CD44 Introduction
Le CD44 est une glycoprotéine transmembranaire également appelée P-glycoprotéine 1. Il est codé par un seul gène sur le locus chromosomique 11p13 (Underhill, 1992 ; Iczkowski, 2010). La CD44 est exprimée de manière ubiquitaire dans tout le corps et a un poids moléculaire de 85-200 kDa (Basakran, 2015). Le CD44 standard (sCD44) est la forme conservée avec un poids moléculaire d’environ 85-90 kDa protéine qui est faite de la transcription des exons 1-5 et 16-20 qui sont épissés ensemble (Rall et Rustgi, 1995 ; Rudzki et Jothy, 1997). Les principaux domaines de la CD44 sont le domaine extracellulaire (ou ectodomaine), le domaine transmembranaire et le domaine intracellulaire/cytoplasmique (Iczkowski, 2010). Le domaine extracellulaire interagit avec le microenvironnement externe et détecte les stimuli dans le microenvironnement externe (Underhill, 1992). Le domaine transmembranaire permet d’interagir avec des cofacteurs et des protéines adaptatrices et de diriger la localisation des lymphocytes (Underhill, 1992 ; Williams et al., 2013). Le domaine intracellulaire du CD44 (CD44-ICD) présente une configuration à queue courte et à queue longue, avec des fonctions de localisation nucléaire et de médiation de la transcription (Okamoto et al., 2001 ; Williams et al., 2013). Notre compréhension actuelle du double rôle de CD44 dans la progression du cancer est résumée dans la figure 1 ci-dessous.
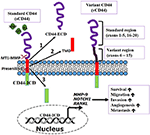
Figure 1. Fonction du récepteur transmembranaire CD44. Le CD44, un récepteur multifonctionnel peut contrôler les fonctions biologiques impliquées dans la dissémination des cellules cancéreuses et les métastases. Le CD44 peut être clivé séquentiellement par la métalloprotéase matricielle de type 1 de la membrane (MT1-MMP) puis par la préséniline-1/γ sécrétase induite par la liaison des ligands. Le clivage produit (1) un fragment du domaine extracellulaire (ECD). (2) un peptide similaire au CD44β ou domaine transmembranaire (TMD), et (3) un fragment de domaine intracellulaire CD44 (ICD). Le CD44-ICD se transloque dans le noyau pour activer la transcription de gènes importants pour les métastases et la survie cellulaire. Adapté de Thorne et al., 2004.
Isoformes de CD44
De multiples isoformes de CD44 peuvent être générées en raison de l’insertion d’exons alternatifs à des sites spécifiques du domaine extracellulaire (Cichy et Puré, 2003). Les isoformes variantes de CD44 (CD44v) comprennent l’exon 6-15 épissé à différents sites entre les exons 5 et 16 de l’isoforme standard (Goodison et al., 1999 ; Zeilstra et al., 2014). L’expression d’isoformes CD44 distinctes semble être nécessaire à la progression des tumeurs humaines (Günthert et al., 1995 ; Wang et al., 2009). Une ou plusieurs variantes d’épissage et la CD44 standard peuvent être exprimées dans les cellules cancéreuses. Il existe une probabilité accrue d’exprimer des isoformes plus importantes comme celle de CD44v8-10 dans les cancers du pancréas (Rall et Rustgi, 1995) et de CD44v6 dans le cancer colorectal (Yamane et al., 1999). L’expression de CD44v6 est bien connue comme un marqueur utile de la progression tumorale et du pronostic dans le cancer colorectal (Yamane et al., 1999). Dans les surnageants de culture de lignées cellulaires de cancer de la prostate dérivées de métastases osseuses (PC3), le CD44 soluble et l’isoforme variante 6 (v6) ont été identifiés, mais pas dans la lignée cellulaire de cancer de la prostate métastatique au niveau des ganglions lymphatiques (LNCaP, Stevens et al., 1996 ; Desai et al., 2009 ; Gupta et al., 2012). Le passage du CD44 standard au CD44v6 a amélioré la survie et l’adhésion des cellules de cancer de la prostate (PC3) (Gupta et al., 2013b). L’expression de CD44v6 dans le cancer colorectal est renforcée par l’expression des cellules souches cancéreuses (Todaro et al., 2014).
Expression de CD44 dans les cellules normales et tumorales
La molécule de surface cellulaire transmembranaire ubiquitaire CD44 est largement distribuée dans les tissus adultes et fœtaux normaux. L’isoforme standard de CD44 a été isolée à l’origine des cellules hématopoïétiques, mais on la trouve maintenant dans une variété de tissus, par exemple le système nerveux central, les poumons et l’épiderme. En comparaison, la distribution des isoformes variantes de CD44 est restreinte et exprimée sur une sélection de cellules épithéliales (Sneath et Mangham, 1998). Les isoformes à distribution restreinte et à séquence d’exon peuvent avoir des fonctions différentes par rapport à l’isoforme standard de CD44. Les kératinocytes, les macrophages et certaines cellules épithéliales expriment la variante de l’isoforme CD44 (CD44v) et sont présents dans les tissus à divers stades de développement (Sneath et Mangham, 1998). Dans les tissus normaux, l’importance de CD44 est vitale dans la régulation du métabolisme hyaluronique, l’activation des lymphocytes et la libération de cytokines. Cependant, le ciblage du CD44 entraînant sa perte conduit à la perturbation du métabolisme hyaluronique, de la cicatrisation et de la prolifération des kératinocytes (Yu et Stamenkovic, 1999). Parmi les nombreuses fonctions du CD44, l’une d’entre elles est de rendre des lignées cellulaires non métastatiques plus métastatiques (Heider et al., 1993). Les détails qui confèrent au CD44 un potentiel métastatique dans les malignités humaines font l’objet d’une élucidation plus poussée. Les cellules prostatiques bénignes expriment davantage les isoformes de la variante 5 de CD44 (CD44v5), tandis que les cellules prostatiques néoplasiques expriment des niveaux plus élevés de CD44s (Dhir et al., 1997 ; Desai et al., 2009 ; Gupta et al., 2013a). Diverses cellules cancéreuses du sein présentent une expression anormale de CD44, y compris des isoformes de CD44 exprimant de manière hétérogène (Basakran, 2015).
Interaction récepteur-ligand de CD44
Le CD44 est connu pour interagir avec divers ligands et cette interaction est cruciale pour ses nombreuses fonctions cellulaires (Goodison et al., 1999). Il existe plusieurs ligands bien connus de la CD44, notamment l’acide hyaluronique (HA), l’ostéopontine (OPN), les collagènes et les métalloprotéinases matricielles (MMP) (Goodison et al., 1999). Les effets du CD44 sur la migration et la croissance cellulaire dépendent de sa spécificité aux ligands (Weber et al., 1996).
Hyaluronan (HA)
L’HA est un glycosaminoglycane qui est un composant ubiquitaire de la membrane extracellulaire. Il est considéré comme le principal ligand du CD44 et peut lier les isoformes CD44v qui sont exprimées de manière ubiquitaire. En se liant au CD44, l’HA peut activer le cytosquelette et la signalisation des métalloprotéinases matricielles (MMP) impliquées dans la progression tumorale (Bourguignon et al., 2014). Plusieurs régions du domaine cytoplasmique de CD44 peuvent favoriser l’amélioration de la liaison de l’HA, cependant, le rôle du domaine cytoplasmique dans la médiation de la liaison ne nécessite pas une séquence d’acides aminés spécifique dans les cellules de lymphome T (Perschl et al., 1995). L’HA peut exister sous forme de poids moléculaire élevé ou de faible poids moléculaire en raison de son clivage en différentes tailles. Dans les lignées cellulaires du cancer du sein, l’HA de haut poids moléculaire est impliqué dans la tumorigenèse, les réponses antiangiogéniques et anti-inflammatoires. Cependant, il a été démontré que l’HA de faible poids moléculaire favorise la motilité cellulaire, le clivage du CD44 et l’angiogenèse. Par conséquent, la taille du ligand HA est importante pour la fonction biologique (Louderbough et Schroeder, 2011).
Osteopontin (OPN)
Plusieurs études ont démontré une expression élevée de l’OPN dans les cancers humains métastatiques hautement invasifs (Tuck et al., 2007). Les intégrines αvβ3 et CD44 sont des récepteurs de l’OPN et peuvent interagir avec l’αvβ3 par le biais de sa séquence de liaison cellulaire fonctionnelle arginine-glycine-acide aspartique (RGD) (Thalmann et al., 1999 ; Desai et al., 2007). La croissance et la progression du cancer de la prostate sont médiées par la signalisation paracrine et autocrine de l’OPN (Thalmann et al., 1999). L’interaction CD44-OPN induit la migration des cellules hors de la circulation sanguine vers les sites d’inflammation. La migration des cellules et l’invasion ultérieure de sites distants impliquent une séquence complexe d’événements (Weber et al., 1996). Les isoformes variants de CD44 se lient à l’OPN indépendamment des séquences RGD présentes dans le domaine N-terminal de CD44 (Katagiri et al., 1999). La liaison de l’OPN aux variantes de CD44/à l’intégrine contenant du bêta1 favorise la propagation, la motilité et le comportement chimiotactique des cellules dans le carcinome pancréatique de rat (Katagiri et al., 1999). L’OPN augmente l’expression de surface du CD44 standard (sCD44) dans les ostéoclastes et des isoformes sCD44 et variantes dans les mélanomes humains et les cellules PC3 (Chellaiah et al., 2003 ; Samanna et al., 2006 ; Desai et al., 2007). La régulation par l’ostéopontine de l’expression de surface de CD44v6 et de sCD44 a été observée dans des cellules de cancer du sein et de cancer hépatocellulaire (Gao et al., 2003 ; Khan et al., 2005).
Métalloprotéases matricielles (MMPs)
Les métalloprotéases matricielles (MMPs) sont des protéines importantes de la matrice extracellulaire qui sont impliquées dans la dégradation de la matrice extracellulaire. Elles sont également importantes pendant le développement, la cicatrisation des plaies, la résorption osseuse et l’angiogenèse (Paiva et Granjeiro, 2014). Il existe des preuves suggérant que MMP-9 et CD44 s’associent dans les cellules tumorales de souris et d’humains, ce qui entraîne la localisation de l’activité de MMP9 à la surface des cellules (Yu et Stamenkovic, 1999 ; Gupta et al., 2013a). L’interaction de CD44 et de la forme protéolytique de MMP-9 est particulièrement impliquée dans l’invasion des cellules cancéreuses de la prostate (PC3) dérivées de métastases osseuses (Desai et al., 2007). Par conséquent, la capacité du CD44 à localiser la MMP-9 protéolytiquement active à la surface des cellules tumorales est importante pour l’invasion tumorale (Yu et Stamenkovic, 1999).
Rôle du CD44 dans la migration/invasion, l’angiogenèse et les métastases osseuses
Migration et invasion
Le récepteur CD44 a le potentiel d’intégrer des activités adhésives et de signalisation pour moduler les processus de migration/invasion au cours de la progression du cancer (Lokeshwar et al, 1995). Les mécanismes par lesquels les récepteurs CD44 médient la migration, la prolifération et la survie des cellules tumorales par le biais de la signalisation médiée par l’HA ont été largement étudiés (Bourguignon et al., 1998, 2001, 2004 ; Kuniyasu et al., 2001 ; Wang et Bourguignon, 2006a,b ; Wang et al., 2009). Les changements de forme des cellules et la formation de structures adhésives sont régis par la régulation dynamique du cytosquelette d’actine. La régulation dynamique du cytosquelette d’actine et les structures spécialisées impliquées dans la migration sont régulées par la localisation temporelle et spatiale des protéines de liaison à l’actine (Chellaiah et al., 2000 ; Linder et Aepfelbacher, 2003 ; Desai et al., 2008). L’expression de surface de CD44 et son interaction avec la métalloprotéinase 9 (MMP9) à la surface de la cellule entraînent la sécrétion de MMP9 active, la migration et l’invasion des cellules PC3 (Desai et al., 2007, 2008 ; Gupta et al., 2013a). La perturbation de l’interaction CD44/MMP9 à la surface des cellules réduit la migration et l’invasion des cellules PC3. Lorsque MMP9 est éliminé, l’expression de CD44 passe à la variante 6 (v6) de l’isoforme. Il en résulte un phénotype moins invasif en raison du manque d’expression de sCD44 et de l’incapacité à former des invadopodes (Gupta et al., 2013a). L’expression de CD44v6 est inversement corrélée au stade pathologique et à la progression de la maladie et positivement corrélée à la survie sans PSA dans le cancer de la prostate (Ekici et al., 2002). Cependant, il a été démontré que l’expression de CD44v6 dans des cellules non métastatiques de carcinome de rat les transforme en cellules métastatiques et favorise la progression de la tumeur (Günthert et al., 1991 ; Seiter et al., 1993). En outre, il a été démontré que le CD44v3 régulait à la hausse la fonction du cytosquelette par l’intermédiaire de l’ankyrine pour activer le complexe contractile de l’actomyosine afin de médier la migration cellulaire dans la lignée cellulaire du carcinome squameux de la tête et du cou. La transfection de l’ADNc v3 dans des lignées cellulaires qui ne l’expriment pas a également entraîné une augmentation significative de la migration cellulaire mais pas de la prolifération (Franzmann et al., 2001 ; Wang et al., 2007). Il a également été démontré que les variants de CD44 fonctionnent comme un corécepteur pour l’activation de récepteurs tyrosine kinases tumoraux favorisant la croissance (Orian-Rousseau et al., 2002, 2007).
Angiogenèse
La formation de nouveaux vaisseaux sanguins (angiogenèse) est nécessaire pour que les cellules tumorales se disséminent et migrent vers des organes distants. Des études antérieures ont identifié l’expression du CD44 sur les cellules endothéliales (Liesveld et al., 1994 ; Xu et al., 1994) et celui-ci contrôle la formation des vaisseaux sanguins (Trochon et al., 1996 ; Savani et al., 2001). L’inhibition du CD44 entraîne donc une altération de la formation de réseaux vasculaires (Savani et al., 2001 ; Cao et al., 2006). Les cellules endothéliales ont été trouvées en nombre accru dans les tissus du cancer de la prostate par rapport aux tissus normaux (Wang et al., 2013). Lorsque des souris sans CD44 ont été utilisées pour étudier les réponses angiogéniques in vivo, la cicatrisation des plaies et la vascularisation étaient toutes deux altérées dans les implants de matrigel. Par conséquent, la formation de métastases est également liée à l’expression de CD44 dans les vaisseaux (Cao et al., 2006). L’adhésion des cellules cancéreuses au système vasculaire et l’expression accrue du CD44 (CD44s et/ou CD44v) par les facteurs angiogéniques (par exemple, le VEGF) produits par les cellules tumorales pourraient faciliter l’extravasation via l’angiogenèse. En outre, le rôle de CD44 dans l’angiogenèse tumorale est renforcé par sa liaison à l’HA immobilisée (Griffioen et al., 1997). Il a été démontré que les variantes de CD44 possèdent des domaines de liaison pour divers facteurs de croissance, notamment le facteur de croissance endothélial vasculaire (VEGF), le facteur de croissance basique des fibroblastes se liant à l’héparine et le facteur de croissance épidermique se liant à l’héparine (Bourguignon et al., 1998, 1999 ; Kalish et al., 1999). L’analyse de microréseaux tissulaires et de lysats de cellules tumorales prostatiques a montré que l’expression de l’OPN et du VEGF était plus prononcée dans le cancer de la prostate que dans les tissus prostatiques bénins ou normaux. Il a été suggéré qu’une augmentation du nombre de micro-vaisseaux et de l’expression de CD44 pourrait être des marqueurs diagnostiques utiles des métastases du cancer du sein (Ozer et al., 1997).
Métastases osseuses
La capacité des cellules cancéreuses du sein et de la prostate à métastaser dans les os repose sur leur capacité à s’arrêter sur l’endothélium de la moelle osseuse, à y adhérer et à s’extravertir à travers celui-ci dans la matrice osseuse sous-jacente (Draffin et al., 2003). Dans les cellules cancéreuses de la prostate, l’adhésion sélective de ces cellules à l’épithélium de la moelle osseuse repose sur le rôle des propriétés adhésives des récepteurs des intégrines. Les cellules cancéreuses de la prostate ont été impliquées dans une forte interaction avec les cellules endothéliales de la moelle osseuse (Draffin et al., 2004). Il existe actuellement une dissension entre les données cliniques et expérimentales dans la littérature concernant l’importance de la sCD44 dans la progression de la maladie du cancer du sein. Une étude récente suggère que les modèles de cancer du sein montrent l’expression des isoformes CD44 standard et variante qui augmentent la progression de la maladie et le comportement métastatique (McFarlane et al., 2015). HA et CD44 se colocalisent dans l’épithélium sinusoïdal de la moelle osseuse, qui est un site de métastases du cancer du sein. Cela suggère la contribution de l’HA-CD44 à l’efficacité des métastases distantes vers les os dans les cellules de cancer du sein (McFarlane et al., 2015). Les cellules produisant de faibles niveaux de CD44 ont une plus faible capacité à former une sphère tumorale in vitro. En outre, CD44 est un marqueur des cellules souches cancéreuses (Jaggupilli et Elkord, 2012 ; Cho et al., 2015 ; Stivarou et Patsavoudi, 2015) et les cellules souches cancéreuses exprimant CD44 augmentent la probabilité de métastases osseuses par son interaction avec HA. Par conséquent, l’interaction CD44-HA pourrait être une cible potentielle pour réduire les métastases osseuses. Il a également été démontré que la signalisation CD44 dans les cellules cancéreuses de la prostate régulait des protéines clés (c’est-à-dire RANKL et MMP9) impliquées dans la différenciation des ostéoclastes et les métastases tumorales (Gupta et al., 2012). Runx2 est un facteur de transcription principal qui joue un rôle important dans la différenciation des ostéoblastes. La transcription de nombreux facteurs liés aux ostéoblastes et à la formation osseuse, tels que l’OPN, l’ostéocalcine et le collagène de type I, est régulée par Runx2 (Akech et al., 2010).
Rôle du CD44 en tant que facteur transcriptionnel
Le clivage protéolytique qui se produit au niveau du domaine extracellulaire libérant le CD44 soluble est reconnu depuis longtemps. Cependant, des études récentes ont montré que le CD44 peut subir un autre traitement protéolytique séquentiel par les métalloprotéases matricielles de type 1 de la membrane (MT1-MMP) et la préséniline-1/y-secrétase pour produire les fragments du domaine extracellulaire et du domaine intracellulaire (DIC). Le clivage par la préséniline-1/y-secrétase se produit au niveau du site intramembranaire, libérant deux produits de clivage de ~25 et ~16 kDa. Le CID de 12 kDa se transloque vers le noyau pour activer la transcription de plusieurs protéines, dont la CD44 elle-même (Okamoto et al., 2001 ; Nagano et Saya, 2004 ; Thorne et al., 2004). Par conséquent, si ce clivage peut être inhibé par des inhibiteurs de métalloprotéases, il peut servir de moyen thérapeutique pour prévenir la progression des tumeurs et les métastases (Nagano et Saya, 2004). La translocation du CD44-ICD vers le noyau initie le processus de régulation transcriptionnelle via sa liaison à un nouvel élément de réponse du promoteur, régulant ainsi la transcription de plusieurs gènes impliqués dans la survie cellulaire en cas de stress, d’inflammation, de glycolyse oxydative et d’invasion tumorale (Okamoto et al., 2001 ; Miletti-González et al., 2012). Cela suggère un mécanisme pour le rôle multifonctionnel de CD44 dans les métastases et le métabolisme des cellules cancéreuses (Miletti-González et al., 2012). La translocation nucléaire du domaine intracellulaire a également montré qu’elle interagissait avec les facteurs de la souche (Cho et al., 2015). CD44-ICD est lié à la régulation du gène MMP-9 dans les cellules cancéreuses de la prostate et du sein par son interaction avec le facteur de transcription RUNX2 (Miletti-González et al., 2012).
Conclusions
La glycoprotéine multifonctionnelle CD44 peut subir des événements d’épissage alternatif pour produire des isoformes variantes de CD44 qui sont plus restreintes dans leur distribution par rapport aux isoformes standard de CD44 (Rall et Rustgi, 1995). Cette protéine de surface cellulaire exprimée de façon ubiquitaire est principalement impliquée dans l’agrégation, la migration et l’activation des cellules, ces fonctions étant médiées par les propriétés adhésives du CD44 (Heider et al., 1993). Initialement décrite pour les cellules souches hématopoïétiques, elle a depuis été confirmée comme marqueur des cellules souches cancéreuses (Bourguignon et al., 1998). Le CD44 interagit avec une variété de ligands et peut subir un traitement protéolytique séquentiel aboutissant à la génération du CD44-ICD. On sait que le CD44-ICD se transloque dans le noyau pour activer la transcription des gènes (Okamoto et al., 1999). Bien que les informations fournies ici constituent une revue complète de la littérature jusqu’à présent, il existe un certain discours sur l’effet du DIC comme principal modulateur des événements métastatiques dans les cancers. Pour étayer davantage l’effet de CD44 dans les métastases, des recherches sur les spécificités devront être complétées pour répondre à cette question.
Contributions des auteurs
LS et MC ont rédigé le manuscrit et ont contribué de manière égale à l’édition et à la réécriture du contenu final.
Financement
Ce travail a été soutenu par une subvention de recherche à MC de l’Institut national de la santé – Institut national de l’arthrite et des maladies musculo-squelettiques et cutanées (5R01AR066044).
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Akech, J.., Wixted, J. J., Bedard, K., van der Deen, M., Hussain, S., Guise, T. A., et al. (2010). Association de Runx2 avec la progression du cancer de la prostate chez les patients : mécanismes médiateurs de l’ostéolyse osseuse et des lésions métastatiques ostéoblastiques. Oncogene 29, 811-821. doi : 10.1038/onc.2009.389
PubMed Abstract | CrossRef Full Text | Google Scholar
Basakran, N. S. (2015). CD44 comme un marqueur de tumeur diagnostique potentiel. Saudi Med. J. 36, 273-279. doi : 10.15537/smj.2015.3.9622
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Gunja-Smith, Z., Iida, N., Zhu, H. B., Young, L. J., Muller, W. J., et al. (1998). CD44v(3,8-10) est impliqué dans la migration des cellules tumorales médiée par le cytosquelette et l’association de la métalloprotéinase matricielle (MMP-9) dans les cellules métastatiques du cancer du sein. J. Cell. Physiol. 176, 206-215. doi : 10.1002/(SICI)1097-4652(199807)176:1<206::AID-JCP22>3.0.CO;2-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Shiina, M., et Li, J. J. (2014). L’interaction Hyaluronan-CD44 favorise la signalisation oncogénique, les fonctions des microARN, la chimiorésistance et la résistance aux radiations dans les cellules souches cancéreuses conduisant à la progression tumorale. Adv. Cancer Res. 123, 255-275. doi : 10.1016/B978-0-12-800092-2.00010-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Singleton, P. A., Diedrich, F., Stern, R., et Gilad, E. (2004). L’interaction de CD44 avec l’échangeur Na+-H+ (NHE1) crée des microenvironnements acides conduisant à l’activation de la hyaluronidase-2 et de la cathepsine B et à l’invasion des cellules tumorales du sein. J. Biol. Chem. 279, 26991-27007. doi : 10.1074/jbc.M311838200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Zhu, H., Shao, L., et Chen, Y. W. (2001). L’interaction de CD44 avec la kinase c-Src favorise la fonction du cytosquelette médiée par la cortactine et la migration des cellules tumorales ovariennes dépendante de l’acide hyaluronique. J. Biol. Chem. 276, 7327-7336. doi : 10.1074/jbc.M006498200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Zhu, H., Shao, L., Zhu, D., et Chen, Y. W. (1999). La rho-kinase (ROK) favorise l’interaction CD44v(3,8-10)-ankyrine et la migration des cellules tumorales dans les cellules métastatiques du cancer du sein. Cell Motil. Cytoskeleton 43, 269-287. doi : 10.1002/(SICI)1097-0169(1999)43:4<269::AID-CM1>3.0.CO;2-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Cao, G., Savani, R. C., Fehrenbach, M., Lyons, C., Zhang, L., Coukos, G., et al. (2006). Involvement of endothelial CD44 during in vivo angiogenesis. Am. J. Cathol. 169, 325-336. doi : 10.2353/ajpath.2006.060206
PubMed Abstract | CrossRef Full Text | Google Scholar
Chellaiah, M. A., Kizer, N., Biswas, R., Alvarez, U., Strauss-Schoenberger, J., Rifas, L., et al. (2003). Osteopontin deficiency produces osteoclast dysfunction due to reduced CD44 surface expression. Mol. Biol. Cell 14, 173-189. doi : 10.1091/mbc.E02-06-0354
PubMed Abstract | CrossRef Full Text | Google Scholar
Chellaiah, M., Kizer, N., Silva, M., Alvarez, U., Kwiatkowski, D., et Hruska, K. A. (2000). Gelsolin deficiency blocks podosome assembly and produces increased bone mass and strength. J. Cell Biol. 148, 665-678. doi : 10.1083/jcb.148.4.665
PubMed Abstract | CrossRef Full Text | Google Scholar
Cho, Y., Lee, H. W., Kang, H. G., Kim, H. Y., Kim, S. J., and Chun, K. H. (2015). Le domaine intracellulaire de CD44 clivé soutient l’activation des facteurs de stemness et favorise la tumorigenèse du cancer du sein. Oncotarget 6, 8709-8721. doi : 10.18632/oncotarget.3325
PubMed Abstract | CrossRef Full Text | Google Scholar
Cichy, J., et Puré, E. (2003). La libération de CD44. J. Cell Biol. 161, 839-843. doi : 10.1083/jcb.200302098
PubMed Abstract | CrossRef Full Text | Google Scholar
Desai, B., Ma, T., et Chellaiah, M. A. (2008). Invadopodia et dégradation de la matrice, une nouvelle propriété des cellules cancéreuses de la prostate pendant la migration et l’invasion. J. Biol. Chem. 283, 13856-13866. doi : 10.1074/jbc.M709401200
PubMed Abstract | CrossRef Full Text | Google Scholar
Desai, B., Ma, T., Zhu, J., et Chellaiah, M. A. (2009). Caractérisation de l’expression de la variante et de la norme CD44 dans les cellules cancéreuses de la prostate : identification du mécanisme moléculaire possible de la formation du complexe CD44/MMP9 à la surface des cellules. J. Cell. Biochem. 108, 272-284. doi : 10.1002/jcb.22248
PubMed Abstract | CrossRef Full Text | Google Scholar
Desai, B., Rogers, M. J., et Chellaiah, M. A. (2007). Mécanismes de l’ostéopontine et du CD44 comme principes métastatiques dans les cellules du cancer de la prostate. Mol. Cancer 6:18. doi : 10.1186/1476-4598-6-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Dhir, R., Gau, J. T., Krill, D., Bastacky, S., Bahnson, R. R., Cooper, D. L., et al. (1997). Expression de CD44 dans les prostates humains bénins et néoplasiques. Mol. Diagn. 2, 197-204. doi : 10.1016/S1084-8592(97)80029-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Draffin, J. E., Hill, A., Johnston, P. G., and Waugh, D. J. (2003). L’expression du CD44 sur les cellules cancéreuses de la prostate est en corrélation avec l’adhésion aux cellules endothéliales de la moelle osseuse. Clin. Cancer Res. 9, 6181S-6181S.
Google Scholar
Draffin, J. E., McFarlane, S., Hill, A., Johnston, P. G., and Waugh, D. J. (2004). CD44 potentialise l’adhérence des cellules métastatiques du cancer de la prostate et du sein aux cellules endothéliales de la moelle osseuse. Cancer Res. 64, 5702-5711. doi : 10.1158/0008-5472.CAN-04-0389
PubMed Abstract | CrossRef Full Text | Google Scholar
Ekici, S., Ayhan, A., Kendi, S., et Ozen, H. (2002). Détermination du pronostic chez les patients atteints de cancer de la prostate traités par prostatectomie radicale : valeur pronostique du score CD44v6. J. Urol. 167, 2037-2041. doi : 10.1016/S0022-5347(05)65078-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Franzmann, E. J., Weed, D. T., Civantos, F. J., Goodwin, W. J., and Bourguignon, L. Y. (2001). A novel CD44 v3 isoform is involved in head and neck squamous cell carcinoma progression. Otolaryngol. Head Neck Surg. 124, 426-432. doi : 10.1067/mhn.2001.114674
PubMed Abstract | CrossRef Full Text | Google Scholar
Gao, C., Guo, H., Downey, L., Marroquin, C., Wei, J., et Kuo, P. C. (2003). Osteopontin-dependent CD44v6 expression and cell adhesion in HepG2 cells. Carcinogenesis 24, 1871-1878. doi : 10.1093/carcin/bgg139
PubMed Abstract | CrossRef Full Text | Google Scholar
Goodison, S., Urquidi, V., and Tarin, D. (1999). CD44 molécules d’adhésion cellulaire. Mol. Pathol. 52, 189-196. doi : 10.1136/mp.52.4.189
PubMed Abstract | CrossRef Full Text | Google Scholar
Griffioen, A. W., Coenen, M. J., Damen, C. A., Hellwig, S. M., van Weering, D. H., Vooys, W., et al. (1997). CD44 est impliqué dans l’angiogenèse tumorale ; un antigène d’activation sur les cellules endothéliales humaines. Blood 90, 1150-1159.
PubMed Abstract | Google Scholar
Günthert, U., Hofmann, M., Rudy, W., Reber, S., Zöller, M., Haussmann, I., et al. (1991). A new variant of glycoprotein CD44 confers metastatic potential to rat carcinoma cells. Cell 65, 13-24. doi : 10.1016/0092-8674(91)90403-L
PubMed Abstract | CrossRef Full Text | Google Scholar
Günthert, U., Stauder, R., Mayer, B., Terpe, H. J., Finke, L., and Friedrichs, K. (1995). Are CD44 variant isoforms involved in human tumour progression ? Cancer Surv. 24, 19-42.
PubMed Abstract | Google Scholar
Gupta, A., Cao, W., et Chellaiah, M. A. (2012). Les voies Integrin αvβ3 et CD44 dans les cellules cancéreuses métastatiques de la prostate soutiennent l’ostéoclastogenèse via un axe de signalisation Runx2/Smad 5/récepteur activateur de NF-κB ligand. Mol. Cancer 11:66. doi : 10.1186/1476-4598-11-66
PubMed Abstract | CrossRef Full Text | Google Scholar
Gupta, A., Cao, W., Sadashivaiah, K., Chen, W., Schneider, A., et Chellaiah, M. A. (2013a). Phénotype cellulaire non invasif prometteur dans les cellules du cancer de la prostate knockdown de la métalloprotéinase matricielle 9. ScientificWorldJournal 2013:493689. doi : 10.1155/2013/493689
PubMed Abstract | CrossRef Full Text | Google Scholar
Gupta, A., Zhou, C. Q., et Chellaiah, M. A. (2013b). Ostéopontine et MMP9 : associations avec l’expression/sécrétion du VEGF et l’angiogenèse dans les cellules cancéreuses de la prostate PC3. Cancers 5, 617-638. doi : 10.3390/cancers5020617
PubMed Abstract | CrossRef Full Text | Google Scholar
Heider, K. H., Hofmann, M., Hors, E., van den Berg, F., Ponta, H., Herrlich, P., et al. (1993). A human homologue of the rat metastasis-associated variant of CD44 is expressed in colorectal carcinomas and adenomatous polyps. J. Cell Biol. 120, 227-233. doi : 10.1083/jcb.120.1.227
PubMed Abstract | CrossRef Full Text | Google Scholar
Iczkowski, K. A. (2010). Molécule d’adhésion cellulaire CD44 : ses rôles fonctionnels dans le cancer de la prostate. Am. J. Transl. Res. 3, 1-7.
PubMed Abstract | Google Scholar
Jaggupilli, A., et Elkord, E. (2012). Signification de CD44 et CD24 comme marqueurs de cellules souches cancéreuses : une ambiguïté persistante. Clin. Dev. Immunol. 2012:708036. doi : 10.1155/2012/708036
PubMed Abstract | CrossRef Full Text | Google Scholar
Kalish, E. D., Iida, N., Moffat, F. L., et Bourguignon, L. Y. (1999). Une nouvelle isoforme contenant le CD44V3 est impliquée dans la croissance et la migration des cellules tumorales pendant la progression du carcinome mammaire humain. Front. Biosci. 4, A1-A8. doi : 10.2741/Kalish
PubMed Abstract | CrossRef Full Text | Google Scholar
Katagiri, Y. U., Sleeman, J., Fujii, H., Herrlich, P., Hotta, H., Tanaka, K., et al. (1999). Les variantes de CD44, mais pas les CD44, coopèrent avec les intégrines contenant des bêta1 pour permettre aux cellules de se lier à l’ostéopontine indépendamment de l’acide arginine-glycine-aspartique, stimulant ainsi la motilité et la chimiotaxie des cellules. Cancer Res. 59, 219-226.
Google Scholar
Khan, S. A., Cook, A. C., Kappil, M., Günthert, U., Chambers, A. F., Tuck, A. B., et al. (2005). Enhanced cell surface CD44 variant (v6, v9) expression by osteopontin in breast cancer epithelial cells facilitates tumor cell migration : nouvelle régulation post-transcriptionnelle et post-traductionnelle. Clin. Exp. Metastasis 22, 663-673. doi : 10.1007/s10585-006-9007-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuniyasu, H., Oue, N., Tsutsumi, M., Tahara, E., et Yasui, W. (2001). Le sulfate d’héparine améliore l’invasion par les lignées cellulaires de carcinome du côlon humain par l’expression de la variante exon 3 de CD44. Clin. Cancer Res. 7, 4067-4072.
PubMed Abstract | Google Scholar
Liesveld, J. L., Frediani, K. E., Harbol, A. W., DiPersio, J. F., and Abboud, C. N. (1994). Characterization of the adherence of normal and leukemic CD34+ cells to endothelial monolayers. Leukemia 8, 2111-2117.
PubMed Abstract | Google Scholar
Linder, S., et Aepfelbacher, M. (2003). Podosomes : points chauds d’adhésion des cellules invasives. Trends Cell Biol. 13, 376-385. doi : 10.1016/S0962-8924(03)00128-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lokeshwar, B. L., Lokeshwar, V. B., and Block, N. L. (1995). Expression de CD44 dans les cellules du cancer de la prostate : association avec la prolifération cellulaire et le potentiel invasif. Anticancer Res. 15, 1191-1198.
PubMed Abstract | Google Scholar
Louderbough, J. M., et Schroeder, J. A. (2011). Comprendre la double nature de CD44 dans la progression du cancer du sein. Mol. Cancer Res. 9, 1573-1586. doi : 10.1158/1541-7786.MCR-11-0156
PubMed Abstract | CrossRef Full Text | Google Scholar
McFarlane, S., Coulter, J. A., Tibbits, P., O’Grady, A., McFarlane, C., Montgomery, N., et al. (2015). CD44 augmente l’efficacité des métastases à distance du cancer du sein. Oncotarget 6, 11465-11476. doi : 10.18632/oncotarget.3410
PubMed Abstract | CrossRef Full Text | Google Scholar
Miletti-González, K. E., Murphy, K., Kumaran, M. N., Ravindranath, A. K., Wernyj, R. P., Kaur, S., et al. (2012). Identification de la fonction du domaine intracytoplasmique CD44 (CD44-ICD) : modulation de la transcription de la métalloprotéinase matricielle 9 (MMP-9) via un nouvel élément de réponse du promoteur. J. Biol. Chem. 287, 18995-19007. doi : 10.1074/jbc.M111.318774
PubMed Abstract | CrossRef Full Text | Google Scholar
Nagano, O., et Saya, H. (2004). Mécanisme et signification biologique du clivage de CD44. Cancer Sci. 95, 930-935. doi : 10.1111/j.1349-7006.2004.tb03179.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Okamoto, I., Kawano, Y., Murakami, D., Sasayama, T., Araki, N., Miki, T., et al. (2001). Libération protéolytique du domaine intracellulaire de la CD44 et son rôle dans la voie de signalisation de la CD44. J. Cell Biol. 155, 755-762. doi : 10.1083/jcb.200108159
PubMed Abstract | CrossRef Full Text | Google Scholar
Okamoto, I., Kawano, Y., Tsuiki, H., Sasaki, J., Nakao, M., Matsumoto, M., et al. (1999). CD44 cleavage induced by a membrane-associated metalloprotease plays a critical role in tumor cell migration. Oncogene 18, 1435-1446. doi : 10.1038/sj.onc.1202447
PubMed Abstract | CrossRef Full Text | Google Scholar
Orian-Rousseau, V., Chen, L., Sleeman, J. P., Herrlich, P., and Ponta, H. (2002). CD44 est nécessaire pour deux étapes consécutives dans la signalisation HGF/c-Met. Genes Dev. 16, 3074-3086. doi : 10.1101/gad.242602
PubMed Abstract | CrossRef Full Text | Google Scholar
Orian-Rousseau, V., Morrison, H., Matzke, A., Kastilan, T., Pace, G., Herrlich, P., et al. (2007). Hepatocyte growth factor-induced Ras activation requires ERM proteins linked to both CD44v6 and F-actin. Mol. Biol. Cell 18, 76-83. doi : 10.1091/mbc.E06-08-0674
PubMed Abstract | CrossRef Full Text | Google Scholar
Ozer, E., Canda, T., et Kurtodlu, B. (1997). Le rôle de l’angiogenèse, de la laminine et de l’expression de CD44 dans le comportement métastatique des carcinomes mammaires invasifs de bas grade à un stade précoce. Cancer Lett. 121, 119-123. doi : 10.1016/S0304-3835(97)00346-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Paiva, K. B., et Granjeiro, J. M. (2014). Remodelage et développement du tissu osseux : focus sur les fonctions des métalloprotéinases matricielles. Arch. Biochem. Biophys. 561, 74-87. doi : 10.1016/j.abb.2014.07.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Perschl, A., Lesley, J., English, N., Trowbridge, I., et Hyman, R. (1995). Rôle du domaine cytoplasmique de CD44 dans la liaison de hyaluronan. Eur. J. Immunol. 25, 495-501. doi : 10.1002/eji.1830250228
PubMed Abstract | CrossRef Full Text | Google Scholar
Rall, C. J., et Rustgi, A. K. (1995). Expression de l’isoforme CD44 dans l’adénocarcinome pancréatique primaire et métastatique. Cancer Res. 55, 1831-1835.
PubMed Abstract | Google Scholar
Rudzki, Z., et Jothy, S. (1997). CD44 et l’adhésion des cellules néoplasiques. Mol. Cathol. 50, 57-71. doi : 10.1136/mp.50.2.57
PubMed Abstract | CrossRef Full Text | Google Scholar
Samanna, V., Wei, H., Ego-Osuala, D., et Chellaiah, M. A. (2006). La signalisation alpha-V-dépendante outside-in est nécessaire pour la régulation de l’expression de surface de CD44, la sécrétion de MMP-2 et la migration cellulaire par l’ostéopontine dans les cellules de mélanome humain. Exp. Cell Res. 312, 2214-2230. doi : 10.1016/j.yexcr.2006.03.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Savani, R. C., Cao, G., Pooler, P. M., Zaman, A., Zhou, Z., et DeLisser, H. M. (2001). Differential involvement of the hyaluronan (HA) receptors CD44 and receptor for HA-mediated motility in endothelial cell function and angiogenesis. J. Biol. Chem. 276, 36770-36778. doi : 10.1074/jbc.M102273200
PubMed Abstract | CrossRef Full Text | Google Scholar
Seiter, S., Arch, R., Reber, S., Komitowski, D., Hofmann, M., Ponta, H., et al. (1993). Prevention of tumor metastasis formation by anti-variant CD44. J. Exp. Med. 177, 443-455. doi : 10.1084/jem.177.2.443
PubMed Abstract | CrossRef Full Text | Google Scholar
Sneath, R. J., et Mangham, D. C. (1998). La structure et la fonction normales de CD44 et son rôle dans la néoplasie. Mol. Catholic. 51, 191-200. doi : 10.1136/mp.51.4.191
PubMed Abstract | CrossRef Full Text | Google Scholar
Stevens, J. W., Palechek, P. L., Griebling, T. L., Midura, R. J., Rokhlin, O. W., and Cohen, M. B. (1996). Expression des isoformes de CD44 dans les lignées cellulaires des tumeurs de la prostate humaine. Prostate 28, 153-161. doi : 10.1002/(SICI)1097-0045(199603)28:3153::AID-PROS2>3.0.CO;2-G
PubMed Abstract | CrossRef Full Text | Google Scholar
Stivarou, T., et Patsavoudi, E. (2015). Molécules extracellulaires impliquées dans l’invasion des cellules cancéreuses. Cancers 7, 238-265. doi : 10.3390/cancers7010238
PubMed Abstract | CrossRef Full Text | Google Scholar
Thalmann, G. N., Sikes, R. A., Devoll, R. E., Kiefer, J. A., Markwalder, R., Klima, I., et al. (1999). Osteopontin : possible role in prostate cancer progression. Clin. Cancer Res. 5, 2271-2277.
PubMed Abstract | Google Scholar
Thorne, R. F., Legg, J. W., et Isacke, C. M. (2004). Le rôle des domaines transmembranaires et cytoplasmiques de la CD44 dans la coordination des événements adhésifs et de signalisation. J. Cell Sci. 117(Pt 3), 373-380. doi : 10.1242/jcs.00954
PubMed Abstract | CrossRef Full Text | Google Scholar
Todaro, M., Gaggianesi, M., Catalano, V., Benfante, A., Iovino, F., Biffoni, M., et al. (2014). CD44v6 est un marqueur de cellules souches cancéreuses constitutives et reprogrammées conduisant les métastases du cancer du côlon. Cell Stem Cell 14, 342-356. doi : 10.1016/j.stem.2014.01.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Trochon, V., Mabilat, C., Bertrand, P., Legrand, Y., Smadja-Joffe, F., Soria, C., et al. (1996). Evidence of involvement of CD44 in endothelial cell proliferation, migration and angiogenesis in vitro. Int. J. Cancer 66, 664-668. doi : 10.1002/(SICI)1097-0215(19960529)66:5<664::AID-IJC14>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Tuck, A. B., Chambers, A. F., et Allan, A. L. (2007). Surexpression de l’ostéopontine dans le cancer du sein : connaissances acquises et implications possibles pour la gestion clinique. J. Cell. Biochem. 102, 859-868. doi : 10.1002/jcb.21520
PubMed Abstract | CrossRef Full Text | Google Scholar
Underhill, C. (1992). CD44 : le récepteur de l’hyaluronane. J. Cell. Sci. 103(Pt 2), 293-298.
PubMed Abstract | Google Scholar
Wang, S. J., et Bourguignon, L. Y. (2006a). Hyaluronan et l’interaction entre CD44 et le récepteur du facteur de croissance épidermique dans la signalisation oncogénique et la résistance à la chimiothérapie dans le cancer de la tête et du cou. Arch. Otolaryngol. Head Neck Surg. 132, 771-778. doi : 10.1001/archotol.132.7.771
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, S. J., et Bourguignon, L. Y. (2006b). Le Hyaluronan-CD44 favorise la signalisation Ca2+ médiée par la phospholipase C et la résistance au cisplatine dans le cancer de la tête et du cou. Arch. Otolaryngol. Head Neck Surg. 132, 19-24. doi : 10.1001/archotol.132.1.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, S. J., Wong, G., de Heer, A. M., Xia, W., et Bourguignon, L. Y. (2009). CD44 variant isoformes dans la progression du carcinome épidermoïde de la tête et du cou. Laryngoscope 119, 1518-1530. doi : 10.1002/lary.20506
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, S. J., Wreesmann, V. B., and Bourguignon, L. Y. (2007). Association des isoformes contenant CD44 V3 avec la croissance des cellules tumorales, la migration, l’expression des métalloprotéases matricielles et les métastases des ganglions lymphatiques dans le cancer de la tête et du cou. Head Neck 29, 550-558. doi : 10.1002/hed.20544
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, X., Lee, S. O., Xia, S., Jiang, Q., Luo, J., Li, L., et al. (2013). Les cellules endothéliales renforcent les métastases du cancer de la prostate via les signaux IL-6 → récepteur des androgènes → TGF-β → MMP-9. Mol. Cancer Ther. 12, 1026-1037. doi : 10.1158/1535-7163.MCT-12-0895
PubMed Abstract | CrossRef Full Text | Google Scholar
Weber, G. F., Ashkar, S., Glimcher, M. J., et Cantor, H. (1996). Interaction récepteur-ligand entre CD44 et ostéopontine (Eta-1). Science 271, 509-512. doi : 10.1126/science.271.5248.509
PubMed Abstract | CrossRef Full Text | Google Scholar
Williams, K., Motiani, K., Giridhar, P. V., et Kasper, S. (2013). CD44 intègre la signalisation dans les cellules souches normales, les cellules souches cancéreuses et les niches (pré)métastatiques. Exp. Biol. Med. 238, 324-338. doi : 10.1177/1535370213480714
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, Y., Swerlick, R. A., Sepp, N., Bosse, D., Ades, E. W., et Lawley, T. J. (1994). Characterization of expression and modulation of cell adhesion molecules on an immortalized human dermal microvascular endothelial cell line (HMEC-1). J. Invest. Dermatol. 102, 833-837. doi : 10.1111/1523-1747.ep12382086
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamane, N., Tsujitani, S., Makino, M., Maeta, M., et Kaibara, N. (1999). La variante 6 du CD44 soluble comme indicateur pronostique chez les patients atteints de cancer colorectal. Oncology 56, 232-238. doi : 10.1159/000011970
PubMed Abstract | CrossRef Full Text | Google Scholar
Yu, Q., et Stamenkovic, I. (1999). La localisation de la métalloprotéinase matricielle 9 à la surface des cellules fournit un mécanisme pour l’invasion tumorale médiée par CD44. Genes Dev. 13, 35-48. doi : 10.1101/gad.13.1.35
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeilstra, J., Joosten, S. P., van Andel, H., Tolg, C., Berns, A., Snoek, M., et al. (2014). Les isoformes CD44v des cellules souches favorisent la formation de cancers intestinaux chez les souris Apc(min) en aval de la signalisation Wnt. Oncogene 33, 665-670. doi : 10.1038/onc.2012.611
PubMed Abstract | CrossRef Full Text | Google Scholar
.