Introduction
La résistance croissante aux insecticides et les impacts sur la santé humaine et environnementale ont encouragé l’utilisation de champignons entomopathogènes (EPF) pour le biocontrôle (Inglis et al., 2001). Les environnements tropicaux abritent une biodiversité microbienne impressionnante (Thompson et al., 2017), dont de nombreux parasites d’arthropodes (Mahe et al., 2017). Cependant, les EPF commercialisés de loin les plus courants dans les agroécosystèmes tropicaux et subtropicaux appartiennent à deux genres : Beauveria et Metarhizium (Ascomycota : Hypocreales) (Faria et Wraight, 2007 ; Li et al., 2010 ; Kumar et al., 2018 ; Mascarin et al., 2019). Ici, nous passons en revue la littérature axée sur la lutte contre les ravageurs arthropodes avec des entomopathogènes, en mettant l’accent sur ces deux genres.
Metarhizium et Beauveria ont des distributions pan-globales révélant une diversification génétique importante, avec une large gamme d’insectes hôtes et de vastes niches écologiques (Driver et al., 2000 ; Rehner et Buckley, 2005 ; Zimmermann, 2007). Ainsi, de nombreux aspects de l’utilisation de ces EPF pour lutter contre les ravageurs s’étendent sur les gradients latitudinaux, et nous en discutons de manière générale. Les conditions environnementales et les compositions d’espèces, cependant, peuvent différer grandement entre les régions tropicales et tempérées, de sorte que nous discutons de ces facteurs en nous référant spécifiquement aux études tropicales et en utilisant la théorie générale résultant des systèmes modèles pour combler les lacunes de la littérature actuelle et stimuler d’autres études.
Les EPF sont généralement formulés comme des biopesticides et appliqués en réponse à des épidémies. Cependant, si l’habitat est bien adapté à la souche fongique particulière à l’environnement, il peut être possible pour les applications fongiques de servir de libérations inoculatives, où les EPF restent dans le sol et prévenir les épidémies d’insectes. Ici, nous décrivons les préférences de niche des champignons entomopathogènes pour aider à informer l’utilisation des EPF pour prévenir les épidémies de ravageurs. Nous nous concentrons sur deux espèces, Beauveria bassiana et Metarhizium anisopliae, mais chacune représente très probablement une gamme plus large d’espèces et de souches qui étaient auparavant regroupées. Par conséquent, la majorité des articles cités concernant ces espèces fongiques se réfèrent à Beauveria bassiana et Metarhizium anisopliae sensu lato, en raison des récentes révisions taxonomiques (par exemple, Driver et al., 2000 ; Bidochka et al., 2001 ; Inglis et al, 2019).
Beauveria et Metarhizium
Espèces de champignons entomopathogènes, B. bassiana et M. anisopliae contrôlent un large éventail de ravageurs (Kassa et al., 2004 ; Castrillo et al., 2010 ; Migiro et al., 2010 ; Singha et al., 2010 ; Skinner et al., 2012 ; Akmal et al., 2013 ; Wraight et al., 2016). Ces champignons peuvent également habiter la surface des feuilles de diverses espèces végétales et de divers environnements (Meyling et Eilenberg, 2006a ; Garrido-Jurado et al., 2015), habiter le sol en tant que saprophytes (Evans, 1982) ou se développer de manière endophile (Greenfield et al., 2016). La distribution apparemment large et la diversité des hôtes pathogènes attaqués par ces champignons, et la persistance dans l’environnement lorsque les hôtes sont rares suggèrent une valeur potentielle dans les programmes de lutte intégrée contre les ravageurs à travers divers endroits et conditions (Lacey et al., 2015).
La persistance et l’efficacité des propagules fongiques sur les plantes sont directement influencées par la température, l’humidité, la lumière du soleil et l’activité microbienne sur le phylloplane (Jaronski, 2010). La plupart de nos connaissances proviennent d’études in vitro (Fargues et al., 1997 ; Luz et Fargues, 1997 ; Fargues et Luz, 2000 ; Devi et al., 2005 ; Shin et al., 2017). Cependant, il n’est pas certain que les données in vitro puissent être extrapolées aux conditions de terrain (Keyser et al., 2017), en raison de l’influence de l’environnement sur des processus tels que le potentiel d’infection, la persistance des conidies et les interactions abiotiques et biotiques complexes qui sont rarement reproduites dans les environnements de laboratoire (Inglis et al, 2001 ; Lacey et al., 2015).
Metarhizium et Beauveria colonisent facilement les rhizosphères des plantes, formant des associations endophytiques (Vega et al., 2009 ; Behie et al., 2015). Les espèces de Beauveria s’associent à plusieurs espèces végétales tropicales ou subtropicales, notamment le cacao (Posada et Vega, 2005), le bananier (Akello et al., 2008) et le caféier (Vega, 2008). Après la colonisation endophytique, Metarhizium robertsii peut même transférer l’azote dérivé des insectes aux plantes (Behie et al., 2012). Les affiliations de Beauveria et Metarhizium à des hôtes végétaux dans l’agriculture et les services écosystémiques (c’est-à-dire la symbiose bénéfique dans les plantes et le contrôle des populations d’insectes nuisibles) en font des candidats prometteurs pour leur application comme biopesticides dans l’agriculture tropicale. L’utilisation des EPF comme biopesticides dans une variété d’agroécosystèmes offre des possibilités intéressantes et durables de gestion agricole, mais une connaissance approfondie des espèces fongiques endémiques est cruciale pour identifier les scénarios et les environnements où l’insecte pathogène sera le plus efficace (Meyling et Eilenberg, 2007 ; Meyling et al, 2009 ; Perez-Gonzalez et al., 2014).
La vie dans le sol
Le sol peut agir comme un réservoir pour les inoculats fongiques (Castrillo et al., 2010), se dispersant en surface par le vent, les éclaboussures de pluie et l’activité des insectes, ou via l’infection des insectes vivant dans le sol et la croissance des hyphes radiaux (Meyling et Eilenberg, 2007). L’efficacité et la persistance des champignons hypocréaliens sont influencées par le type de sol, les niveaux d’humidité et les interactions microbiennes (Inglis et al., 2001). Alors que les sols tropicaux peuvent contenir une matière organique et une diversité microbienne très élevées, les niveaux agricoles pour chacun d’entre eux dépendent principalement des pratiques de gestion agricole (Moeskops et al., 2010 ; Bai et al., 2018), et la texture varie largement parmi les sols tropicaux sans distinction claire des systèmes tempérés (Pulla et al., 2016). Par conséquent, les études tempérées décrivant les effets des caractéristiques physiques du sol sur la persistance et l’efficacité de l’EPF sont probablement directement applicables aux systèmes tropicaux.
Les sols riches en matière organique regorgent souvent de microbes, permettant potentiellement des interactions antagonistes entre les microbes (Inglis et al., 1998 ; Pal et Gardener, 2006). Dans des études menées en milieu tempéré, les effets antagonistes d’une activité microbienne accrue dans le sol ont contribué à l’inhibition de B. bassiana (Studdert et Kaya, 1990 ; Kessler et al., 2003 ; Quesada-Moraga et al., 2007), B. brongniartii (Kessler et al., 2004) et M. anisopliae (Jabbour et Barbercheck, 2009). Par exemple, une teneur élevée en humidité du sol a favorisé l’apparition d’organismes antagonistes, ce qui suggère que l’humidité du sol pourrait réduire directement ou indirectement la survie des conidies (Lingg et Donaldson, 1981 ; Jabbour et Barbercheck, 2009). Cependant, cela a été réfuté par d’autres études dans les régions tempérées trouvant peu ou pas de relation entre l’humidité du sol et l’occurrence de l’EPF, potentiellement en raison de la variation limitée des niveaux d’humidité du sol échantillonné ou d’un manque d’oxygène (Griffin, 1963 ; Ali-Shtayeh et al, 2003 ; Kessler et al, 2003).
Les niveaux d’oxygène du sol pendant l’infection peuvent favoriser la croissance mycélienne, la tolérance thermique, la germination et la virulence contre les insectes (Garza-López et al., 2012 ; Miranda-Hernández et al., 2014 ; Garcia-Ortiz et al., 2015 ; García-Ortiz et al., 2018 ; Oliveira et Rangel, 2018). Des études in vitro révèlent une corrélation positive entre les concentrations d’oxygène enrichies (26 et 30 % O2) et la qualité des conidies par rapport aux niveaux d’oxygène atmosphérique normaux (21 % O2) (Miranda-Hernández et al., 2014 ; Garcia-Ortiz et al., 2015 ; García-Ortiz et al., 2018). De même, à des niveaux d’oxygène privés, le même contraste dans la croissance des conidies et la virulence s’applique, réduisant sous des concentrations ambiantes d’oxygène (Garza-López et al., 2012 ; Oliveira et Rangel, 2018). La germination dans des conditions hypoxiques est plus faible qu’aux niveaux atmosphériques normaux (Garza-López et al., 2012), augmentant lorsque les conditions d’oxygène s’enrichissent (Miranda-Hernández et al., 2014). Ainsi, l’aération du sol pendant la croissance mycélienne peut faciliter le développement optimal des champignons entomopathogènes et la lutte contre les ravageurs.
La texture du sol influence la transmission et la rétention des propagules fongiques. L’augmentation de la teneur en argile peut favoriser la persistance des champignons entomopathogènes, probablement en raison de la plus petite taille des pores et/ou de l’adsorption des conidies sur l’argile et les particules organiques (Ignoffo et al., 1977 ; Storey et Gardner, 1988 ; Quesada-Moraga et al., 2007). Cependant, une teneur élevée en argile peut également inhiber la capacité d’un hôte potentiel à en rencontrer un autre, en raison d’une porosité réduite pour la pénétration des conidies dans les couches plus profondes du sol et la transmission potentielle (Vänninen et al., 2000 ; Fuxa et Richter, 2004). Par conséquent, la filtration mécanique de la structure du sol peut être un déterminant majeur de la persistance et de l’efficacité des champignons entomopathogènes lorsqu’ils sont appliqués au sol (Storey et Gardner, 1988). Par exemple, l’efficacité de B. bassiana contre les fourmis de feu rouges Solenopsis invicta s’est améliorée lorsqu’elle a été appliquée sur des sols plus humides, favorisant la transmission des conidies et les taux d’infection (Fuxa et Richter, 2004).
Préférence de niche
L’hypothèse de sélection de l’habitat
Les interactions biotiques peuvent modifier la persistance des EPF tropicaux (Jaronski, 2010), en particulier L’hypothèse de sélection de l’habitat pour les espèces de Metarhizium suggère qu’il s’agit d’une différence clé entre les régions tempérées et tropicales (Bidochka et al, 2002). Bidochka et Small (2005) ont suggéré que les génotypes de Metarhizium sont associés aux types d’habitats dans les régions tempérées et polaires et sont plus probablement associés à certains insectes hôtes dans les régions (sub)tropicales. Les auteurs ont également suggéré que M. anisopliae est originaire d’Asie du Sud-Est mais qu’il comprend maintenant un assemblage d’espèces cryptiques, dont beaucoup traversent de grandes barrières géographiques. Les études sur Beauveria et Metarhizium dans les régions tempérées ont souligné leur préférence pour la sélection de l’habitat par rapport aux associations avec des insectes hôtes (Meyling et Eilenberg, 2006b ; Meyling et al., 2009 ; Ormond et al., 2010). Toute association d’insectes hôtes de M. anisopliae à des latitudes plus élevées a été attribuée à l’habitat de l’insecte, ce qui suggère que des facteurs abiotiques pourraient potentiellement être à l’origine de la structure génétique de la population (Bidochka et al…, 2001).
Takatsuka (2007) a caractérisé des isolats de Beauveria du Japon en utilisant l’ISSR-PCR et n’a trouvé aucune preuve de coévolution à long terme entre le champignon et les insectes hôtes, soutenant l’hypothèse de Bidochka et al. (2002) selon laquelle la variation de la persistance du stade saprophyte libre d’un insecte pathogène facultatif conduit la structure génétique de la population. En revanche, Bridge et al. (1997) ont suggéré une coévolution entre les isolats tropicaux de M. flavoviride var. minus d’un seul génotype et les insectes appartenant à la superfamille des Acridoidea. Les isolats tropicaux de M. flavoviride var. minus présentant des caractéristiques de préférence d’hôte différaient de ceux d’origine européenne. Il est intéressant de noter que la majorité des isolats dans les publications soutenant l’hypothèse de Bidochka et Small (2005) concernant l’association des Metarhizium spp. avec les espèces d’insectes hôtes ont une origine tropicale (Rombach et al., 1986 ; St. Leger et al., 1992 ; Bridge et al., 1993, 1997 ; Leal et al., 1994 ; Tigano-Milani et al., 1995). Cependant, des analyses futures sont nécessaires pour définir ces relations.
Les souches de Metarhizium se sont adaptées à des environnements particuliers, soutenant des stratégies d’histoire de vie polyvalentes (Lovett et St. Leger, 2015). Les ajustements des réponses au stress environnemental peuvent provenir de l’adaptation à des facteurs environnementaux abiotiques (par exemple, la température, le rayonnement UV et l’humidité) et biotiques liés à l’infection d’un hôte (par exemple, les facteurs de stress antimicrobiens et comportementaux) (Lovett et St. Leger, 2015 ; Ortiz-Urquiza et Keyhani, 2015). Les conidies produites sous stress abiotique et biotique peuvent résister à une gamme environnementale plus large, et améliorer la virulence contre les insectes (Li et al., 2015 ; Rangel et al., 2015). Par exemple, surmonter les fièvres comportementales de l’hôte acariâtre pendant l’infection peut produire des isolats de champignons entomopathogènes plus thermotolérants (Fargues et al., 1997 ; Blanford et Thomas, 2000 ; Rangel et al., 2005). Les traits comportementaux défensifs des sauterelles peuvent entraîner des divergences entre les espèces de champignons entomopathogènes et leur efficacité à contrôler les populations de ravageurs à différentes températures (Inglis et al., 1999). Les nymphes de sauterelles infectées par B. bassiana et M. acridum ont connu des niveaux réduits de mortalité lorsque la température a été augmentée, et M. acridum a largement dépassé B. bassiana dans la mortalité des nymphes à des températures plus élevées (Inglis et al…, 1999).
À partir des preuves principalement présentées pour Metarhizium, nous proposons deux hypothèses générales pour l’EPF : (i) Les facteurs abiotiques sont les principaux déterminants de la structure génétique des populations à des latitudes plus élevées, en raison de la nécessité pour l’insecte pathogène de s’adapter à la saisonnalité et aux conditions environnementales extrêmes. (ii) Inversement, les facteurs biotiques (interactions avec d’autres espèces et voies d’infection associées au champignon et à l’hôte) sont les principaux régulateurs de la structure génétique des populations de l’EPF aux latitudes inférieures. Nous évaluons ces hypothèses à la lumière des recherches récentes ci-dessous. Pour présenter visuellement nos hypothèses, nous avons construit un modèle conceptuel (Figure 1). Celui-ci est destiné à décrire qualitativement nos hypothèses pour stimuler les recherches futures, plutôt que de se présenter seul comme un modèle mathématique.
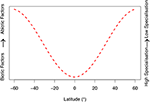
Figure 1. Modèle conceptuel qualitatif basé de nos revues hypothèses développées. La spécificité des communautés fongiques entomopathogènes change avec la latitude, correspondant à des facteurs biotiques et abiotiques. Les facteurs biotiques sont liés aux interactions avec l’hôte et d’autres microbes (c’est-à-dire les courses aux armements coévolutives et les voies d’infection). Les facteurs abiotiques comprennent des variables environnementales telles que la température, l’humidité, le rayonnement UV et les facteurs de stress oxydatifs et osmotiques. La gamme latitudinale a été limitée à 60°N et 60°S, car cette figure ne tient pas compte des extrêmes climatiques au-delà de ces seuils sur les communautés fongiques. Nous émettons l’hypothèse qu’à des latitudes plus basses, les champignons entomopathogènes vivent dans des conditions environnementales plus idéales, malgré une pression accrue d’autres espèces fongiques, et une défense de l’hôte plus importante (voir les sections « Conditions abiotiques et adaptation » et « Interactions biotiques et adaptation » du texte principal pour plus d’informations). Cela correspond à une augmentation de la spécialisation des champignons entomopathogènes.
Conditions abiotiques et adaptation
Les champignons habitant les latitudes plus élevées connaissent une plus large gamme de températures en raison de la saisonnalité (Wielgolaski et Inouye, 2003). Ainsi, les facteurs de stress abiotiques (en particulier la température) à des latitudes plus élevées peuvent principalement conduire la génétique des populations et l’adaptabilité de l’EPF. Dans les régions tempérées, l’EPF doit s’adapter à une large gamme et à des niveaux plus élevés d’intensité climatique (Maggi et al., 2013 ; Wang et al., 2017), les facteurs abiotiques influençant principalement la survie des pathogènes généralistes (Bidochka et al., 2001 ; Lennon et al., 2012). En revanche, nous supposons que les facteurs biotiques des basses latitudes, tels que la richesse en espèces et les associations pathogènes-insectes, qui entraînent des courses aux armements coévolutives, influencent principalement le cycle biologique de l’EPF. Les regroupements phylogénétiques de B. bassiana par type d’habitat sont plus fréquents aux hautes latitudes à variation saisonnière (Ormond et al., 2010), bien qu’une étude n’ait trouvé aucun effet saisonnier dans les régions à climat subtropical (Garrido-Jurado et al., 2015). Des études structurées sur le plan phylogénétique suggèrent que B. bassiana adapte la régulation de ses gènes aux conditions environnementales, l’adaptation de l’habitat étant le moteur de la dynamique des populations (Bidochka et al., 2002 ; Xiao et al., 2012). Ainsi, les différences dans l’ampleur des conditions environnementales saisonnières à différentes latitudes peuvent contribuer aux dissemblances temporelles observées dans la dynamique de la population de B. bassiana entre les études.
Les conditions environnementales proches des limites de survie des champignons entomopathogènes peuvent conduire à une adaptation locale lorsque ces limites sont régulièrement expérimentées (Doberski, 1981 ; Vidal et al., 1997). La température optimale pour la croissance et la virulence contre les insectes hôtes des espèces Metarhizium et Beauveria se situe généralement entre 25 et 30°C (Luz et Fargues, 1997 ; Ekesi et al., 1999 ; Devi et al., 2005 ; Bugeme et al., 2009). Cependant, des variations significatives existent dans la préférence thermique d’une espèce de champignon pathogène et leurs effets sur les hôtes potentiels, en raison de l’environnement dans lequel les agents pathogènes ont évolué (Fargues et al., 1997 ; Bugeme et al., 2009 ; Alali et al., 2019), et les souches individuelles peuvent différer dans leurs optima thermiques (Doberski, 1981 ; Thomas et Jenkins, 1997 ; Alali et al., 2019). Les isolats de M. acridum obtenus dans un environnement chaud ont montré une meilleure performance à des températures plus élevées que ceux provenant d’un climat beaucoup plus frais (Thomas et Jenkins, 1997). De même, les souches subtropicales de B. bassiana collectées dans des zones plus chaudes de Syrie ont démontré une plus grande capacité de thermotolérance que l’aberration collectée sur un site connaissant des températures plus basses (Alali et al., 2019). En ce qui concerne la virulence contre les insectes, les isolats tempérés de B. bassiana étaient significativement plus efficaces contre le scolyte de l’orme (Scolytus scolytus F.) à basse température (2 à 6°C) que les isolats de M. anisopliae originaires de latitudes tropicales et subtropicales (Doberski, 1981), bien qu’il soit impossible de séparer les différences entre les espèces fongiques des différences provenant des sources géographiques des deux souches fongiques. B. bassiana et M. anisopliae sont également sensibles aux rayons ultraviolets, ce qui explique l’utilisation de protecteurs UV dans les pulvérisations à base d’huile sur le terrain (Inglis et al., 1995 ; Shin et al., 2017 ; Kumar et al., 2018). La tolérance aux UV varie souvent entre les isolats provenant de différentes latitudes (Braga et al., 2001 ; Fernandes et al., 2008) et de différents types d’habitats (Bidochka et al., 2001). Les isolats de B. bassiana et de M. anisopliae plus proches de l’équateur présentent une plus grande tolérance aux UV, et les populations adaptées au froid provenant de latitudes plus élevées connaissent généralement des conditions optimales dans des températures plus froides (Fernandes et al., 2008). Au Canada, les isolats de Metarhizium rencontrés dans les habitats forestiers sont moins tolérants aux rayons UV et sont plus adaptés au froid par rapport aux paysages agricoles (Bidochka et al., 2001). Ainsi, la sélection abiotique aux hautes latitudes (par ex, exposition aux UV dans un type d’habitat donné) pour des groupes génétiques spécifiques d’entomopathogènes fongiques pourrait influencer leur efficacité en agriculture, en particulier si les isolats proviennent d’habitats forestiers ou de haies.
Interactions biotiques et adaptation
Les forêts tropicales abritent une grande diversité de mycotaxes entomopathogènes, où l’on trouve surtout les téléomorphes (stades sexuels) des champignons hypocréaliens, souvent plus spécialisés dans leur gamme d’hôtes que les morphotypes asexués (Evans, 1982 ; Vega et al, 2012 ; Hu et al., 2014). En revanche, les EPF à développement asexué (anamorphes) habitent aussi bien les climats tropicaux que tempérés (Vega et al., 2012). Des études en laboratoire dans des systèmes modèles qui ont augmenté la biodiversité ont observé une intensification correspondante des courses aux armements évolutives entre hôtes et parasites (Betts et al., 2018). De même, la diversité génétique et la spécificité d’hôte de certaines espèces fongiques suggèrent que les insectes hôtes peuvent exercer de fortes pressions sélectives sur les agents pathogènes par le biais d’une cascade de mécanismes de défense et de contre-défense (Maurer et al., 1997 ; Evans et al., 2011 ; Mukherjee et Vilcinskas, 2018). Par exemple, Metarhizium a souvent évolué d’insectes pathogènes spécialistes à généralistes ; une expansion de la gamme d’hôtes coïncidant avec l’occupation fongique d’une gamme latitudinale en expansion (Bidochka et Small, 2005 ; Hu et al., 2014). Cependant, dans les zones de forêts pluviales à forte densité d’espèces, la grande diversité fongique tropicale peut subir une pression plus forte de la part des hôtes et des concurrents, ce qui peut favoriser l’apparition d’agents pathogènes tels que le genre téléomorphe Cordyceps (Evans, 1982 ; Sung et al., 2007 ; Aung et al., 2008), et les entomopathogènes fongiques spécialistes du genre Ophiocordyceps (Aung et al., 2008 ; Evans et al., 2011 ; Araújo et al., 2015). Les analyses phylogénomiques suggèrent que Beauveria spp. est le stade de vie asexué de la lignée Cordyceps (Xiao et al., 2012). Bien que Beauveria ait des liens génétiques directs avec Cordyceps, les Beauveria et Metarhizium généralistes sont moins courants dans les habitats de la forêt tropicale humide et sont plus fréquemment rencontrés dans l’agriculture (Rehner, 2005 ; Aung et al., 2008). Le contraste dans les histoires de vie entre ces champignons spécialistes et généralistes pourrait être attribué à la perte des mutations ponctuelles induites par la répétition chez B. bassiana et Metarhizium spp. (infère que le cycle sexuel est rare chez les deux champignons), qui était une condition préalable de ces champignons pathogènes pour l’expansion des familles de gènes (Xiao et al, 2012 ; Lovett et St. Leger, 2017).
Compte tenu de l’origine sud-est asiatique probable de Metarhizium (le continent présentant la plus grande diversité génotypique) (Bidochka et Small, 2005 ; Lovett et St. Leger, 2017), et des changements évolutifs ultérieurs de la spécificité (Hu et al., 2014), une expansion de l’aire géographique vers les régions tempérées peut avoir correspondu à une gamme d’hôtes plus généraliste. Nous supposons que cela pourrait être dû en partie à une plus faible richesse en espèces hôtes dans les régions tempérées (Thompson et al., 2017), et à la nécessité de s’adapter à une plus grande variation des conditions climatiques en concentrant l’adaptation sur les conditions abiotiques. Il reste à savoir comment la plus grande diversité d’hôtes potentiels dans les environnements tropicaux modifie ces pressions de sélection. Des recherches futures sur la façon dont les courses aux armements entre insectes et pathogènes modifient la composition des communautés avec les changements de latitude permettraient d’améliorer la gestion des entomopathogènes sous différentes latitudes. En outre, les évaluations empiriques des champignons collectés à différentes latitudes et les expériences de laboratoire amélioreront nos connaissances sur les espèces fongiques endémiques et leur pertinence dans un système particulier, parallèlement à leur utilisation appropriée dans les régimes de biocontrôle.
Améliorer la persistance fongique et la prévention des épidémies d’insectes
La capacité de certaines espèces fongiques à traverser de grandes barrières géographiques (c’est-à-dire, de nature cosmopolite) n’implique pas que l’application d’agents pathogènes fongiques comme biopesticide agricole assurera la persistance fongique. Il est plutôt nécessaire d’étudier la pertinence d’un pathogène fongique spécifique à l’environnement cible, y compris les effets interactifs des facteurs biotiques/abiotiques individuels. Les efforts doivent se concentrer sur les communautés fongiques endémiques et être appliqués dans son système dérivé. Les différences régionales entre le type d’application fongique approprié, la gamme d’hôtes (c’est-à-dire, généraliste vs spécialiste) et les facteurs environnementaux dominants (biotiques/abiotiques) sur la performance des agents pathogènes peuvent mieux prédire le succès à long terme du biocontrôle entomopathogène et aider à prévenir les épidémies d’insectes.
Contributions des auteurs
AM a rédigé la première version. AM et TN ont contribué de manière significative aux versions ultérieures.
Funding
AM a été soutenu par une subvention AusIndustry Innovations Connections à TN.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Akello, J., Dubois, T., Coyne, D., et Kyamanywa, S. (2008). Effet de Beauveria bassiana endophyte sur les populations du charançon du bananier, Cosmopolites sordidus, et leurs dommages dans les bananiers cultivés en tissu. Entomol. Exp. Appl. 129, 157-165. doi : 10.1111/j.1570-7458.2008.00759.x
CrossRef Full Text | Google Scholar
Akmal, M., Freed, S., Malik, M. N., et Gul, H. T. (2013). Efficacité de Beauveria bassiana (Deuteromycotina : Hypomycètes) contre différentes espèces de pucerons dans des conditions de laboratoire. Pak. J. Zool. 45, 71-78.
Google Scholar
Alali, S., Mereghetti, V., Faoro, F., Bocchi, S., Al Azmeh, F., et Montagna, M. (2019). Isolats thermotolérants de Beauveria bassiana comme agent de contrôle potentiel des insectes nuisibles dans les climats subtropicaux. PLoS ONE 14:e0211457. doi : 10.1371/journal.pone.0211457
PubMed Abstract | CrossRef Full Text | Google Scholar
Ali-Shtayeh, M. S., Mara’i, A.-B. B. M., et Jamous, R. M. (2003). Distribution, occurrence et caractérisation des champignons entomopathogènes dans les sols agricoles de la région palestinienne. Mycopathologia 156, 235-244. doi : 10.1023/A:1023339103522
PubMed Abstract | CrossRef Full Text | Google Scholar
Araújo, J. P. M., Evans, H. C., Geiser, D. M., Mackay, W. P., et Hughes, D. P. (2015). Unravelling the diversity behind the Ophiocordyceps unilateralis complex : three new species of zombie-ant fungi from the Brazilian Amazon. Zootaxa 22, 224-238. doi : 10.11646/phytotaxa.220.3.2
CrossRef Full Text | Google Scholar
Aung, O. M., Soytong, K., and Hyde, K. (2008). Diversité des champignons entomopathogènes dans les forêts pluviales de la province de Chiang Mai, en Thaïlande. Fungal Divers. 30, 15-22.
Google Scholar
Bai, Z., Caspari, T., Gonzalez, M. R., Batjes, N. H., Mäder, P., Bünemann, E. K., et al. (2018). Effets des pratiques de gestion agricole sur la qualité des sols : un examen des expériences à long terme pour l’Europe et la Chine. Agric. Ecosyst. Environ. 265, 1-7. doi : 10.1016/j.agee.2018.05.028
CrossRef Full Text | Google Scholar
Behie, S. W., Jones, S. J., et Bidochka, M. J. (2015). Localisation dans les tissus végétaux des champignons endophytes pathogènes pour les insectes Metarhizium et Beauveria. Fungal Ecol. 13, 112-119. doi : 10.1016/j.funeco.2014.08.001
CrossRef Full Text | Google Scholar
Behie, S. W., Zelisko, P., et Bidochka, M. J. (2012). Les champignons endophytes parasites d’insectes transloquent l’azote directement des insectes aux plantes. Science 336, 1576-1577. doi : 10.1126/science.1222289
PubMed Abstract | CrossRef Full Text | Google Scholar
Betts, A., Gray, C., Zelek, M., MacLean, R. C., et King, K. C. (2018). Une grande diversité parasitaire accélère l’adaptation et la diversification des hôtes. Science 360, 907-911. doi : 10.1126/science.aam9974
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., Kamp, A. M., Lavender, T. M., Dekoning, J., et De Croos, J. N. (2001). Habitat association in two genetic groups of the insect-pathogenic fungus Metarhizium anisopliae : uncovering cryptic species ? Appl. Environ. Microbiol. 67, 1335-1342. doi : 10.1128/AEM.67.3.1335-1342.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., Menzies, F. V., et Kamp, A. M. (2002). Les groupes génétiques du champignon pathogène pour les insectes Beauveria bassiana sont associés aux préférences d’habitat et de croissance thermique. Arch. Microbiol. 178, 531-537. doi : 10.1007/s00203-002-0490-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., et Small, C. L. (2005). » Phylogéographie de Metarhizium, un champignon pathogène pour les insectes « , dans Insect-Fungal Associations : Ecology and Evolution, eds F. E. Vega and M. Blackwell (New York, NY : Oxford University Press), 75-118.
Google Scholar
Blanford, S., and Thomas, M. B. (2000). Comportement thermique de deux espèces acrides : effets de l’habitat et de la saison sur la température corporelle et l’impact potentiel sur le biocontrôle avec des agents pathogènes. Environ. Entomol. 29, 1060-1069. doi : 10.1603/0046-225X-29.5.1060
CrossRef Full Text | Google Scholar
Braga, G., Flint, S., Miller, C., Anderson, A., and Roberts, D. (2001). Variabilité de la réponse aux UV-B parmi les espèces et les souches de Metarhizium isolées de sites à des latitudes de 61°N à 54°S. J. Invertebr. Cathol. 78, 98-108. doi : 10.1006/jipa.2001.5048
PubMed Abstract | CrossRef Full Text | Google Scholar
Bridge, P. D., Prior, C., Sagbohan, J., Lomer, C. J., Carey, M., et Buddie, A. (1997). Caractérisation moléculaire d’isolats de Metarhizium provenant de criquets et de sauterelles. Biodivers. Conserv. 6, 177-189. doi : 10.1023/A:1018387918686
CrossRef Full Text | Google Scholar
Bridge, P. D., Williams, M. A. J., Prior, C., et Paterson, R. R. M. (1993). Caractéristiques morphologiques, biochimiques et moléculaires de Metarhizium anisopliae et M. flavoviride. J. Gen. Microbiol 139, 1163-1169. doi : 10.1099/00221287-139-6-1163
CrossRef Full Text | Google Scholar
Bugeme, D. M., Knapp, M., Boga, H. I., Wanjoya, A. K., et Maniania, N. K. (2009). Influence de la température sur la virulence des isolats fongiques de Metarhizium anisopliae et Beauveria bassiana sur le tétranyque à deux points Tetranychus urticae. Mycopathologia 167, 221-227. doi : 10.1007/s11046-008-9164-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Castrillo, L. A., Bauer, L. S., Liu, H., Griggs, M. H., et Vandenberg, J. D. (2010). Caractérisation des isolats de Beauveria bassiana (Ascomycota : Hypocreales) associés aux populations d’Agrilus planipennis (Coleoptera : Buprestidae) dans le Michigan. Biol. Control 54, 135-140. doi : 10.1016/j.biocontrol.2010.04.005
CrossRef Full Text | Google Scholar
Devi, K. U., Sridevi, V., Mohan, C. M., et Padmavathi, J. (2005). Effet de la température élevée et du stress hydrique sur la germination in vitro et la croissance des isolats du champignon entomopathogène Beauveria bassiana (Bals.) Vuillemin. J. Invertebr. Pathol. 88, 181-189. doi : 10.1016/j.jip.2005.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Doberski, J. W. (1981). Études comparatives en laboratoire sur trois champignons pathogènes du scolyte de l’orme Scolytus scolytus : Effet de la température et de l’humidité sur l’infection par Beauveria bassiana, Metarhizium anisopliae et Paecilomyces farinosus. J. Invertebr. Cathol. 37, 195-200. doi : 10.1016/0022-2011(81)90075-6
CrossRef Full Text | Google Scholar
Driver, F., Milner, R. J., and Trueman, J. W. H. (2000). Une révision taxonomique de Metarhizium basée sur une analyse phylogénétique des données de séquence d’ADNr. Mycol. Res. 104, 134-150. doi : 10.1017/S0953756299001756
CrossRef Full Text | Google Scholar
Ekesi, S., Maniania, N. K., and Ampong-Nyarko, K. (1999). Effet de la température sur la germination, la croissance radiale et la virulence de Metarhizium anisopliae et Beauveria bassiana sur Megalurothrips sjostedti. Biocontrol Sci. Technol. 9, 177-185. doi : 10.1080/09583159929767
CrossRef Full Text | Google Scholar
Evans, H. C. (1982). Champignons entomogènes dans les écosystèmes forestiers tropicaux : une évaluation. Ecol. Entomol. 7, 47-60. doi : 10.1111/j.1365-2311.1982.tb00643.x
CrossRef Full Text | Google Scholar
Evans, H. C., Elliot, S. L., and Hughes, D. P. (2011). La diversité cachée derrière le champignon zombie-ant Ophiocordyceps unilateralis : Four new species described from carpenter ants in Minas Gerais, Brazil. PLoS ONE 6:e17024. doi : 10.1371/journal.pone.0017024
PubMed Abstract | CrossRef Full Text | Google Scholar
Fargues, J., Goettel, M. S., Smits, N., Ouedraogo, A., et Rougier, M. (1997). Effect of temperature on vegetative growth of Beauveria bassiana isolates from different origins. Mycologia 89, 383-892. doi : 10.1080/00275514.1997.12026797
CrossRef Full Text | Google Scholar
Fargues, J., et Luz, C. (2000). Effets des régimes fluctuants d’humidité et de température sur le potentiel d’infection de Beauveria bassiana pour Rhodnius prolixus. J. Invertebr. Pathol. 75, 202-211. doi : 10.1006/jipa.1999.4923
PubMed Abstract | CrossRef Full Text | Google Scholar
Faria, M. R. D., et Wraight, S. P. (2007). Mycoinsecticides et mycoacaricides : une liste complète avec une couverture mondiale et une classification internationale des types de formulation. Biol. Control 43, 237-256. doi : 10.1016/j.biocontrol.2007.08.001
CrossRef Full Text | Google Scholar
Fernandes, E. K., Rangel, D. E. N., Moraes, Á.. M. L., Bittencourt, V. R. E. P., et Roberts, D. W. (2008). Activité au froid de Beauveria et Metarhizium, et thermotolérance de Beauveria. J. Invertebr. Pathol. 98, 69-78. doi : 10.1016/j.jip.2007.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuxa, J. R., et Richter, A. R. (2004). Effets de l’humidité et de la composition du sol et de l’isolat fongique sur la prévalence de Beauveria bassiana dans les colonies de laboratoire de la fourmi de feu importée rouge (Hymenoptera : Formicidae). Environ. Entomol. 33, 975-981. doi : 10.1603/0046-225X-33.4.975
CrossRef Full Text | Google Scholar
García-Ortiz, N., Figueroa-Martínez, F. J., Carrasco-Navarro, U., Favela-Torres, E., et Loera, O. (2018). La concentration d’oxygène dans les cultures module l’expression des protéines et les réponses antioxydantes enzymatiques dans les conidies de Metarhizium lepidiotae. Fungal Biol. 122, 487-496. doi : 10.1016/j.funbio.2017.10.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Garcia-Ortiz, N., Tlecuitl-Beristain, S., Favela-Torres, E., et Loera, O. (2015). Production et qualité des conidies par Metarhizium anisopliae var. lepidiotum : niveau d’oxygène critique et période de compétence du mycélium. Appl. Microbiol. Biotechnol. 99, 2783-2791. doi : 10.1007/s00253-014-6225-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Garrido-Jurado, I., Fernandez-Bravo, M., Campos, C., et Quesada-Moraga, E. (2015). Diversité des Hypocreales entomopathogènes dans le sol et les phylloplanes de cinq systèmes de culture méditerranéens. J. Invertebr. Pathol. 130, 97-106. doi : 10.1016/j.jip.2015.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Garza-López, P. M., Konigsberg, M., Gómez-Quiroz, L. E., et Loera, O. (2012). Réponse physiologique et antioxydante de Beauveria bassiana Bals (Vuill.) à différentes concentrations d’oxygène. World J. Microbiol. Biotechnol. 28, 353-359. doi : 10.1007/s11274-011-0827-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Greenfield, M., Gomez-Jimenez, M. I., Ortiz, V., Vega, F. E., Kramer, M., et Parsa, S. (2016). Beauveria bassiana et Metarhizium anisopliae colonisent de manière endophytique les racines de manioc après inoculation par trempage du sol. Biol. Control 95, 40-48. doi : 10.1016/j.biocontrol.2016.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Griffin, D. M. (1963). L’humidité du sol et l’écologie des champignons du sol. Biol. Rev. 38, 141-166. doi : 10.1111/j.1469-185X.1963.tb00781.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Hu, X., Xiao, G., Zheng, P., Shang, Y., Su, Y., Zhang, X., et al. (2014). Trajectoire et déterminants génomiques de la spéciation des champignons-pathogènes et de l’adaptation des hôtes. Proc. Natl. Acad. Sci. U.S.A. 111, 16796-16801. doi : 10.1073/pnas.1412662111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ignoffo, C. M., Garcia, C., Hostetter, D. L., et Pinnell, R. E. (1977). Mouvement vertical des conidies de Nomuraea rileyi à travers les sols de sable et de loam. J. Econ. Entomol. 70, 163-164. doi : 10.1093/jee/70.2.163
CrossRef Full Text | Google Scholar
Inglis, G., Goettel, M. S., Butt, T., et Strasser, H. (2001). « Use of hyphomycetous fungi for managing insect pests », dans Fungi as Biocontrol Agents : Progress, Problems and Potential, eds T. M. Butt, C. Jackson, and N. Magan (Oxfordshire : CABI Publishing), 23-69. doi : 10.1079/9780851993560.0023
CrossRef Full Text | Google Scholar
Inglis, G. D., Duke, G. M., Goettel, M. S., Kabaluk, J. T., et Ortega-Polo, R. (2019). Biogéographie et diversité génotypique de Metarhizium brunneum et Metarhizium robertsii dans les sols du nord-ouest de l’Amérique du Nord. Can. J. Microbiol. 65, 261-281. doi : 10.1139/cjm-2018-0297
PubMed Abstract | CrossRef Full Text | Google Scholar
Inglis, G. D., Duke, G. M., Kawchuk, L. M., et Goettel, M. S. (1999). Influence des températures oscillantes sur l’infection compétitive et la colonisation de la sauterelle migratrice par Beauveria bassiana et Metarhizium flavoviride. Biol. control 14, 111-120. doi : 10.1006/bcon.1998.0666
CrossRef Full Text | Google Scholar
Inglis, G. D., Goettel, M. S., and Johnson, D. L. (1995). Influence des protecteurs de lumière ultraviolette sur la persistance du champignon entomopathogène, Beauveria bassiana. Biol. Control 5, 581-590. doi : 10.1006/bcon.1995.1069
CrossRef Full Text | Google Scholar
Inglis, G. D., Johnson, D. L., Kawchuk, L. M., and Goettel, M. S. (1998). Effet de la texture du sol et de la stérilisation du sol sur la sensibilité des sauterelles oviposantes à Beauveria bassiana. J. Invertebr. 71, 73-81. doi : 10.1006/jipa.1997.4698
PubMed Abstract | CrossRef Full Text | Google Scholar
Jabbour, R., et Barbercheck, M. E. (2009). Effets de la gestion du sol sur les champignons entomopathogènes pendant la transition vers l’agriculture biologique dans une rotation de céréales fourragères. Biol. Control 51, 435-443. doi : 10.1016/j.biocontrol.2009.08.004
CrossRef Full Text | Google Scholar
Jaronski, S. T. (2010). Facteurs écologiques dans l’utilisation inondative des entomopathogènes fongiques. Biocontrol 55, 159-185. doi : 10.1007/s10526-009-9248-3
CrossRef Full Text | Google Scholar
Kassa, A., Stephan, D., Vidal, S., et Zimmermann, G. (2004). Évaluation en laboratoire et sur le terrain de différentes formulations de spores submergées et de conidies aériennes de Metarhizium anisopliae var. acridum pour la lutte contre les criquets et les sauterelles. Biocontrol 49, 63-81. doi : 10.1023/B:BICO.0000009384.46858.aa
CrossRef Full Text | Google Scholar
Kessler, P., Enkerl, J., Schweize, C., et Keller, S. (2004). Survie de Beauveria brongniartii dans le sol après application comme agent de biocontrôle contre le hanneton européen Melolontha melolontha. Biocontrol 49, 563-581. doi : 10.1023/B:BICO.0000036441.40227.ed
CrossRef Full Text | Google Scholar
Kessler, P., Matzke, H., and Keller, S. (2003). L’effet du temps d’application et des facteurs du sol sur l’occurrence de Beauveria brongniartii appliqué comme agent de lutte biologique dans le sol. J. Invertebr. Pathol. 84, 15-23. doi : 10.1016/j.jip.2003.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Keyser, C. A., Fernandes, É. K. K., Rangel, D. E. N., Foster, R. N., Jech, L. E., Reuter, K. C., et al. (2017). Essais biologiques en laboratoire et essais en cage sur le terrain d’isolats de Metarhizium spp. avec des grillons Mormon (Anabrus simplex) collectés sur le terrain. Biocontrol 62, 257-268. doi : 10.1007/s10526-016-9782-8
CrossRef Full Text | Google Scholar
Kumar, K. K., Sridhar, J., Murali-Baskaran, R. K., Senthil-Nathan, S., Kaushal, P., Dara, S. K., et al. (2018). Biopesticides microbiens pour la gestion des insectes nuisibles en Inde : état actuel et perspectives futures. J. Invertebr. Pathol. 165, 74-81. doi : 10.1016/j.jip.2018.10.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lacey, L. A., Grzywacz, D., Shapiro-Ilan, D. I., Frutos, R., Brownbridge, M., et Goettel, M. S. (2015). Les insectes pathogènes en tant qu’agents de contrôle biologique : retour vers le futur. J. Invertebr. Pathol. 132, 1-41. doi : 10.1016/j.jip.2015.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Leal, S. C. M., Bertioli, T. M., Butt, T. M., et Peberdy, J. F. (1994). Caractérisation des isolats du champignon entomopathogène Metarhizium anisopliae par RAPD-PCR. Mycol. Res. 98, 1077-1081. doi : 10.1016/S0953-7562(09)80436-X
CrossRef Full Text | Google Scholar
Lennon, J. T., Aanderud, Z. T., Lehmkuhl, B. K., et Schoolmaster, D. R. Jr. (2012). Cartographie de l’espace de niche des microorganismes du sol en utilisant la taxonomie et les traits. Ecology 93, 1867-1879. doi : 10.1890/11-1745.1
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, F., Shi, H.-Q., Ying, S.-H., and Feng, M.-G.. (2015). Contributions distinctes d’une Fe- et de deux superoxyde dismutases cofacturées par Cu/Zn à l’antioxydation, à la tolérance aux UV et à la virulence de Beauveria bassiana. Fungal Genet. Biol. 81, 160-171. doi : 10.1016/j.fgb.2014.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Z. B., Alves, S., Roberts, D., Fan, M., Delalibera, I., Tang, J., et al. (2010). Lutte biologique contre les insectes au Brésil et en Chine : histoire, programmes actuels et raisons de leurs succès en utilisant des champignons entomopathogènes. Biocontrol Sci. Technol. 20, 117-136. doi : 10.1080/09583150903431665
CrossRef Full Text | Google Scholar
Lingg, A. J., et Donaldson, M. D. (1981). Facteurs biotiques et abiotiques affectant la stabilité des conidies de Beauveria bassiana dans le sol. J. Invertebr. Pathol. 38, 191-200. doi : 10.1016/0022-2011(81)90122-1
CrossRef Full Text | Google Scholar
Lovett, B., and St. Leger, R. J. (2015). Le stress est la règle plutôt que l’exception pour Metarhizium. Curr. Genet. 61, 253-261. doi : 10.1007/s00294-014-0447-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett, B., et St. Leger, R. J. (2017). Les insectes pathogènes. Microbiol. Spectr. 5, 1-19. doi : 10.1128/microbiolspec.FUNK-0001-2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Luz, C., et Fargues, J. (1997). Exigences de température et d’humidité pour la germination des conidies d’un isolat de Beauveria bassiana, pathogène pour Rhodnius prolixus. Mycopathologia 138, 117-125. doi : 10.1023/A:1006803812504
PubMed Abstract | CrossRef Full Text | Google Scholar
Maggi, O., Tosi, S., Angelova, M., Lagostina, E., Fabbri, A. A., Pecoraro, L., et al. (2013). Adaptation des champignons, y compris les levures, aux environnements froids. Plant Biosyst. 147, 247-258. doi : 10.1080/11263504.2012.753135
CrossRef Full Text | Google Scholar
Mahe, F., de Vargas, C., Bass, D., Czech, L., Stamatakis, A., Lara, E., et al. (2017). Les parasites dominent les communautés hyperdiverses de protistes du sol dans les forêts tropicales humides néotropicales. Nat. Ecol. Evol. 1:0091. doi : 10.1038/s41559-017-0091
PubMed Abstract | CrossRef Full Text | Google Scholar
Mascarin, G. M., Lopes, R. B., Delalibera, I., Fernandes, E. K. K., Luz, C., et Faria, M. (2019). État actuel et perspectives des entomopathogènes fongiques utilisés pour le contrôle microbien des arthropodes nuisibles au Brésil. J. Invertebr. Pathol. 165, 46-53. doi : 10.1016/j.jip.2018.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Maurer, P., Couteaudier, Y., Girard, P. A., Bridge, P. D., et Riba, G. (1997). La diversité génétique de Beauveria bassiana et la relation avec la gamme d’insectes hôtes. Mycol. Res. 101, 159-164. doi : 10.1017/S0953756296002213
CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2006a). Isolation et caractérisation des isolats de Beauveria bassiana à partir de phylloplanes de végétation de haies. Mycol. Res. 110, 188-195. doi : 10.1016/j.mycres.2005.09.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Meyling, N. V., et Eilenberg, J. (2006b). Occurrence et distribution des champignons entomopathogènes du sol dans un seul agroécosystème biologique. Agric. Ecosyst. Environ. 113, 336-341. doi : 10.1016/j.agee.2005.10.011
CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2007). Écologie des champignons entomopathogènes Beauveria bassiana et Metarhizium anisopliae dans les agroécosystèmes tempérés : potentiel pour la lutte biologique de conservation. Biol. Control 43, 145-155. doi : 10.1016/j.biocontrol.2007.07.007
CrossRef Full Text | Google Scholar
Meyling, N. V., Lubeck, M., Buckley, E. P., Eilenberg, J., and Rehner, S. A. (2009). Composition de la communauté, gamme d’hôtes et structure génétique de l’entomopathogène fongique Beauveria dans des habitats agricoles et semi-naturels adjacents. Mol. Ecol. 18, 1282-1293. doi : 10.1111/j.1365-294X.2009.04095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Migiro, L. N., Maniania, N. K., Chabi-Olaye, A., et Vandenberg, J. (2010). Pathogénicité des isolats de champignons entomopathogènes Metarhizium anisopliae et Beauveria bassiana (Hypocreales : Clavicipitaceae) pour la mineuse du pois adulte (Diptera : Agromyzidae) et perspectives d’un dispositif d’autoinoculation pour l’infection au champ. Environ. Entomol. 39, 468-475. doi : 10.1603/EN09359
PubMed Abstract | CrossRef Full Text | Google Scholar
Miranda-Hernández, F., Saucedo-Castañeda, G., Alatorre-Rosas, R., et Loera, O. (2014). Les conditions de culture riches en oxygène améliorent l’infectivité conidienne et la qualité de deux souches d’Isaria fumosorosea pour des processus de biocontrôle potentiellement améliorés. Gestion des ravageurs. Sci. 70, 661-666. doi : 10.1002/ps.3605
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeskops, B., Sukristiyonubowo Buchan, D., Sleutel, S., Herawaty, L., Husen, E., et al. (2010). Soil microbial communities and activities under intensive organic and conventional vegetable farming in West Java, Indonesia. Appl. Soil Ecol. 45, 112-120. doi : 10.1016/j.apsoil.2010.03.005
CrossRef Full Text | Google Scholar
Mukherjee, K., et Vilcinskas, A. (2018). Le champignon entomopathogène Metarhizium robertsii communique avec l’insecte hôte Galleria mellonella pendant l’infection. Virulence 9, 402-413. doi : 10.1080/21505594.2017.1405190
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira, A. S., et Rangel, D. E. N. (2018). L’anoxie transitoire pendant la croissance de Metarhizium robertsii augmente la virulence conidienne à Tenebrio molitor. J. Invertebr. Cathol. 153, 130-133. doi : 10.1016/j.jip.2018.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Ormond, E. L., Thomas, A. P., Pugh, P. J., Pell, J. K., et Roy, H. E. (2010). Un champignon pathogène dans le temps et l’espace : la dynamique de la population de Beauveria bassiana dans une forêt de conifères. FEMS Microbiol. Ecol. 74, 146-154. doi : 10.1111/j.1574-6941.2010.00939.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ortiz-Urquiza, A., et Keyhani, N. O. (2015). Signalisation de la réponse au stress et virulence : aperçu des champignons entomopathogènes. Curr. Genet. 61, 239-249. doi : 10.1007/s00294-014-0439-9
CrossRef Full Text | Google Scholar
Pal, K. K., et Gardener, M. B. (2006). La lutte biologique contre les agents pathogènes des plantes. Plant Health Instr. doi : 10.1094/PHI-A-2006-1117-02Disponible en ligne à l’adresse suivante : http://www.apsnet.org/edcenter/advanced/topics/Pages/BiologicalControl.aspx
CrossRef Full Text | Google Scholar
Perez-Gonzalez, V. H., Guzman-Franco, A. W., Alatorre-Rosas, R., Hernandez-Lopez, J., Hernandez-Lopez, A., Carrillo-Benitez, M. G., et al. (2014). Diversité spécifique des champignons entomopathogènes Beauveria et Metarhizium dans les sols agricoles mexicains. J. Invertebr. Pathol. 119, 54-61. doi : 10.1016/j.jip.2014.04.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Posada, F., et Vega, F. E. (2005). Établissement de l’entomopathogène fongique Beauveria bassiana (Ascomycota : Hypocreales) comme endophyte dans les plants de cacao (Theobroma cacao). Mycologia 97, 1195-1200. doi : 10.1080/15572536.2006.11832729
PubMed Abstract | CrossRef Full Text | Google Scholar
Pulla, S., Riotte, J., Suresh, H. S., Dattaraja, H. S., et Sukumar, R. (2016). Contrôles de la variabilité spatiale du sol dans une forêt tropicale sèche. PLoS ONE 11:e0153212. doi : 10.1371/journal.pone.0153212
PubMed Abstract | CrossRef Full Text | Google Scholar
Quesada-Moraga, E., Navas-Cortes, J. A., Maranhao, E. A., Ortiz-Urquiza, A., et Santiago-Alvarez, C. (2007). Facteurs affectant l’occurrence et la distribution des champignons entomopathogènes dans les sols naturels et cultivés. Mycol. Res. 111(Pt 8), 947-966. doi : 10.1016/j.mycres.2007.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Rangel, D. E. N., Braga, G. U. L., Anderson, A. J., and Roberts, D. W. (2005). Variabilité de la thermotolérance conidienne des isolats de Metarhizium anisopliae de différentes origines géographiques. J. Invertebr. Pathol. 88, 116-125. doi : 10.1016/j.jip.2004.11.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rangel, D. E. N., Braga, G. U. L., Fernandes, É. K. K., Keyser, C. A., Hallsworth, J. E., et Roberts, D. W. (2015). La tolérance au stress et la virulence des champignons pathogènes pour les insectes sont déterminées par les conditions environnementales pendant la formation des conidies. Curr. Genet. 61, 383-404. doi : 10.1007/s00294-015-0477-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehner, S., et Buckley, E. (2005). A Beauveria phylogeny inferred from nuclear ITS and EF1-alpha sequences : evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia 97, 84-98. doi : 10.3852/mycologia.97.1.84
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehner, S. A. (2005). « Phylogénétique du genre Beauveria, pathogène pour les insectes », dans Insect-Fungal Associations : Ecology and Evolution, eds F. E. Vega and M. Blackwell (New York, NY : Oxford University Press), 3-27.
Google Scholar
Rombach, M. C., Humber, R. A., and Roberts, D. W. (1986). Metarhizium flavoviride var. minus, var. nov. un agent pathogène des cicadelles et des cicadelles du riz aux Philippines et aux îles Salomon. Mycotaxon 27, 87-92.
Google Scholar
Shin, T. Y., Bae, S. M., Kim, D. J., Yun, H. G., et Woo, S. D. (2017). Évaluation de la virulence, de la tolérance aux facteurs environnementaux et des activités antimicrobiennes des champignons entomopathogènes contre le tétranyque à deux points, Tetranychus urticae. Mycoscience 58, 204-212. doi : 10.1016/j.myc.2017.02.002
CrossRef Full Text | Google Scholar
Singha, D., Singha, B., et Dutta, B. K. (2010). Potentiel de Metarhizium anisopliae et Beauveria bassiana dans la lutte contre le termite du thé Microtermes obesi Holmgren in vitro et dans des conditions de terrain. J. Pest. Sci. 84, 69-75. doi : 10.1007/s10340-010-0328-z
CrossRef Full Text | Google Scholar
Skinner, M., Gouli, S., Frank, C. E., Parker, B. L., et Kim, J. S. (2012). Gestion de Frankliniella occidentalis (Thysanoptera : Thripidae) avec des formulations granulaires de champignons entomopathogènes. Biol. Control 63, 246-252. doi : 10.1016/j.biocontrol.2012.08.004
CrossRef Full Text | Google Scholar
St. Leger, R. J., May, B., Allee, L. L., Frank, D. C., Staples, R. C., et Robers, D. W. (1992). Genetic differences in allozymes and in formation of infection structures among isolates of the entomopathogenic fungus Metarhizium anisopliae. J. Invertebr. 60, 89-101. doi : 10.1016/0022-2011(92)90159-2
CrossRef Full Text | Google Scholar
Storey, G. K., et Gardner, W. A. (1988). Mouvement d’un spray aqueux de Beauveria bassiana dans le profil de quatre sols de Géorgie. Environ. Entomol. 17, 135-139. doi : 10.1093/ee/17.1.135
CrossRef Full Text | Google Scholar
Studdert, J. P., et Kaya, H. K. (1990). Effet du potentiel hydrique, de la température et de l’enrobage d’argile sur la survie des conidies de Beauveria bassiana dans un sol de loam et de tourbe. J. Invertebr. Pathol. 55, 417-427. doi : 10.1016/0022-2011(90)90086-L
CrossRef Full Text | Google Scholar
Sung, G.-H., Hywel-Jones, N. L., Sung, J.-M., Luangsa-ard, J. J., Shrestha, B., et Spatafora, J. W. (2007). Classification phylogénétique de Cordyceps et des champignons clavicipitacés. Stud. Mycol. 57, 5-59. doi : 10.3114/sim.2007.57.01
PubMed Abstract | CrossRef Full Text | Google Scholar
Takatsuka, J. (2007). Caractérisation des isolats de Beauveria bassiana du Japon en utilisant l’amplification par réaction en chaîne de la polymérase inter-simple séquence-répétition ancrée (ISSR-PCR). Appl. Entomol. Zool. 42, 563-571. doi : 10.1303/aez.2007.563
CrossRef Full Text | Google Scholar
Thomas, M. B., et Jenkins, N. E. (1997). Effects of temperature on growth of Metarhizium flavoviride and virulence to the variegated grasshopper, Zonocerus variegatus. Mycol. Res 101, 1469-1474. doi : 10.1017/S0953756297004401
CrossRef Full Text | Google Scholar
Thompson, L. R., Sanders, J. G., McDonald, D., Amir, A., Ladau, J., Locey, K. J., et al. (2017). Un catalogue communal révèle la diversité microbienne multi-échelle de la Terre. Nature 551, 457-463. doi : 10.1038/nature24621
PubMed Abstract | CrossRef Full Text | Google Scholar
Tigano-Milani, M. S., Gomes, A. C. M. M., et Sobral, B. W. S. (1995). La variabilité génétique des isolats brésiliens du champignon entomopathogène Metarhizium anisopliae. J. Invertebr. 65, 206-210. doi : 10.1006/jipa.1995.1031
CrossRef Full Text | Google Scholar
Vänninen, I., Tyni-Juslin, J., et Hokkanen, H. (2000). Persistance de Metarhizium anisopliae et Beauveria bassiana augmentés dans les sols agricoles finlandais. Biocontrol 45, 201-222. doi : 10.1023/A:1009998919531
CrossRef Full Text | Google Scholar
Vega, F. E. (2008). Pathologie des insectes et endophytes fongiques. J. Invertebr. Pathol. 98, 277-279. doi : 10.1016/j.jip.2008.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Vega, F. E., Goettel, M. S., Blackwell, M., Chandler, D., Jackson, M. A., Keller, S., et al. (2009). Fungal entomopathogens : new insights on their ecology. Fungal Ecol. 2, 149-159. doi : 10.1016/j.funeco.2009.05.001
CrossRef Full Text | Google Scholar
Vega, F. E., Meyling, N. V., Luangsa-ard, J. J., et Blackwell, M. (2012). « Fungal entomopathogens, » in Insect Pathology, eds F. E. Vega and H. K. Kaya (Cambridge, MA : Academic Press), 171-220. doi : 10.1016/B978-0-12-384984-7.00006-3
CrossRef Full Text | Google Scholar
Vidal, C., Fargues, J., and Lacey, L. A. (1997). Variabilité intraspécifique de Paecilomyces fumosoroseus : effet de la température sur la croissance végétative. J. Invertebr. 70, 18-26. doi : 10.1006/jipa.1997.4658
CrossRef Full Text | Google Scholar
Wang, M., Tian, J., Xiang, M., et Liu, X. (2017). Stratégie de vie des champignons adaptés au froid avec la référence à plusieurs espèces représentatives. Mycologie 8, 178-188. doi : 10.1080/21501203.2017.1370429
PubMed Abstract | CrossRef Full Text | Google Scholar
Wielgolaski, F. E., et Inouye, D. W. (2003). » High latitude climates « , dans Phenology : An Integrative Environmental Science, ed M. D. Schwartz (Dordrecht : Springer), 175-194. doi : 10.1007/978-94-007-0632-3_12
CrossRef Full Text | Google Scholar
Wraight, S. P., Ugine, T. A., Ramos, M. E., et Sanderson, J. P. (2016). Efficacité des applications de pulvérisation de champignons entomopathogènes contre les thrips des fleurs de l’ouest infestant les impatiens de serre dans des conditions d’humidité variables. Biol. Control 97, 31-47. doi : 10.1016/j.biocontrol.2016.02.016
CrossRef Full Text | Google Scholar
Xiao, G., Ying, S. H., Zheng, P., Wang, Z. L., Zhang, S., Xie, X. Q., et al. (2012). Perspectives génomiques sur l’évolution de l’entomopathogénicité fongique chez Beauveria bassiana. Sci. Rep. 2:483. doi : 10.1038/srep00483
PubMed Abstract | CrossRef Full Text | Google Scholar
Zimmermann, G. (2007). Examen de la sécurité du champignon entomopathogène Metarhizium anisopliae. Biocontrol Sci. Technol. 17, 879-920. doi : 10.1080/09583150701593963
CrossRef Full Text | Google Scholar