La sténose aortique valvulaire (SA) est la maladie valvulaire la plus fréquente dans les pays développés. Le diagnostic de SA est classiquement confirmé par l’échocardiographie, outil standard de détection et d’évaluation de la sévérité de la maladie (1). Néanmoins, l’évaluation de la gravité de la SA reste difficile. La SA sévère est généralement définie par un gradient moyen >40 mmHg, une surface de la valve aortique (AVA) <1 cm2 et une vitesse maximale du jet aortique >4,0 m/s (2). Cependant, des divergences sont fréquemment observées entre le gradient moyen et la surface de la valve chez un même patient (3). Ces écarts sont faciles à comprendre chez les patients dont le débit cardiaque est faible en raison d’une fraction d’éjection ventriculaire gauche réduite, mais ils peuvent également se produire chez des patients dont la fonction ventriculaire gauche est apparemment préservée (4). Dans la pratique quotidienne, elles peuvent potentiellement conduire à une sous-estimation de la sténose et de la gravité des symptômes et donc à un retard inapproprié du remplacement de la valve aortique (RVA), ce qui peut, à son tour, avoir un impact négatif sur le résultat du patient (5-7). Dans ce numéro de Cardiovascular Diagnosis and Therapy, OZKAN a élégamment passé en revue le concept de SA à faible gradient chez les patients dont la fonction du VG est préservée (8).
Nouvelle classification de gradation de la sténose aortique
Récemment, plusieurs auteurs ont rapporté que sous la même dénomination de SA sévère (AVA <1 cm2), plusieurs entités peuvent être identifiées qui diffèrent en termes de débits transvalvulaires et de gradients de pression développés (9-11). Le groupe de Pibarot et al. (5) a été le premier à souligner l’importance d’intégrer la relation valve-gradient au schéma d’écoulement, tandis que Miners et al. (3) ont été les premiers à montrer clairement les incohérences dans le classement de la sévérité de la SA et à proposer avec Dumesnil et al. (6) la nouvelle classification de la SA. Chez les patients présentant une AVA <1 cm2, quatre catégories de SA à gradient de débit peuvent être identifiées : débit normal/faible gradient (NF/LG), débit normal/haut gradient (NF/HG), faible débit/haut gradient (LF/HG) et faible débit/faible gradient (LF/LG). Le LF est défini comme un volume de course indexé du VG <35 ml/m2 et le LG comme un gradient de pression trans-aortique moyen <40 mmHg (12).
Débit normal/faible gradient
Ce schéma est observé chez 31-38% des patients et semble identifier un groupe de patients avec un degré de SA moins sévère – incohérence inhérente contenue dans les directives – ou qui a été exposé à la maladie pendant une période plus courte. Cette entité est caractérisée par une fonction myocardique longitudinale du ventricule gauche préservée, ce qui se traduit par un taux de BNP et un score de risque de Monin plus faibles (12,13). Le pronostic de ces patients semble être relativement préservé par rapport aux autres catégories.
Débit normal-gradient élevé
Ce schéma représente l’entité la plus prévalente (39-72%) et est tout à fait conforme aux critères proposés par les directives (4,5,12). En comparaison avec le groupe NF/LG, bien que la fonction longitudinale du VG soit préservée, le BNP est plus élevé et le taux de survie sans événement cardiaque de NF/HG est réduit. De plus, les patients atteints de NF/HG semblent avoir une SA plus sévère, ce qui suggère une plus longue exposition à cette maladie progressive. Lorsqu’ils sont symptomatiques, ces patients sont classiquement orientés vers une RVA, alors que lorsqu’ils sont asymptomatiques, la prise en charge de ces patients souligne la nécessité d’une stratification optimisée du risque.
Low flow-high gradient
Ce schéma représente 8% des patients atteints de SA sévère (4,12). Il se caractérise par un volume systolique indexé du VG <35 ml/m2 malgré une fraction d’éjection du VG préservée, un niveau de BNP et un score de risque de Monin élevés et une réduction significative de la fonction longitudinale du VG (14). Il convient de noter que la fraction d’éjection du ventricule gauche est une estimation grossière de la fonction systolique du ventricule gauche. La fraction d’éjection du ventricule gauche est influencée à la fois par la fonction myocardique intrinsèque et la géométrie de la cavité ventriculaire gauche. Par conséquent, pour un degré similaire de raccourcissement myocardique intrinsèque, la fraction d’éjection du VG aura tendance à augmenter en fonction de l’étendue du remodelage concentrique du VG. La fraction d’éjection du ventricule gauche peut donc nettement sous-estimer l’étendue de l’atteinte myocardique en présence d’un remodelage concentrique du ventricule gauche, comme c’est généralement le cas chez les patients atteints de SA. Ainsi, ce qui est normal pour un ventricule gauche à géométrie normale peut être anormal pour un ventricule gauche présentant un remodelage concentrique. De plus, la réduction du débit du ventricule gauche (liée à une dysfonction myocardique intrinsèque et à un remodelage important du ventricule gauche) peut, à son tour, entraîner des gradients transvalvulaires plus faibles que prévu. L’issue de ces patients est presque identique à celle des patients atteints de NF/HG. Lorsqu’ils sont symptomatiques, ces patients ont tendance à avoir une meilleure survie s’ils sont traités chirurgicalement.
Low flow-low gradient
La prévalence du pattern LF/LG semble être plus faible que ce qui a été initialement rapporté. Cette entité représente 7% chez les patients asymptomatiques et jusqu’à 15-35% chez les patients symptomatiques (4-6,12,14). Ce schéma, à savoir le SA paradoxal à faible débit, représente une entité clinique difficile qui a été récemment mise en évidence. Il est associé à un remodelage concentrique du ventricule gauche plus prononcé, à une cavité ventriculaire gauche plus petite, à une postcharge ventriculaire gauche globale accrue, à une dysfonction myocardique intrinsèque, à une fibrose myocardique et à un pronostic sombre (12,15). Chez les patients asymptomatiques, nous avons montré que la probabilité de rester en vie sans AVR à 3 ans était 5 fois plus faible que pour le modèle NF/LG et 4,3 fois plus élevée que dans le groupe NF/HG (12). Cette entité clinique est souvent mal diagnostiquée, ce qui peut conduire à une sous-estimation de la gravité de la SA et donc à une sous-utilisation ou à un retard inapproprié de la chirurgie. Il est important de reconnaître cette entité afin de ne pas refuser la chirurgie à un patient symptomatique avec une petite AVA et un LG.
Discordance entre le gradient et la surface valvulaire
Les causes potentielles de la discordance entre l’AVA et le gradient chez les patients ayant une fraction d’éjection ventriculaire gauche préservée comprennent (I) des erreurs de mesure ; (II) une petite taille corporelle ; (III) un SA paradoxal à faible débit ; et (IV) un classement incohérent lié aux divergences intrinsèques des critères des directives (4,6,7,10,11). Tout d’abord, les patients de petite taille et de petites dimensions peuvent présenter un gradient de pression transvalvulaire plus faible en raison d’un volume systolique inférieur, bien que normal. Deuxièmement, le volume systolique et donc l’AVA peuvent être sous-estimés en raison d’une sous-estimation de la voie de sortie du ventricule gauche et/ou d’un mauvais positionnement du volume de l’échantillon Doppler à ondes pulsées. Plusieurs méthodes peuvent être utilisées pour corroborer les mesures Doppler-échocardiographiques du volume systolique et de l’AVA. Par exemple, en l’absence de régurgitation mitrale significative, le volume systolique peut facilement être estimé par la méthode de Simpson (méthode volumétrique pour mesurer la fraction d’éjection et les volumes du ventricule gauche). Si le volume systolique mesuré par ces méthodes indépendantes est cohérent avec le volume systolique mesuré dans la voie de sortie du ventricule gauche, on peut être rassuré sur la précision de la mesure du volume systolique. Troisièmement, le LF/LG paradoxal représente une nouvelle entité dans laquelle l’état LF résulte à la fois d’un remodelage concentrique du LV et d’une fonction longitudinale sous-endocardique réduite. Cela souligne l’absence d’estimation erronée de la gravité de la SA. Quatrièmement, dans certains cas, la divergence de la relation gradient – surface de la valve peut être liée à des incohérences dans les directives actuelles. Une harmonisation de la définition de la SA sévère pourrait reclasser certains de ces patients atteints de SA « sévère » en SA « modérée ». Lorsque l’on combine les données cliniques prospectives actuelles avec les données antérieures de l’écho hémodynamique et les données invasives, il semble qu’un gradient de 40 mmHg corresponde davantage à une surface valvulaire de 0,8 cm2 alors qu’une surface valvulaire de 1 cm2 correspond à un gradient moyen de 26 mmHg (3,6,16). De plus, lorsqu’il y a une discordance entre la surface valvulaire (dans la fourchette sévère) et le gradient (dans la fourchette modérée) chez des patients ayant une fraction d’éjection ventriculaire gauche préservée, une évaluation échocardiographique Doppler plus complète et potentiellement d’autres tests diagnostiques (BNP, score calcique par tomodensitométrie multicoupe, échocardiographie d’effort/dobutamine) peuvent être nécessaires pour confirmer la sévérité de la maladie et guider la prise en charge thérapeutique.
Implications cliniques et prise en charge
Dans la pratique quotidienne, l’évaluation de la sévérité de la SA doit intégrer le schéma de gradient de flux à la mesure classique de l’AVA. En règle générale, un faible gradient trans-valvulaire (<40 mmHg) ou une faible vitesse (<4 m/s) n’exclut pas la présence d’une SA sévère chez les patients présentant une petite AVA et une fraction d’éjection du VG préservée. En outre, une fraction d’éjection du ventricule gauche préservée (>50%) n’exclut pas la présence d’une dysfonction systolique du myocarde et d’un faible débit transvalvulaire dans la SA. Les patients atteints de SA NF/LG n’ont classiquement pas ou peu de dysfonctionnement sous-endocardique et ont une issue relativement préservée. Dans cette catégorie NF/LG, l’indication de la RVA doit être limitée aux patients chez qui les symptômes peuvent être clairement attribués à la SA. Dans la catégorie NF/HG, la RVA (chirurgicale ou percutanée) est la seule thérapie qui améliore significativement la survie et les symptômes. Lorsqu’ils sont asymptomatiques, la stratification du risque individuel peut aider à identifier les patients qui peuvent bénéficier d’une chirurgie précoce. Dans les autres catégories, l’état de LF représente un témoin de dysfonctionnement myocardique intrinsèque et un processus pathologique plus avancé. Les patients symptomatiques présentant un LF/HG devraient également bénéficier d’une RVA rapide. Lorsqu’ils sont asymptomatiques, la stratification individuelle du risque doit également être encouragée. L’échocardiographie d’effort peut être intéressante en démasquant les patients présentant une compliance valvulaire limitée et/ou une réserve contractile du ventricule gauche épuisée (17,18). Un LF/LG paradoxal est synonyme de mauvais résultat même chez les patients asymptomatiques. Dans cette catégorie, bien que le bénéfice de la chirurgie ne soit pas prouvé, l’AVR peut probablement être bénéfique chez des patients symptomatiques sélectionnés (7,19,20) (Tableau 1). En pratique clinique, la détermination de cette entité est un défi. Avant d’envisager une intervention chirurgicale, les symptômes doivent être adaptés à la gravité de la SA. Chez les patients à faible risque, la RVA peut être préconisée. Chez les patients à haut risque, des études supplémentaires sur les résultats sont nécessaires pour déterminer la modalité et le moment les plus appropriés du traitement.
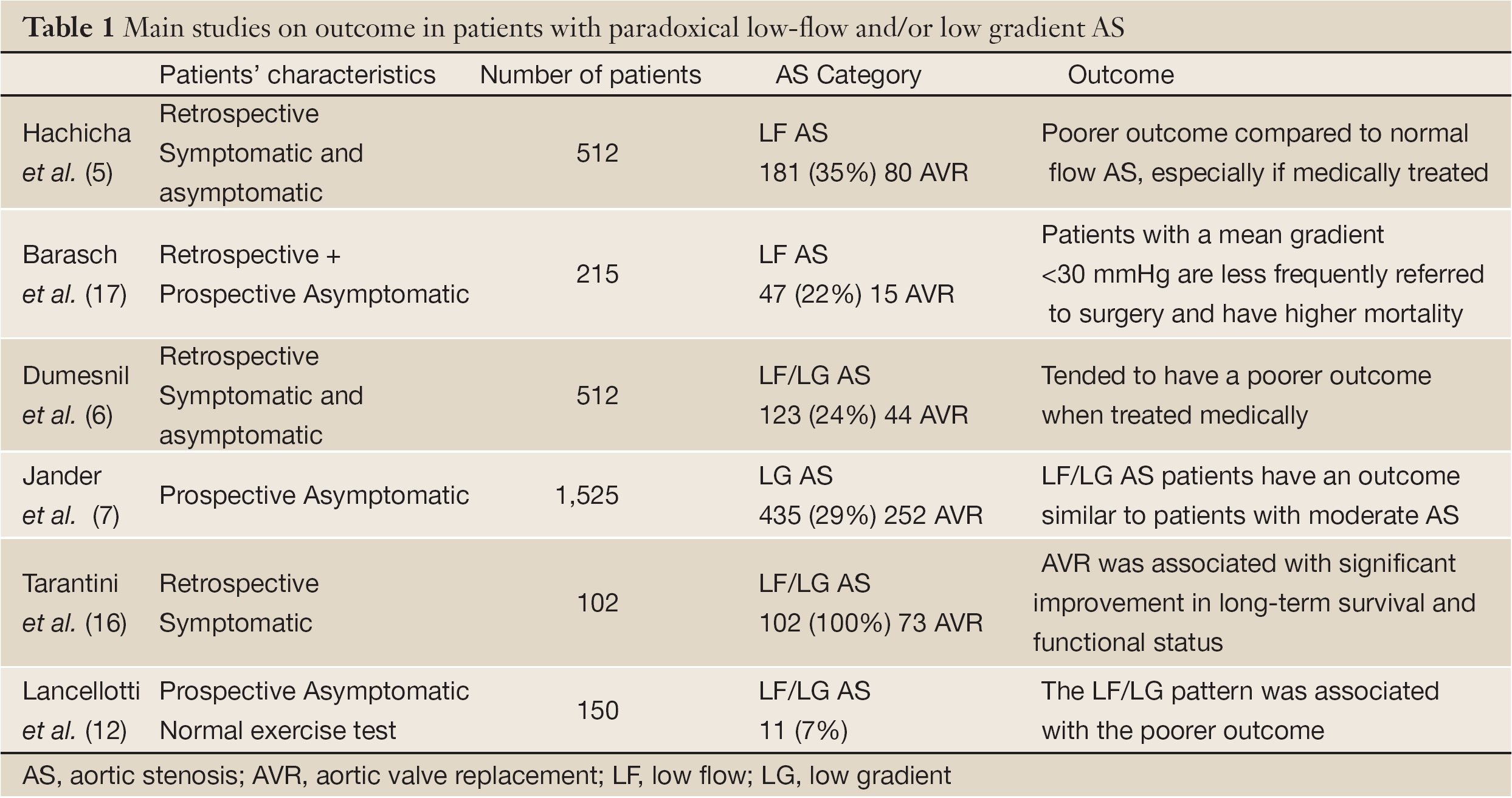
Tableau complet
Reconnaissances
Divulgation : Les auteurs ne déclarent aucun conflit d’intérêts.
- Lancellotti P, Donal E, Magne J, et al. Stratification du risque dans la sténose aortique modérée à sévère asymptomatique : l’importance de l’interaction valvulaire, artérielle et ventriculaire. Heart 2010;96:1364-71.
- Bonow RO, Carabello BA, Kanu C, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease : a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease) : developed in collaboration with the Society of Cardiovascular Anesthesiologists : endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons. Circulation 2006;114:e84-231.
- Minners J, Allgeier M, Gohlke-Baerwolf C, et al. Inconsistent grading of aortic valve stenosis by current guidelines : haemodynamic studies in patients with apparently normal left ventricular function. Heart 2010;96:1463-8.
- Adda J, Mielot C, Giorgi R, et al. Low-Flow, Low-Gradient Severe Aortic Stenosis Despite Normal Ejection Fraction Is Associated With Severe Left Ventricular Dysfunction as Assessed by Speckle-Tracking Echocardiography : A Multicenter Study. Circ Cardiovasc Imaging 2012;5:27-35.
- Hachicha Z, Dumesnil JG, Bogaty P, et al. La sténose aortique sévère paradoxale à faible débit et faible gradient malgré une fraction d’éjection préservée est associée à une postcharge plus élevée et à une survie réduite. Circulation 2007;115:2856-64.
- Dumesnil JG, Pibarot P, Carabello B. Paradoxal low flow and/or low gradient severe aortic stenosis despite preserved left ventricular ejection fraction : implications for diagnosis and treatment. Eur Heart J 2010;31:281-9.
- Jander N, Minners J, Holme I, et al. Outcome of patients with low-gradient « severe » aortic stenosis and preserved ejection fraction. Circulation 2011;123:887-95.
- Ozkan A. Sténose aortique « sévère » à faible gradient avec fraction d’éjection ventriculaire gauche préservée. Cardiovasc Diagn Ther 2012;2:19-27.
- Dumesnil JG, Pibarot P, Akins C. Nouvelles approches pour quantifier la gravité de la sténose aortique. Curr Cardiol Rep 2008;10:91-7.
- Pibarot P, Dumesnil JG. Évaluation de la sévérité de la sténose aortique : quand le gradient ne correspond pas à la surface de la valve. Heart 2010;96:1431-3.
- Lancellotti P, Magne J. Impédance valvuloartérielle dans la sténose aortique : regardez la charge, mais n’oubliez pas le flux. Eur J Echocardiogr 2011;12:354-7.
- Lancellotti P, Magne J, Donal E, et al. Clinical outcome in asymptomatic severe aortic stenosis insights from the new proposed aortic stenosis grading classification. J Am Coll Cardiol 2012;59:235-43.
- Monin JL, Lancellotti P, Monchi M, et al. Risk score for predicting outcome in patients with asymptomatic aortic stenosis. Circulation 2009;120:69-75.
- Lancellotti P, Donal E, Magne J, et al. Impact of global left ventricular afterload on left ventricular function in asymptomatic severe aortic stenosis : a two-dimensional speckle-tracking study. Eur J Echocardiogr 2010;11:537-43.
- Herrmann S, Störk S, Niemann M, et al. Fibrose myocardique de la sténose de la valve aortique à faible gradient et son influence sur la fonction et le résultat. J Am Coll Cardiol 2011;58:402-12.
- Zoghbi WA. Sténose aortique « sévère » à faible gradient avec une fonction systolique normale : il est temps d’affiner les directives ? Circulation 2011;123:838-40.
- Lancellotti P, Lebois F, Simon M, et al. Importance pronostique de l’échocardiographie Doppler d’exercice quantitative dans la sténose aortique valvulaire asymptomatique. Circulation 2005;112:I377-82.
- Maréchaux S, Hachicha Z, Bellouin A, et al. Utilité de l’échocardiographie de stress à l’effort pour la stratification du risque des patients réellement asymptomatiques atteints de sténose valvulaire aortique. Eur Heart J 2010;31:1390-7.
- Tarantini G, Covolo E, Razzolini R, et al. Remplacement valvulaire pour sténose aortique sévère avec faible gradient transvalvulaire et fraction d’éjection ventriculaire gauche supérieure à 0,50. Ann Thorac Surg 2011;91:1808-15.
- Barasch E, Fan D, Chukwu EO, et al. Sténose aortique isolée sévère avec fonction systolique ventriculaire gauche normale et faibles gradients transvalvulaires : aperçus physiopathologiques et pronostiques. J Heart Valve Dis 2008;17:81-8.