Le tétrachlorure de carbone peut être exprimé par CCl4, et il est constitué d’une molécule de carbone et de quatre molécules de chlorure. Le tétrachlorure de carbone est non polaire. Pourquoi le tétrachlorure de carbone est-il non polaire ? Il est non polaire parce que les moments dipolaires de la molécule sont uniformément répartis autour de l’atome de carbone central. Cela signifie que leurs effets individuels s’annulent, et que la molécule est neutre.
Les quatre atomes de chlore sont positionnés symétriquement aux quatre coins d’un tétraèdre, et une liaison simple relie chacun d’eux à l’atome de carbone au centre de la molécule. Par conséquent, CCl4 n’a pas de moment dipolaire positif ou négatif net. Si un atome autre que le chlore avait été positionné à n’importe quel autre endroit dans une molécule, la molécule aurait un moment dipolaire et CCl4 serait polaire en conséquence.
« Nous définissons la chimie organique comme la chimie des composés du carbone. » – August Kekule
C’est la réponse rapide concernant la polarité du tétrachlorure de carbone. Cependant, il serait bénéfique de parler de la polarité des molécules en général et d’examiner le tétrachlorure de carbone et ses propriétés pour comprendre pourquoi il est non polaire dans la nature.
Que signifie la polarité d’une molécule ?
Lorsque vous entendez le terme polaire, vous pensez probablement aux pôles nord et sud de la terre. Ces pôles nord et sud sont situés aux extrémités opposées de la terre, de la même façon qu’une batterie peut avoir un pôle positif et un pôle négatif. Les molécules et les liaisons entre les atomes peuvent également présenter une polarité. Une molécule est définie comme polaire lorsque les atomes qui la constituent sont disposés de manière à donner à une extrémité de la molécule une charge positive et à l’autre extrémité de la molécule une charge négative.
Une molécule polaire est créée lorsqu’un atome qui a un niveau d’électronégativité élevé se combine ou se lie avec un atome qui a un niveau d’électronégativité plus faible. La molécule résultante possède une région à haute électronégativité et une région à plus faible électronégativité ou pôles électriques. L’un des exemples les plus célèbres de molécule polaire est l’eau, et c’est grâce à la nature polaire de l’eau qu’elle sert de base à la vie sur terre.
A l’inverse, les molécules non polaires sont dépourvues de pôles électriques, et les électrons en leur sein sont répartis de manière plus égale. Les molécules non polaires n’ont pas de charge notable à chaque extrémité de la molécule. La plupart des liquides hydrocarbonés sont de nature non polaire.
En somme, une molécule dont les dipôles ne s’annulent pas est polaire, alors que les molécules non polaires sont celles où les charges des atomes s’annulent et où il n’y a pas de charge à une extrémité de la molécule ou à l’autre.
Exemples de molécules polaires
Comme mentionné précédemment, l’eau est une molécule polaire. Les liaisons qui existent entre les atomes d’oxygène et les atomes d’hydrogène sont distribuées de telle sorte que les deux côtés de l’atome, les deux liaisons oxygène-hydrogène et, sont espacées de manière égale. Le résultat est que le côté oxygène, ou le haut de la molécule, a une charge légèrement négative tandis que les atomes d’hydrogène, ou le bas de la molécule, ont une charge légèrement positive.
L’éthanol est une molécule polaire parce que les atomes d’oxygène qui sont dans la molécule ont une électronégativité plus grande que les autres atomes. Les atomes d’oxygène attirent plus d’électrons en raison de leur potentiel d’électronégativité plus élevé, et les groupes de liaison -OH dans la molécule ont des charges négatives dans l’ensemble, même si la charge négative est très légère.
« La vie existe dans l’univers uniquement parce que l’atome de carbone possède certaines propriétés exceptionnelles. » – James Jeans
ADVERTISSEMENT
Autres exemples de molécules polaires : le dioxyde de soufre (SO2), le sulfure d’hydrogène (H2S) et l’ammoniac (NH3).
Avertissez-vous qu’une molécule peut être composée de liaisons polaires tout en étant non polaire. Un exemple est le dioxyde de carbone, qui a quatre liaisons et pourtant les moments dipolaires de la molécule finissent par se neutraliser mutuellement, de sorte que la molécule est non polaire.
Exemples de molécules non polaires

Les exemples de molécules non polaires comprennent l’azote, le méthane, l’ozone et l’oxygène. Ce sont des molécules homonucléaires ou des molécules composées d’atomes d’un seul élément. Les molécules non polaires qui ne sont pas homonucléaires comprennent le dioxyde de carbone, mentionné ci-dessus, et le méthane. Le toluène et l’essence sont également des exemples de substances non polaires. En règle générale, les composés du carbone sont non polaires, bien qu’il y ait quelques exceptions, comme le monoxyde de carbone. Le monoxyde de carbone est de nature linéaire, ce qui rendrait habituellement une molécule non polaire, mais la différence d’électronégativité entre les molécules d’oxygène et de carbone est suffisamment importante pour que la molécule soit polaire. Les alcynes ne se dissolvent pas dans l’eau et sont considérés comme des molécules non polaires. Les gaz inertes ou nobles sont également classés comme des molécules non polaires parce que les gaz ne sont que des atomes uniques de leurs éléments respectifs, comme le néon, l’hélium, l’argon et le krypton.
Prédire la polarité d’une molécule
L’examen des valeurs d’électronégativité des atomes d’une molécule vous aidera à déterminer si la molécule est susceptible d’être polaire ou non polaire. Des différences significatives entre les valeurs d’électronégativité impliquent que les électrons sont également partagés entre les atomes de la molécule. Comme les électrons seront plus proches d’un atome que d’un autre, cette région de la molécule sera polaire, bien que pour déterminer la polarité de la molécule entière, toutes les liaisons doivent être prises en compte.
Le facteur décisif de la polarité ou de la non-polarité d’une molécule est sa géométrie. Si une extrémité de la molécule a une charge négative alors que l’autre extrémité de la molécule a une charge positive, la molécule sera polaire. En revanche, si les charges sont réparties uniformément et gravitent autour d’un atome central, la molécule est probablement non polaire. Vous pouvez utiliser cette information pour prédire si une molécule sera polaire ou non polaire. Toutes les molécules n’ont pas un moment dipolaire, ce qui peut rendre la prédiction de la polarité d’une molécule un peu plus difficile. A titre d’exemple, les molécules qui peuvent être retournées et reflétées à travers un plan géométrique, n’ont pas de moment dipolaire parce que les moments dipolaires ne peuvent pas comprendre plus d’un seul point.
Faits sur le tétrachlorure de carbone
Le tétrachlorure de carbone a été découvert pour la première fois par le chimiste français Henri Victor Regnault au milieu des années 1800. Ce produit chimique a été découvert grâce à une combinaison de chlore et de chloroforme. Malgré cela, le tétrachlorure de carbone est aujourd’hui principalement dérivé du méthane. La production de tétrachlorure de carbone se fait souvent en utilisant les sous-produits des réactions de chloration pour obtenir le composé. Il s’agit notamment des sous-produits de la création du chloroforme et du dichlorométhane. Le tétrachlorure de carbone est de nature assez volatile, dégageant une odeur similaire à celle des produits chimiques de nettoyage à sec. Le tétrachlorure de carbone est également un solvant et est donc utile pour dissoudre des substances non polaires comme les huiles et les graisses.
Le tétrachlorure de carbone a de nombreuses applications différentes et a été utilisé comme agent de nettoyage, comme réfrigérant et dans les extincteurs. Le tétrachlorure de carbone est souvent utilisé dans la création de lampes à lave, rendant la cire plus lourde.
« … La molécule de carbone est-elle tapissée de pensée ? ». – Saul Bellow
En raison de l’impact environnemental du tétrachlorure de carbone, sa production a fortement diminué depuis les années 1980. Le protocole de Montréal a limité la production de chlorofluorocarbones, et comme le tétrachlorure de carbone est un ingrédient clé dans la création des CFC, le tétrachlorure de carbone a vu sa production fortement diminuer en conséquence. Les effets néfastes du tétrachlorure de carbone sur la santé ont également entraîné une diminution de sa production, et bien qu’il ait été autrefois largement utilisé comme solvant, il est rarement utilisé à ces fins de nos jours.
Le tétrachlorure de carbone est extrêmement toxique pour le foie, et d’autres substances endommageant le foie sont souvent comparées à la toxicité du tétrachlorure de carbone. De fortes concentrations de tétrachlorure de carbone peuvent non seulement endommager le foie, mais aussi les reins. Une exposition prolongée au tétrachlorure de carbone peut provoquer un coma ou la mort. L’exposition à ce produit chimique pourrait également augmenter les chances de développer un cancer.
Pourquoi le tétrachlorure de carbone est-il polaire?
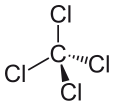
Après avoir vu ce qui rend une molécule polaire, et regardé quelques exemples de molécules polaires, nous pouvons maintenant mieux comprendre pourquoi le tétrachlorure de carbone est une molécule non polaire. La première chose à faire pour déterminer si une molécule est polaire ou non polaire est de calculer les valeurs d’électronégativité des atomes de la molécule. La polarité de la liaison entre deux atomes doit être vérifiée, et toutes les liaisons doivent être prises en compte pour déterminer la polarité de la molécule. Cependant, la différence des valeurs d’électronégativité entre le chlorure et le carbone, dans le cas du tétrachlorure de carbone, n’est pas le seul facteur à prendre en compte. La forme de la molécule doit également être prise en compte. Bien qu’il y ait des dipôles présents dans la molécule, la forme linéaire du tétrachlorure de carbone signifie que les effets des différents moments dipolaires dans la molécule s’annulent, et la molécule est neutre ou non polaire en conséquence.