Vu l’abondance des fonctions qu’un bioréacteur doit remplir, vous vous demandez peut-être comment il peut tout faire. De quels composants a-t-il besoin ? Comment savoir quelles sont les conditions actuelles dans le bioréacteur et comment les corriger ? Et enfin, juste pour la perspective : comment prendre les données capturées au cours d’un bioprocessus par lots, les afficher de manière significative, puis les enregistrer et les évaluer tout en les gardant organisées ?
Les paramètres de processus les plus importants et les mécanismes permettant de les réguler sont abordés ci-dessous :
- Mélange de la culture
- Contrôle de la température
- Contrôle du pH
- Alimentation en nutriments
- Gazage
- Contrôle de la pression
- . contrôle
- Prévenir la formation de mousse
Mélange de la culture
La culture dans un bioréacteur doit être mélangée soigneusement à tout moment. Si les nutriments dans le bioréacteur ne sont pas assez bien dispersés, les conditions dans certaines parties du bioréacteur s’écarteront considérablement de l’idéal. Le pH pourrait être trop acide, par exemple, ou l’apport en nutriments pourrait être insuffisant. De tels écarts réduisent non seulement l’efficacité du bioprocessus prévu, mais peuvent également favoriser les modifications génétiques. La répartition de la température est une préoccupation supplémentaire. En l’absence d’un brassage uniforme, les micro-organismes ou les cultures cellulaires situés sur le bord du récipient seront littéralement bouillis, tandis que ceux du milieu auront froid aux yeux. Si vous avez déjà fait chauffer une soupe au micro-ondes et l’avez ensuite mangée avec beaucoup d’impatience sans la remuer, vous saurez ce que nous voulons dire.
La vitesse de brassage typique varie entre autres selon l’organisme cultivé :
| Organisme | Vitesse de mélange | ||||
| Bactéries, Levures, Champignons | 500 – 1500 min-1 | ||||
| Mammifères, Insectes ou cellules végétales | 30 – 300 min-1 | ||||
L’ajustement des vitesses d’agitation pour cultiver soit des micro-organismes, des cellules végétales, des cellules animales ou des cellules d’insectes est très important, car ceux-ci réagissent différemment à la contrainte de cisaillement, c’est à dire.e., la contrainte mécanique causée par l’agitation. Selon la lignée cellulaire, les cultures de cellules peuvent avoir une réaction beaucoup plus intense à une agitation trop vigoureuse, c’est-à-dire qu’elles meurent tout simplement, une tendance que les scientifiques décrivent plus précisément (et diplomatiquement) comme étant « sensible au stress de cisaillement ». La disponibilité de l’oxygène peut être modifiée au cours du bioprocédé en changeant la vitesse d’agitation, ce qui permet d’assurer une croissance cellulaire optimale.
Mesurer et contrôler la température
Les micro-organismes comme les cultures cellulaires ont des enzymes qui fonctionnent mieux dans certaines plages de température et de pH. Si les conditions se situent en dehors de ces plages, le bioprocédé souhaité se déroulera beaucoup plus lentement, car la croissance et les performances métaboliques dépendent fortement de ces enzymes, c’est-à-dire de protéines catalytiquement actives. Dans le pire des cas, des conditions environnementales défavorables peuvent même les détruire. Les cultures de cellules de mammifères sont plus à l’aise dans une plage de températures très étroite – une plage qui n’est présente de leur point de vue que lorsque la température à l’intérieur du récipient de culture est de 37 °C.
Par conséquent, un capteur à résistance de platine connu sous le nom de capteur Pt100 est utilisé dans le bioréacteur pour déterminer la température. Il présente une résistance de 100 Ω à 0 °C, et couvre assez bien la plage de mesure biologiquement pertinente attendue lorsqu’il est étalonné de manière appropriée.
La plage de température typique varie entre autres en fonction de l’organisme cultivé :
| Organisme | Plage de température | ||||
| Bactéries, Levures, Champignons | +20 °C à +60 °C | ||||
| Mammifères, Insectes ou cellules végétales | +25 °C à +37 °C | ||||
Si vous travaillez à des températures proches ou inférieures à la température ambiante, vous aurez besoin d’un système de refroidissement actif tel qu’un refroidisseur à recirculation. Pour la plupart des bioprocédés, la température doit rester constante pendant toute la durée de la culture. Cependant, pour certains produits, comme la pénicilline ou les protéines recombinantes (c’est-à-dire les protéines issues de la bio-ingénierie utilisant des organismes génétiquement modifiés), le changement de température à la fin de la phase de croissance active des gènes importants pour la formation du produit et est donc bénéfique. Pour les méthodes de production impliquant des cultures cellulaires, la température est parfois abaissée à la fin du bioprocessus également (technique connue sous le nom de « décalage de température » en biotechnologie) afin que le produit fini reste stable pour une utilisation ultérieure.
Il existe plusieurs façons d’utiliser un circuit de chauffage et/ou de refroidissement pour réguler la température :
-
-
- Un bloc chauffant électrique avec spirale de refroidissement intégrée
- Un coussin chauffant en silicone enroulé autour du récipient de culture après stérilisation
- Une double enveloppe dans laquelle circule de l’eau. La température est ajustée via un chauffage électrique ou de la vapeur et une électrovanne pour l’admission d’eau de refroidissement
-
Mesure et contrôle du pH
La mesure et le contrôle du pH est un aspect très important des bioprocédés, car les changements de pH peuvent modifier de manière significative les conditions de croissance – généralement avec des conséquences majeures. Les milieux de culture comprennent généralement des tampons, c’est-à-dire des substances qui atténuent les changements trop soudains du pH causés par l’ajout d’un acide ou d’une base. Comme un acide qui s’écoule dans le milieu de culture peut endommager de nombreuses lignées cellulaires, les scientifiques enrichissent souvent soigneusement le mélange gazeux utilisé dans la culture cellulaire avec du CO2 plutôt que d’ajouter un acide liquide. Le gaz se dissout alors dans le milieu de culture, permettant au dioxyde de carbone d’influencer le pH en combinaison avec un tampon.
Gammes de pH typiques selon l’organisme cultivé:
| Organisme | pH | ||||
| Bactéries, levures, champignons | 4.5 – 7.0 | ||||
| Cellules de mammifères | 6.7 – 7.4 | ||||
| Cellules d’insectes | 6.2 – 6.9 | ||||
| Cellules de plantes | 5.5 | ||||
Pour mesurer le pH au cours du bioprocédé, chaque bioréacteur est équipé d’un capteur de pH dit électrode combinée de pH. Le bioréacteur peut corriger les déviations du pH ; à cet effet, une solution acide et/ou alcaline est mise à disposition et reliée au récipient de culture par des tubes et des pompes. La concentration de l’acide et de la base doit être choisie avec soin pour que cela fonctionne : si elle est trop élevée, les gouttes d’acide ou de base concentrée peuvent endommager les micro-organismes et les cultures cellulaires avant qu’ils ne soient distribués dans le bioréacteur. Si, au contraire, la concentration est trop faible, les opérateurs devront ajouter plus d’acide ou de base, diluant inutilement le milieu de culture.
Ajout de nutriments
Au cours d’un bioprocessus, les micro-organismes consomment généralement un large éventail de nutriments. La composition de base d’un milieu nutritif est généralement constituée d’eau, d’une source d’énergie utilisable par l’organisme (par exemple, le glucose), ainsi que des nutriments dont il a besoin (carbone, azote et phosphore), de sels et d’oligo-éléments. Selon l’organisme, d’autres composés sont nécessaires qui ne peuvent être synthétisés par soi-même (vitamines, acides aminés essentiels, etc.).
Selon la stratégie du bioprocédé, ces nutriments sont soit tous mis à disposition au début du bioprocédé (bioprocédé discontinu), soit ajoutés au fil du temps comme dans un procédé fed-batch ou dans un procédé continu.
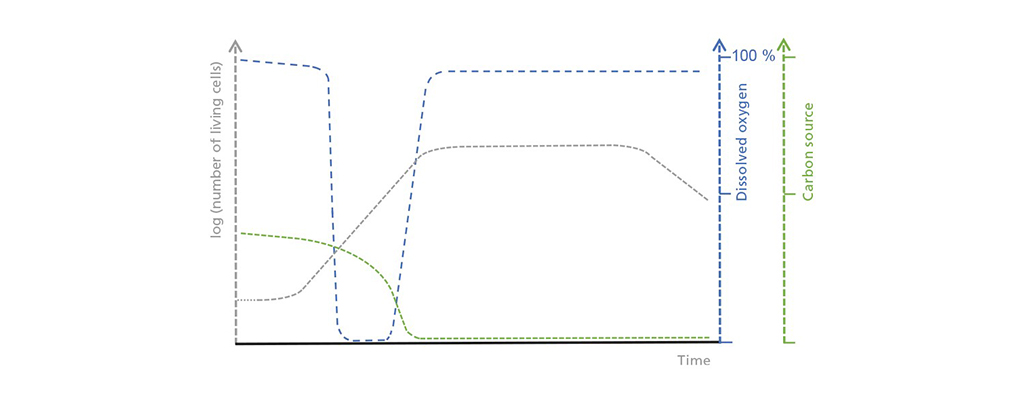
Illustration schématique des corrélations entre la concentration de cellules vivantes, l’oxygène dissous et la source de carbone limitante dans un fonctionnement par lots. Dans la phase initiale de latence, le nombre de cellules vivantes n’augmente que lentement, ce qui entraîne une absorption modérée mais régulière de la source de carbone. La consommation d’oxygène augmente pendant la phase de croissance exponentielle jusqu’à ce qu’elle dépasse l’apport d’oxygène possible. Une fois la source de carbone épuisée, la phase stationnaire commence et est suivie d’une phase morte, pendant laquelle le nombre de cellules vivantes diminue drastiquement.
Si vous souhaitez en savoir plus sur les différentes stratégies d’alimentation, jetez un coup d’œil à notre article de blog : La différence entre les procédés discontinus, Fed-batch et continus.
Gazage
Pendant le bioprocédé, le bioréacteur alimente un mélange gazeux stérile tel que l’air dans le milieu de culture. L’agitation constante ne distribue pas seulement les nutriments – elle réduit également la taille des bulles de gaz qui apparaissent dans le récipient de culture, libérant ainsi efficacement l’oxygène dans la solution nutritive. Ceci est important, car les micro-organismes et les cultures cellulaires ne peuvent absorber que l’oxygène qui a été dissous dans la solution nutritive.
Les besoins en oxygène varient : les bactéries aérobies ont besoin d’oxygène, tandis que d’autres préfèrent les mélanges gazeux tels que le gaz de synthèse (« syngas »). Les organismes anaérobies, en revanche, peuvent se passer entièrement de gazage, se nourrissant uniquement de substances inorganiques et organiques du milieu de culture, comme le nitrate ou le fumarate.
Contrairement aux micro-organismes, les cultures cellulaires sont gazées avec plus que de l’air – la teneur en oxygène du mélange gazeux peut également être influencée en utilisant de l’azote pur et de l’oxygène pur. La composition exacte dépend de l’application de la culture cellulaire. Afin de maintenir l’atmosphère gazeuse constante, le bioréacteur a besoin de systèmes de contrôle précis.
Au début du bioprocessus, par exemple, une culture a souvent besoin de moins d’oxygène – et donc d’une plus petite alimentation en gaz – car la croissance progresse encore lentement. Plus tard, cependant, une croissance plus rapide nécessite beaucoup plus d’oxygène. En plus d’assurer un approvisionnement constant du gaz ou du mélange de gaz souhaité, le bioréacteur fournit également la bonne quantité de gaz au bon moment. Pour ce faire, le bioréacteur possède des orifices de gaz reliés à l’air pressurisé du bâtiment, à un compresseur ou à une bouteille de gaz.
Le débit de gazage est généralement mesuré en litres par minute. Afin d’avoir un paramètre générique applicable à divers bioréacteurs, le taux est aussi fréquemment indiqué comme le taux de gazage spécifique, qui se réfère à des multiples du volume de travail (volumes de la cuve par minute, vvm) et est exprimé en min-1. Une valeur typique pour les bioprocédés microbiens est de 1 à 1,5 fois le volume de travail par minute. Pour un bioréacteur avec un volume de travail de 4 L, le taux de gazage maximal serait donc de 4 L * 2 L L-1 min-1 = 8 L min-1. Dans les cultures cellulaires, en revanche, le taux maximal est souvent de 10 à 15 % du volume de travail par minute, ce qui est un moyen de garder les bulles de gaz petites et d’éviter ainsi la formation de mousse et les dommages causés aux cellules par l’éclatement des bulles.
La modification du taux de gaz, cependant, n’est pas le seul moyen de contrôler l’efficacité avec laquelle le bioréacteur fournit de l’oxygène et d’autres gaz au milieu de culture. Plus la surface du nombre total de toutes les bulles de gaz dans le bioréacteur est grande – c’est-à-dire plus les bulles de gaz elles-mêmes sont finement réparties – plus l’oxygène sera transféré efficacement de la phase gazeuse à la phase liquide. Cela signifie, par exemple, que l’augmentation de la vitesse d’agitation peut améliorer l’oxygénation des micro-organismes, car l’agitateur rend les bulles de gaz encore plus petites et augmente ainsi la surface totale de toutes les bulles de gaz dans le bioréacteur.
La régulation précise de la pO2 – et donc le contrôle précis de la vitesse de gazage et de la composition du gaz – est très importante car, normalement, la pO2 ne devrait pas être le facteur inhibiteur de croissance de la culture. Cependant, si elle est insuffisamment contrôlée, la pO2 devient le facteur limitant.
Comme l’alimentation en gaz du bioréacteur est généralement sèche, l’humidité du bioréacteur peut être collectée dans le flux de sortie pendant le gazage. À un taux de gazage élevé, non seulement le niveau de remplissage baisserait, mais l’humidité bloquerait également le filtre d’évacuation, empêchant une évacuation correcte et permettant à la pression de s’accumuler. Pour éviter cet effet, les bioréacteurs sont équipés d’un refroidisseur d’échappement efficace où l’humidité de l’échappement se condense et peut s’égoutter dans le bioréacteur avant d’atteindre le filtre d’échappement.
Mesure et contrôle de la pression
Plus la pression dans le récipient est élevée, plus l’oxygène est dissous. Les récipients de culture en verre ne sont souvent homologués que pour une pression maximale de 0,5 bar, ce qui ne représente même pas la moitié de la pression d’un pneu de vélo modérément rempli. À une pression de service plus élevée, les récipients de culture en verre légèrement endommagés peuvent éclater, ce qui constitue un risque pour la sécurité. C’est pourquoi il faut toujours veiller à ce que la conduite d’évacuation du bioréacteur soit libre et sans pression en gardant le filtre d’évacuation sec et en le remplaçant régulièrement – ce faisant, vous garantissez également l’intégrité du récipient de culture, bien entendu. Contrairement aux récipients de culture en verre, les bioréacteurs en acier inoxydable sont conçus pour des pressions plus élevées et, même dans leur configuration standard, ils peuvent supporter des pressions allant jusqu’à 2 bars (un pneu de vélo bien rempli). De plus, les systèmes de ce type sont souvent équipés d’un mécanisme de contrôle de la pression basé sur un capteur de pression dans le bioréacteur et une vanne proportionnelle dans la ligne d’échappement. Non seulement ceux-ci peuvent mesurer la pression dans le bioréacteur – ils peuvent également la contrôler activement.

Prévenir la formation de mousse
En dehors des baignoires et des verres de bière, la mousse est un effet secondaire plutôt impopulaire, en particulier dans les bioréacteurs. La mousse se forme à l’interface entre la phase liquide et la phase gazeuse dans le récipient de culture et peut rapidement se retrouver sous la plaque supérieure. Dans le pire des cas, elle bloque alors le filtre d’évacuation, qui à son tour bloque le flux de gaz. La plupart des bioréacteurs sont donc équipés d’un système permettant de lutter contre la formation de mousse. Les briseurs de mousse mécaniques dans l’espace de tête sont réservés aux bioréacteurs en acier inoxydable plutôt grands, tandis que les systèmes de contrôle antimousse basés sur des agents chimiques (tels que les antimousses à base de PPG, de Struktol ou de silicium) peuvent être trouvés dans des bioréacteurs plus petits.
Un système de contrôle antimousse typique consiste en un capteur installé à une hauteur spécifique dans le récipient de culture. Si la hauteur de la mousse atteint le capteur, un agent antimousse est pompé d’un réservoir dans le récipient de culture. Ces agents anti-mousse sont actifs à l’interface liquide-gaz et augmentent la tendance des bulles de mousse à s’effondrer. Dans les cas particulièrement tenaces où la mousse ne se dissout pas immédiatement, répétez la procédure après un temps prédéfini (une stratégie de « retardement du tir & »). La prudence est de mise lors de l’utilisation d’un agent antimousse – si vous en mettez même un peu plus que nécessaire, il peut se déposer comme une seconde peau à la surface du liquide, ce qui entrave l’échange de gaz. Les agents antimousse s’opposent également à un transfert efficace de l’oxygène, car la modification de la tension superficielle favorise l’effondrement des bulles de gaz dans le bioréacteur, réduisant ainsi la surface disponible pour l’échange gazeux. Le choix de l’agent approprié dépend également du bioprocessus en question, car les bactéries et les cellules réagissent différemment à certains produits chimiques.
Bonus : les avantages de l’utilisation d’un logiciel SCADA
De nos jours, les résultats générés dans un bioréacteur doivent être collectés et évalués de manière aussi centralisée que possible, car c’est le seul moyen de mettre en œuvre efficacement les algorithmes modernes de big data afin de générer davantage d’informations et de mieux comprendre le fonctionnement d’un processus. C’est le rôle du logiciel SCADA. Dans un premier temps, toutes les données du bioréacteur peuvent être lues – sans apport majeur de la part de l’utilisateur – et stockées de manière centralisée afin de les évaluer seules ou de les comparer à d’autres données de lot. Cela donne rapidement des idées pour de nouvelles expériences, voire des stratégies de lots complexes. Un logiciel SCADA professionnel vous permet de les planifier facilement, puis de contrôler le bioréacteur, qui sera idéalement un processus entièrement automatisé. En outre, le logiciel SCADA intègre également plusieurs composants dans l’environnement du bioréacteur. Il s’agit notamment d’outils d’optimisation du processus à l’aide de la technique du plan d’expérience (DoE) ou de puissants capteurs logiciels, qui peuvent être utilisés simultanément pour calculer des informations supplémentaires directement à partir des paramètres du processus de traitement par lots et même pour réguler ces paramètres. Par exemple, le quotient respiratoire (RQ) peut être utilisé pour obtenir une estimation de l’activité métabolique au moyen du rapport entre le dioxyde de carbone excrété et l’oxygène absorbé.
Il existe tellement de possibilités – surtout lorsque le bioréacteur et le logiciel SCADA sont parfaitement adaptés – que nous ne pourrions pas toutes les décrire. Si vous souhaitez en savoir plus sur tout ce qu’un logiciel SCADA moderne a à offrir, jetez un coup d’œil au logiciel eve® bioprocess platform

.