
Auparavant, la science derrière la vie à base de silicium a été déterminée comme étant de la science fiction. Les composés de silicium sont limités à des arrangements cristallins invariables, alors que les composés de carbone, à savoir les organiques, peuvent former une grande variété de molécules telles que n’importe quel arrangement moléculaire stable pourrait être formé spontanément et que la sélection naturelle favoriserait les molécules qui supportent la vie. Dans la compétition prébiotique entre les bases silicium et carbone de la vie, le carbone dominerait très probablement. Mais envisageons l’alternative où l’eau serait remplacée par un produit chimique très familier, mais improbable. La vie pourrait-elle exister dans un monde dominé par des océans, des lacs et des rivières d’ammoniac ?
La panne
L’ammoniac est une substance toxique pour les humains, les insectes et même les bactéries. C’est le principal ingrédient de certains solvants industriels et solutions de nettoyage et il est dangereux pour l’environnement. L’ammoniac est même un élément essentiel d’une recette utilisée pour fabriquer des explosifs à haut rendement. Comment un produit aussi mortel que l’ammoniac pourrait-il permettre l’émergence et l’évolution d’organismes vivants ? Croyez-le ou non, l’ammoniac a beaucoup de propriétés moléculaires identiques à celles d’un autre composé familier et essentiel à la vie : l’eau. Certains astrobiologistes proposent que la vie puisse évoluer dans un milieu ammoniacal de la même manière que la vie sur Terre s’est développée dans un milieu hydraté. Imaginez : la même substance connue pour dissoudre les métaux, brûler la peau, polluer l’environnement et exploser si elle est mal mélangée pourrait très bien être » l’eau de la vie » sur certains mondes extraterrestres (et je ne parle pas de Dune).
Voyons d’abord pourquoi l’ammoniac est un candidat potentiel. L’ammoniac et l’eau sont tous deux des molécules polaires. Les électronégativités des atomes d’oxygène et d’azote sont supérieures à l’électronégativité de leurs homologues d’hydrogène. La différence d’électronégativité entre l’atome central (azote ou oxygène) et les atomes d’hydrogène rend les molécules polaires. L’atome central adopte une charge légèrement négative et les hydrogènes deviennent légèrement positifs. Cela fait de l’ammoniac et de l’eau des solvants puissants, car ils peuvent dissoudre les sels et les petites molécules polaires.
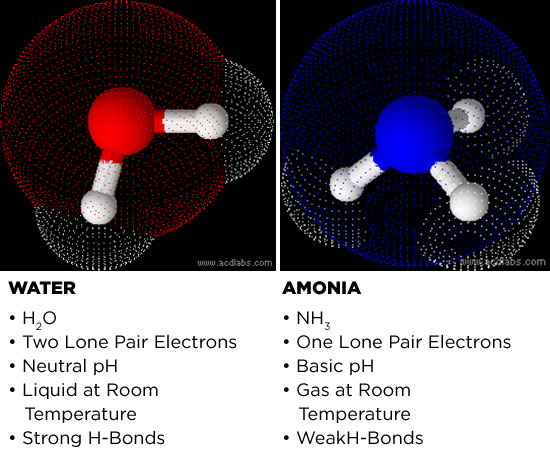
Plusieurs des propriétés physiques de l’eau sont également partagées par l’ammoniac. Les deux milieux peuvent conduire l’électricité, bien que faiblement, et la coordination des hydrogènes chargés positivement avec les parties chargées négativement sur les molécules voisines forme l’une des plus fortes forces intermoléculaires connues en chimie : la liaison hydrogène. Cela revient à prendre un objet ayant une charge positive à une extrémité et à le lier électrostatiquement à une charge négative sur un autre objet. En termes simples, les liaisons hydrogène permettent aux molécules polaires de très bien se coller les unes aux autres, d’où la raison pour laquelle l’eau a une tension superficielle et un point d’ébullition si élevés.
Dans cette mesure, l’eau est un solvant polyvalent : elle peut dissoudre presque « tout », et la solubilité est essentielle dans les conditions prébiotiques. Elle peut dissoudre de nombreux sels et de petites molécules organiques polaires comme les sucres et les acides aminés. La solubilité des composés organiques et des sels est très importante pour la vie car elle permet de tamponner les mélanges réactionnels afin de résister aux changements de pH, de salinité et même d’état d’oxydation. Un environnement qui favorise le mieux la vie est celui qui présente des concentrations stables de biomolécules essentielles.
Une autre caractéristique très importante des propriétés physiques de l’eau est l’effet hydrophobe des grands composés non polaires. Les substances non polaires et polaires ne se mélangent pas très bien en solution, c’est pourquoi les molécules non polaires ont tendance à s’agglomérer dans une solution de molécules polaires. En d’autres termes : les molécules non polaires se collent beaucoup plus les unes aux autres lorsqu’elles sont entourées de molécules polaires.
L’effet hydrophobe est crucial dans le processus d’abiogenèse car il pilote la formation des micelles et des protéines. Sans l’effet hydrophobe, les lipides ne pourraient pas se recuire pour former des membranes cellulaires, et les polymères d’acides aminés ne pourraient pas se replier pour former des protéines et des enzymes fonctionnelles.
Bien que l’ammoniac puisse avoir la capacité de former des liaisons hydrogène, sa polarité fait pâle figure en comparaison de celle de l’eau. L’ammoniac est moins capable de former des liaisons hydrogène et, par conséquent, l’effet hydrophobe et la solubilité des molécules organiques sont également plus faibles.
Cela pose des problèmes pour l’abiogenèse. Les petites molécules bioorganiques ne se dissoudraient pas très bien dans l’ammoniac. Les protéines et les membranes pourraient être instables dans une solution d’ammoniac parce qu’elles pourraient ne pas se plier correctement. Les membranes et les lipides posent un problème encore plus important : si les membranes cellulaires ne sont pas suffisamment compactes, les cellules peuvent se désagréger, même en cas de changements environnementaux légers. La vie serait moins adaptable dans un environnement d’ammoniac que dans un environnement d’eau.
La stabilité de l’ammoniac liquide elle-même justifie des inquiétudes. Théoriquement, la vie ne peut être soutenue que dans un liquide, pas dans un gaz ou un solide. S’il est consommé trop rapidement ou trop facilement, les organismes peuvent avoir plus de mal à s’adapter à l’environnement. L’ammoniac existe sous forme de gaz à température ambiante, tandis que l’eau est stable en tant que liquide dans une plage de températures allant de 0 à 100 degrés Celsius. Cela est dû à la force de la liaison hydrogène : plus les liaisons hydrogène sont fortes, plus les molécules sont susceptibles de rester ensemble suffisamment longtemps pour se condenser en liquide. L’ammoniac a une faible liaison hydrogène, c’est pourquoi la température doit être abaissée de façon spectaculaire sous la pression atmosphérique normale pour stabiliser l’ammoniac à l’état liquide ; nous parlons d’un monde qui doit subir une période glaciaire de 4 milliards d’années. Une planète froide et morte n’est guère un candidat idéal pour accueillir la vie.

Surface d’Andoria.
Le point d’ébullition de l’ammoniac est de -33 degrés Celsius sous 14,7 psi de pression, ce qui signifie que l’ammoniac liquide n’est stable qu’en dessous de cette température à la pression atmosphérique terrestre. En supposant un instant que le pliage, l’agglomération et la solubilité des molécules organiques soient thermodynamiquement probables, il faudrait maintenir une température globale comprise entre -78 degrés Celsius et -33 degrés à 14,7 psi. Il s’agit d’une fourchette trop étroite pour que les organismes puissent prospérer ; toute fluctuation climatique légère peut en fait menacer la survie de la vie à base d’ammoniac. Le métabolisme des nutriments et la réplication des organismes seraient perturbés par des périodes de creux et de hausses extrêmes.
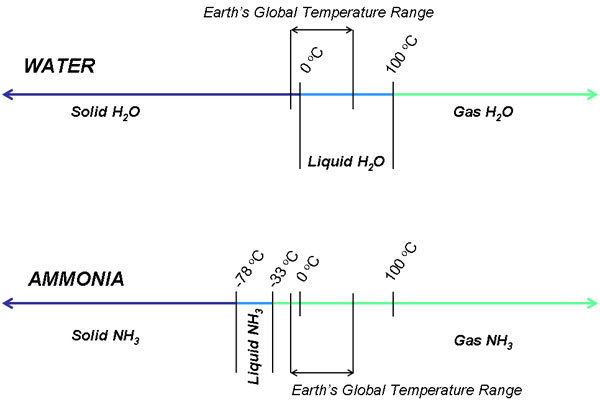
La seule solution de contournement de ce problème est la condensation d’un gaz en utilisant une pression atmosphérique plus élevée plutôt qu’une température plus basse. Un gaz peut être condensé en un liquide sous des pressions extrêmes, et la température peut être maintenue bien au-dessus de son point d’ébullition normal (ce qui est une bonne nouvelle pour un climat ammoniacal dans lequel la vie a besoin de chaleur pour se développer). L’ammoniac se condense en liquide sous une pression équivalente à 12,1 mille atmosphères terrestres à environ 37 degrés Celsius. Malheureusement, nous n’avons pas encore découvert ou émis d’hypothèse sur la manière dont une planète pourrait abriter une atmosphère aussi dense. Vénus, une planète terrestre avec l’atmosphère la plus dense connue à ce jour, a une valeur de pression de 93 bars à la surface ; cela répond à peine à la demande atmosphérique de 12 000 bars. Jupiter, le deuxième meilleur choix, n’a qu’une pression maximale d’environ 1 000 bars au centre de la planète, ce qui n’est pas non plus idéal pour nos besoins. Il est peu probable que des planètes similaires aient des pressions atmosphériques suffisamment élevées pour condenser l’ammoniac en liquide, bien que cela ne signifie pas que la vie à base d’ammoniac ne puisse pas émerger par d’autres moyens.
Le verdict final
La vie à base d’ammoniac n’est pas un thème majeur de Star Trek, et je me suis toujours demandé pourquoi elle n’a jamais été incluse dans les émissions. Malheureusement, il est peu probable que ce soit un fait scientifique. Il est important de noter que de nombreuses choses initialement considérées comme impossibles par la science ont finalement été prouvées par la science, ou du moins dans une certaine mesure. Comme je le souligne toujours dans mes articles : ce n’est pas parce qu’une chose semble hautement improbable qu’elle ne peut pas se produire. Nous devons encore découvrir la vie à base d’ammoniac, ou toute autre vie ailleurs d’ailleurs, avant que quiconque, même moi, puisse affirmer que les extraterrestres ammoniaqués peuvent ou non exister. En l’absence de preuves absolues, la spéculation est le mieux que nous puissions espérer.
Sur cette note, je voudrais conclure avec cet extrait génial édité du Cosmos de Carl Sagan, dans lequel il émet l’hypothèse d’un scénario probable dans lequel la vie pourrait évoluer sur un monde comme Jupiter.
Parce que quelque chose semble improbable de se produire, nous sommes toujours étonnés en science de découvrir que parfois, aussi improbable que cela puisse être, le contraire est vrai. Même si les organismes à base d’ammoniac peuvent ne pas exister selon nos normes terrestres, cela n’implique en aucun cas que cela ne peut pas se produire d’une autre manière.
Tom Caldwell est titulaire d’une licence en biochimie de l’UCLA. Il travaille actuellement à un doctorat en biologie moléculaire.