La structure de Lewis de l’ion oxalate est dessinée dans ce tutoriel étape par étape. Le concept des électrons de valence totale est utilisé pour dessiner la structure de lewis de C2O42-. Après avoir terminé la structure de Lewis de C2O42-, il devrait y avoir une charge de -2 et une stabilité. Vous apprendrez ces choses dans ce tutoriel.
L’ion oxalate | C2O42-
L’ion carbonate a une charge de -2. Il y a deux atomes de carbone dans l’ion oxalate.
C2O42- structure de Lewis
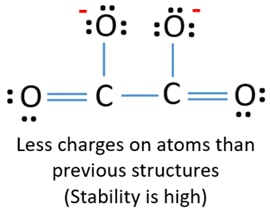
Deux atomes de carbone sont joints à un atome de carbone. De même, les deux autres atomes d’oxygène sont liés à d’autres atomes de carbone. Dans la structure de lewis de l’ion C2O42-, l’ion est symétrique autour de la liaison C-C.
Étapes du dessin de la structure de lewis de C2O42-
Les étapes suivantes sont nécessaires pour dessiner la structure de lewis de C2O42- et elles sont expliquées en détail dans ce tutoriel.
- Trouver le nombre total d’électrons des coquilles de valence des atomes de carbone et d’oxygène. Ceci est utilisé pour déterminer le nombre de liaisons, de paires solitaires autour des atomes.
- Total des paires d’électrons autour des atomes
- Sélection de l’atome central selon la valence maximale
- Mettre des paires solitaires sur les atomes
- Vérifier la stabilité et minimiser les charges sur les atomes pour construire la structure la plus stable en convertissant les paires solitaires en liaisons.
Comme ces étapes, les faits suivants sont importants pour dessiner la structure de lewis.
L’oxygène devrait tenir des charges négatives dans la structure de lewis parce que l’oxygène aime garder les électrons que l’atome de carbone.
L’électronégativité de l’oxygène est plus élevée que celle du carbone.
Dessiner correctement la structure de lewis est important pour dessiner correctement les structures de résonance de CO32-.
Nombre total d’électrons des coquilles de valence de C2O42-
Le carbone est situé dans le groupe 4 du tableau périodique. Donc, le carbone a quatre électrons dans sa coquille de valence. L’oxygène est situé dans le 6e groupe. Il a six électrons dans sa coquille de valence.
- Total des électrons de valence donnés par l’atome de carbone = 4 * 2 = 8
Il y a quatre atomes d’oxygène dans l’ion C2O42-, Donc
- Total des électrons de valence donnés par les atomes d’oxygène = 6 *4 = 24
Il y a une charge de -2 sur l’ion C2O42-. Il y a donc deux électrons de plus qui contribuent aux électrons de valence.
- Electrons de valence totaux = 8 + 24 + 2 = 34
Paires d’électrons de valence totaux
Paires d’électrons de valence totaux = liaisons σ + liaisons π + paires solitaires aux coquilles de valence
Les paires d’électrons totaux sont déterminées en divisant le nombre d’électrons de valence totaux par deux. Pour, l’ion C2O42-, les paires totales d’électrons sont 17.
Atome central de l’ion C2O42-
Pour être l’atome central, la capacité d’avoir une valence plus élevée est importante. Le carbone a plus de chance d’être l’atome central (Voir la figure) parce que le carbone peut montrer une valence de 4. La valence la plus élevée de l’oxygène est de 2. Donc, maintenant nous pouvons construire un croquis de l’ion C2O42-.
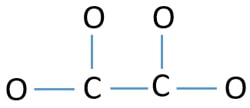
Paires uniques sur les atomes
- Il y a quatre liaisons C-O et une liaison C-C dans le croquis ci-dessus faisant cinq liaisons. Il ne reste donc que douze (17-5 = 12) paires d’électrons de valence.
- Premièrement, marquez ces douze paires d’électrons de valence comme paires solitaires dans les atomes extérieurs (sur les atomes d’oxygène). Un atome d’oxygène prendra trois paires solitaires en suivant la règle octale (l’atome d’oxygène ne peut pas garder plus de huit électrons dans sa coquille de valence).
- Pour quatre atomes d’oxygène, douze paires d’électrons sont dépensées. Maintenant, il n’y a plus de paires solitaires à marquer sur les atomes de carbone après avoir marqué les paires solitaires sur les atomes d’oxygène (à l’extérieur des atomes).
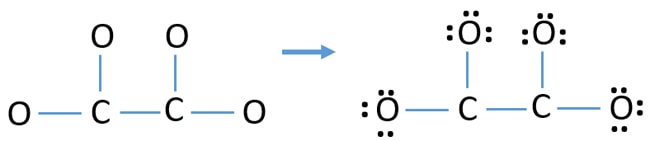
Charges sur les atomes
Après, avoir marqué les paires d’électrons sur les atomes (dans ce cas, seulement sur les atomes d’oxygène), nous devrions marquer les charges de chaque atome s’il y a une charge. Le marquage des charges est important car il est utilisé pour déterminer la meilleure structure de Lewis de l’ion. Après avoir marqué les charges, vous verrez, chaque atome d’oxygène aura une charge de -1 et les deux atomes de carbone auront une charge de +1.
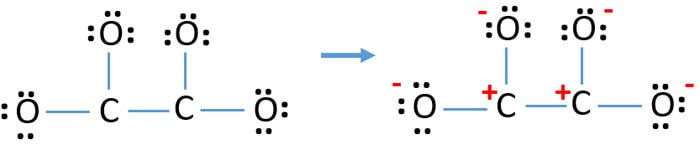
Cette structure est très instable car il y a des charges partout dans l’ion.
Vérifier la stabilité et minimiser les charges sur les atomes en convertissant les paires solitaires en liaisons
- Les atomes d’oxygène doivent détenir des charges négatives car l’électronégativité de l’atome d’oxygène est supérieure à celle de l’atome de carbone. Autrement, nous pouvons dire, la capacité de tenir des charges négatives est plus grande dans les atomes d’oxygène que dans les atomes de carbone.
- La structure dessinée n’est pas une structure stable parce que tous les atomes ont une charge (la structure de Lewis devrait être une structure stable avec moins de charges).
- Maintenant, nous devrions essayer de minimiser les charges en convertissant la paire ou les paires solitaires en liaisons. Donc convertir une paire solitaire d’un atome d’oxygène pour faire une liaison C-O.
- Maintenant, il y a une double liaison entre un atome de carbone et un atome d’oxygène (une liaison C=O). Maintenant, il y a trois liaisons simples entre l’atome de carbone et les trois autres atomes d’oxygène (deux liaisons C-O).
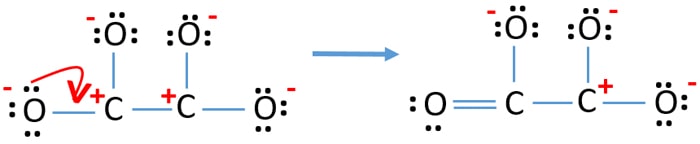
Dans la nouvelle structure, les charges des atomes sont réduites par rapport à la structure précédente. Maintenant, il n’y a pas de charge sur sur un atome d’oxygène et un atome de carbone. Mais, il y a encore des charges sur trois atomes d’oxygène (ont -1 charges négatives) et l’autre atome de carbone. Vous comprenez maintenant que cette structure de C2O42- est plus stable que la structure précédente. Mais, nous essayons de réduire les charges autant que si c’est possible.
Réduire les charges en plus
Vous pouvez convertir la paire solitaire d’un autre atome d’oxygène en une liaison C-O comme ci-dessous.
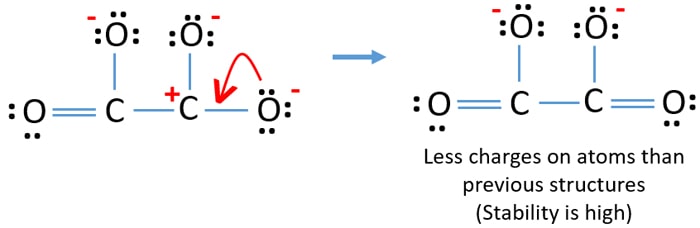
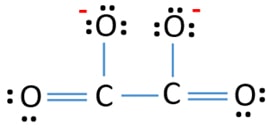
Structure de Lewis de l’ion C2O42- (carbonate)
Questions
Posez vos questions de chimie et trouvez les réponses
Tutoriels associés
.