Abstract
Le but de cette étude, centrée sur un petit nombre de cas, est de traiter l’angiosarcome du sein, représentant moins de 1% de toutes les tumeurs mammaires des tissus mous, et enfin de partager notre expérience. En conséquence de la thérapie conservatrice du sein (TCC) qui est le traitement standard de nos jours, un nouveau type d’angiosarcome a été mis en évidence : L’angiosarcome radio-induit (RIAS).
On rapporte ici une analyse rétrospective des traits caractéristiques des patients RIAS, ainsi qu’un compte rendu du traitement intégré et de l’issue de six cas de RIAS traités dans notre institution de 2013 à 2018.
L’angiosarcome du sein comme conséquence de la chirurgie et de la radiothérapie a été rarement enregistré, mais il s’agit d’une complication documentée de la radiothérapie pour le cancer du sein, avec un taux de récurrence élevé et de mauvais résultats.
Il reste difficile cliniquement, radiologiquement et histologiquement, et donc un indice de suspicion élevé est nécessaire chez les patients sensibles. La mastectomie simple est la principale option thérapeutique, mais un nombre croissant d’études portent sur l’utilisation de la radiothérapie et de la chimiothérapie, chacune avec un degré de réussite variable. Une ré-irradiation peut être prise en considération afin d’augmenter le contrôle local, tandis que la chimiothérapie peut être envisagée pour les cas à un stade plus avancé.
Abréviation
RIAS : Angiosarcome radio-induit ; BCT : Breast-Conserving Therapy ; AS : Angiosarcome du sein ; IRM : Imagerie par résonance magnétique ; IMRT : Radiothérapie modulée en intensité
Keywords
Angiosarcome du sein (AS), Angiosarcome radio-induit (RIAS), Mastectomie radicale (RM), Tumeurs radio-induites, Radiothérapie adjuvante, Radiothérapie à modulation d’intensité (IMRT)
Introduction
Dans ce travail sont abordés le diagnostic, la prise en charge et l’issue du RIAS chez un petit nombre de patientes atteintes d’un cancer du sein.
En tant que tumeur vasculaire très rare, l’angiosarcome (AS) du sein peut être divisé en deux catégories : primaire, s’il survient sans précurseur connu, ou secondaire, s’il se produit au site d’une peau préalablement irradiée, auquel cas il est connu sous le nom d’angiosarcome induit par les radiations (RIAS) du sein . Mais il n’existe toujours pas de directives fondées sur des preuves concernant le traitement idéal des angiosarcomes.
Chez les patientes qui subissent une chirurgie conservatrice du sein avec radiothérapie adjuvante, l’incidence estimée des RIAS varie entre 0,05 et 0,3 %, ce qui représente moins de 1 % des tumeurs du sein et environ 3 % de tous les sarcomes des tissus mous.
L’incidence du RIAS semble augmenter, reflétant peut-être la longue période de latence pour le développement de ces tumeurs après l’adoption généralisée de la radiothérapie adjuvante pour le cancer du sein.
Le diagnostic du RIAS du sein est souvent retardé en raison de son apparence bénigne et de la difficulté à le différencier des changements cutanés non spécifiques induits par une radiation antérieure ou par une autre maladie . Les résultats radiologiques sont également souvent non spécifiques. Bien que le SARI se développe généralement 10 ans après la radiothérapie du cancer du sein, la période de latence peut varier de 6 mois à 20 ans, ce qui amène certains auteurs à penser qu’il est probablement sous-déclaré et que les taux d’incidence réels sont donc plus élevés. Avec l’augmentation de l’incidence du cancer du sein, le recours à la chirurgie conservatrice du sein suivie d’une radiothérapie a remplacé la mastectomie radicale comme traitement standard. L’incidence connexe du SARR augmente également, avec une incidence cumulative estimée à 0,9-3,2 pour 1000 cas de cancer du sein. Dans une vaste étude de cohorte basée sur la population, des antécédents de radiothérapie antérieure pour le traitement du cancer du sein ont été associés à un risque 26 fois plus élevé de développer un angiosarcome par rapport aux groupes témoins non irradiés. Le pronostic des patients atteints de RIAS reste mauvais, avec des taux de survie globale à 5 ans allant de 27 à 48 %. Malgré le fait que le RIAS ait été décrit pour la première fois au début des années 1920, sa biologie moléculaire est encore controversée et il n’existe donc pas de thérapie ciblée disponible.
À l’heure actuelle, une résection chirurgicale agressive est couramment préconisée comme traitement de choix. Il y a un manque de données prouvant l’efficacité de la chimiothérapie adjuvante .
La chirurgie, sous la forme d’une excision large ou d’une mastectomie, est le pilier de la prise en charge dans les maladies localisées. Certaines études ont rapporté une association entre les marges R0 et un meilleur taux de survie, bien qu’il n’ait pas été démontré qu’elle soit indépendante d’autres facteurs biologiques, tels que la taille de la tumeur . Il existe certaines preuves que la chimiothérapie néoadjuvante peut améliorer les résultats dans le traitement de l’angiosarcome, dont la rareté limite nos connaissances à des rapports de cas ou à de petites séries de cas rétrospectives .
Afin de caractériser une population de patients atteints de RIAS, traités dans notre hôpital pendant une période de 5 ans, nous avons réalisé une étude rétrospective analysant l’utilité de la mammographie, de l’échographie et de l’imagerie par résonance magnétique (IRM) pour notre diagnostic .
Notre travail a été rapporté conformément aux critères SCARE .
Matériels et méthodes
Notre série de cas concerne les patients atteints d’angiosarcome du sein prouvé histologiquement, développé après une radiothérapie pour un cancer du sein, entre 2013 et 2018, et analyse les stratégies de traitement avec une approche multidisciplinaire.
Les patients touchés, six femmes avec un angiosarcome du sein radio-induit, ont été identifiés par une recherche exhaustive dans la période susmentionnée du registre du cancer de notre institution, à l’hôpital universitaire de Catane. L’âge moyen était de 70 ans, fourchette : 59-79 ans. Les patients avaient effectué la gestion diagnostique et thérapeutique précédente dans diverses institutions, de sorte que les informations ne sont pas toutes disponibles. Les caractéristiques des patients et les procédures de traitement effectuées après le diagnostic de RIAS sont décrites dans le tableau 1. Tous les patients avaient subi un traitement conservateur du sein au moment du diagnostic, avec une radiothérapie adjuvante administrée par radiothérapie conformationnelle tridimensionnelle conventionnelle à une dose totale de 50 Gy, avec un fractionnement quotidien de 2 Gy, avec ou sans un boost du lit tumoral de 10 Gy. Les tumeurs étaient droites chez 3 patients, et gauches chez les 3 autres. Au cours du traitement adjuvant, cinq des six patientes ont reçu une chimiothérapie systémique à base d’anthracycline, conformément aux directives institutionnelles, tandis que toutes les patientes ont reçu une hormonothérapie adjuvante à base de tamoxifène/inhibiteur de l’aromatase. Aucun patient n’avait un cancer HER2-positif au moment du diagnostic.
Durant le suivi, après une période médiane de 7,6 ans (fourchette : 5-11 ans), le diagnostic d’angiosarcome du sein ipsilatéral a été réalisé : les signes les plus fréquemment présentés par les patientes au début étaient des nodules cutanés de couleur rouge-violet, situés dans le contexte des champs d’irradiation, avec une vitesse de croissance modérément variable de quelques semaines à 4-6 mois. Tous les patients ont reçu une confirmation histologique d’angiosarcome secondaire et une mastectomie radicale a été effectuée dans tous les cas. Pour diagnostiquer le RIAS, les critères de Cahan et Arlen ont été suivis : sarcome survenant dans le champ irradié précédent ; une période de latence d’au moins 3 ans entre la radiothérapie et le développement du sarcome ; et une distinction histologique entre le sarcome secondaire et le néoplasme primaire. Les six patientes ont subi un bilan radiologique complet avec mammographie, échographie et IRM (chez 4/6 patientes) afin de confirmer la suspicion clinique de RIAS, mais aucune caractéristique pathognomonique n’a été identifiée. L’intérêt croissant de la littérature scientifique pour l’identification de caractéristiques spécifiques de la « signature radiologique » n’a pas encore produit de données consolidées. Trois des six patients mis en évidence dans notre série de cas ont fait l’objet d’une étude immunohistochimique pour l’évaluation de l’expression de MYC, qui avait montré une forte expression chez ces patients. Le tableau 1 rapporte également les caractéristiques histologiques des tumeurs. La date du diagnostic RIAS a été définie comme le jour où le diagnostic histologique a été posé. La période de latence a été définie comme le temps écoulé entre la première séance d’irradiation et la date du diagnostic RIAS. Un seul patient présentait des métastases synchrones (dans le poumon) au moment du diagnostic de RIAS, tandis que les cinq autres patients ne présentaient qu’une maladie mammaire.
Tableau 1 : Caractéristiques des patients et procédures de traitement. Voir tableau 1
Tous les patients subissant une intervention chirurgicale dans notre hôpital ont été discutés lors d’une réunion multidisciplinaire sur le sarcome en phase préopératoire. Les patients ont été classés comme ayant une maladie résécable si l’évaluation préopératoire indiquait qu’une marge négative de 2 cm ou plus pouvait être obtenue par une chirurgie avec ou sans reconstruction de chirurgie plastique sous la forme d’un seul lambeau myocutané pédiculé ou libre. Si les marges négatives souhaitées nécessitaient une reconstruction plus importante, par exemple avec un resurfaçage important par une grande greffe de peau, le patient serait classé comme ayant une maladie irrésécable.
La maladie rapidement progressive, où le volume de la maladie a augmenté sur un laps de temps de 2 à 3 semaines, passant de l’aptitude à la mastectomie seule ou en combinaison avec un lambeau pédiculé à la nécessité d’une reconstruction plus étendue, a également été jugée irrésécable en termes oncologiques.
Des biopsies préopératoires ont été réalisées pour confirmer la présence de SA et exclure d’autres maladies.
La résection macroscopiquement complète a été considérée par le chirurgien opérant. Histologiquement, la résection était classée comme R0 (négative au niveau microscopique) si les marges négatives étaient supérieures à 1 cm circonférentiellement ou R1 (positive au niveau microscopique) si la tumeur s’étendait jusqu’à ou dans moins de 1 cm de la marge de résection.
Quatre patients ont été recrutés pour une réirradiation immédiate, tandis qu’un patient a été traité après 13 mois lorsqu’une rechute pariétale est survenue (elle avait refusé une réirradiation immédiate), le dernier patient a été exclu de la réirradiation, car il avait atteint les limites de dose pour le cœur lors du traitement précédent. La décision d’administrer une chimiothérapie adjuvante a été prise au cas par cas, sur la base des données disponibles concernant les traitements antérieurs reçus et l’état de performance des patients. Une patiente a reçu quatre cycles de chimiothérapie épirubicine-ifosfamide, une autre a reçu six cycles d’épirubicine seule, trois ont été exclues pour des raisons médicales (âge, comorbidités ou dose de tolérance des anthracyclines déjà atteinte précédemment). Un patient a reçu du paclitaxel hebdomadaire pendant 12 cycles pour des métastases pulmonaires synchrones.
La radiothérapie a été administrée en tenant compte des doses reçues des tissus sains lors de l’irradiation précédente et de l’administration antérieure d’anthracyclines. Pour ces raisons, nous avons choisi d’effectuer la ré-irradiation au moyen d’une radiothérapie à modulation d’intensité (IMRT, voir figure 1), en utilisant une technique « step-and-shoot », conformément à nos procédures institutionnelles . La dose de rayonnement et le schéma de fractionnement qui ont été utilisés variaient : deux patients ont reçu un fractionnement conventionnel à 50 Gy, deux patients ont reçu 40 Gy (parce que le temps écoulé depuis l’irradiation précédente était court et que le néoplasme était situé sur le sein gauche), un patient 35 Gy en fractionnement de 5 Gy une fois par semaine (en raison d’une conformité clinique réduite).
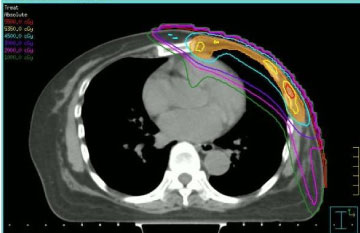 Figure 1 : Image CT transversale avec distribution de la dose modulée en intensité par paliers. View Figure 1
Figure 1 : Image CT transversale avec distribution de la dose modulée en intensité par paliers. View Figure 1
Résultats
Aucune marge positive n’a été signalée chez les patientes qui avaient subi une mastectomie radicale réalisée par la même équipe chirurgicale.
Après la mastectomie radicale, les patientes ont reçu un traitement comme prévu, sans aucune interruption, tant pour la chimiothérapie que pour la radiothérapie. Après un suivi médian de 22 ans (intervalle : 1,5-4 ans), trois patientes sont en vie, sans signe de rechute ou de maladie progressive. Un patient présentant des métastases pulmonaires synchrones au moment du diagnostic est toujours sous traitement oncologique actif. Une patiente a développé des métastases pulmonaires et osseuses, mais elle est toujours en vie au moment de la soumission de ce travail. Les deux derniers patients ont développé des métastases pulmonaires, dont l’une associée à une récidive locale, et sont décédés après 8-10 mois (la distribution des caractéristiques des patients par rapport à la présentation de la maladie et au traitement reçu est décrite dans le tableau 1). Dans l’ensemble, la survie sans maladie était de 14 mois pour cinq patients sans maladie systémique au moment du diagnostic de RIAS, tandis que la survie sans progression pour le patient métastatique synchrone au moment du diagnostic était de 12 mois.
Comme on peut s’y attendre, les résultats de survie plus faibles, rapportés dans la littérature, ont été remarqués chez les patients présentant une maladie localement avancée non adaptée à une prise en charge chirurgicale par rapport aux cas de notre série. Ces facteurs soulignent l’importance d’un diagnostic précoce chez les patients atteints de RIAS. Les angiosarcomes se présentent souvent de manière insidieuse avec des changements cutanés violets ou rouges et peuvent être facilement confondus avec des contusions ou des changements cutanés bénins, ce qui retarde les investigations et le diagnostic. Une détection précoce et une orientation rapide peuvent potentiellement réduire le nombre de patients présentant une maladie irrésécable et améliorer le contrôle de la maladie à la fois locale et distante.
Discussion
Les tumeurs induites par les radiations surviennent généralement dans le contexte ou au bord du champ d’irradiation où la dose n’est pas uniforme et peut résulter inférieure à celle nécessaire pour induire la destruction des cellules, ou provoquer des mutations qui peuvent conduire au processus de cancérogenèse. En tant qu’effet des rayonnements ionisants, les modifications chimiques et biochimiques induites dans les organismes vivants produisent des altérations fonctionnelles et morphologiques des cellules causant un dommage biologique. Chaque cellule, capable de se répliquer, peut devenir potentiellement cancéreuse ; si les cellules qui présentent des modifications chromosomiques échappent aux contrôles cellulaires normaux, la cancérogenèse peut se produire.
La probabilité de développer des tumeurs chez les patients soumis à une radiothérapie pour traiter le cancer du sein est très faible et ne peut limiter l’utilisation de la radiothérapie lorsqu’elle est indiquée. Les doses de rayonnement supérieures à 50 Gy induisent la mort cellulaire et les doses plus faibles (
De nombreuses études ont suggéré la corrélation entre l’apparition de sarcomes des tissus mous et les radiothérapies effectuées pour traiter les tumeurs du sein. La radiothérapie augmente le risque de développer des sarcomes des tissus mous et, en particulier, de développer un angiosarcome . Le SARR représente, approximativement, moins de 1 % des tumeurs du sein. L’angiosarcome radio-induit présente de nombreuses manifestations cliniques : Les patients présentent souvent des modifications cutanées asymptomatiques qui peuvent difficilement être distinguées des altérations actiniques courantes que l’on peut trouver après un traitement de radiothérapie du sein. Les patients présentent souvent une tuméfaction palpable, une zone rouge violacée semblable à un hématome. Les angiosarcomes peuvent être confondus avec des manifestations bénignes telles que des angiomes ou des télangiectasies atypiques. Des papules violettes ou des nodules érythémateux peuvent également apparaître.
Malgré tous les efforts thérapeutiques, le taux de survie à cinq ans varie de 27% à 62,8% (2-3). Bien que le SARI se développe généralement 10 ans après les traitements de radiothérapie pour le cancer du sein, la période de latence peut aller de 6 mois à 20 ans. L’angiosarcome radio-induit ne se distingue pas de l’angiosarcome spontané mais certaines différences peuvent être évaluées : Lae, et al. ont comparé l’amplification c-myc sur le chromosome 8q24.21 dans 32 spécimens de RASB et 15 spécimens d’angiosarcomes sporadiques .
Dans notre série, les patients présentaient des signes non spécifiques de la maladie, mais le diagnostic a été posé rapidement dans la majorité des cas. La période de latence était conforme à celle rapportée dans la littérature, avec une durée médiane de 76 ans.
Le SRIAS est connu pour avoir un taux de récidive élevé. Une récidive locale, soit dans le lit de la tumeur, soit le long de la cicatrice chirurgicale, serait détectée dans une majorité (96%) de cas de RIAS. Cela est probablement dû à une croissance multifocale du RIAS ou à des restes de tissu malin après la chirurgie, même avec des marges chirurgicales négatives. La maladie métastatique, le plus souvent vers les poumons et le foie, peut être présente en même temps ou peu après les récidives locales. Abbott, et al. ont examiné rétrospectivement tous les cas de RIAS publiés à partir de 2017 et ont résumé les données . Les auteurs ont constaté que le taux de récidive locale était de 59 % et que le délai médian avant la récidive était de 6 mois (intervalle, 1-78 mois). Ils ont également constaté que la maladie métastatique était généralement précédée d’au moins une récidive locale et que les localisations les plus fréquentes étaient les poumons, le sein controlatéral et le squelette. En outre, leur examen histologique de 42 cas a suggéré que le RIAS peu différencié était associé à un risque élevé de métastases, tandis que les tumeurs bien différenciées présentaient un risque plus élevé de récidive locale que de métastases à distance.
Le sarcome radio-induit est un néoplasme rare mais très agressif. Sa gestion est un sujet de débat, car aucune directive de traitement n’est disponible, le pronostic est mauvais et le taux de survie à 5 ans varie largement, comme cela a été rapporté auparavant . Néanmoins, la résection chirurgicale agressive est communément préconisée comme le traitement de choix.
La chirurgie, sous forme de mastectomie avec ou sans reconstruction plastique, est le traitement de choix chez les patients présentant une maladie localisée. Dans les séries de patientes traitées, il est possible d’obtenir des marges de résection microscopiquement complètes (R0) dans plus de 80%. Les SARI se présentent typiquement comme des lésions multifocales. La tendance de cette pathologie à créer des dépôts de microsatellites peut contribuer à la difficulté d’obtenir un contrôle local.
L’importance de réaliser une résection pathologique complète a été soulignée dans la littérature, bien qu’aucune directive standard concernant la distance de dégagement recommandée n’ait été publiée. Dans la série actuelle, on a constaté que ceux qui ont développé une récidive locale avaient des marges plus étroites que ceux qui n’en avaient pas. Cependant, l’état des marges ne s’est pas avéré être un pronostic indépendant des résultats oncologiques dans cette série. Cela suggère que la capacité à obtenir des marges plus importantes dépend d’autres facteurs tumoraux biologiques qui déterminent également le résultat, comme la taille. Il est probable que la biologie de la tumeur soit principalement responsable de l’issue du RIAS, bien que la chirurgie initiale doive viser une clairance macroscopique, il convient d’avertir que l’obtention de plus grandes marges négatives n’équivaut pas nécessairement à une amélioration de l’issue pour les patients.
Malgré le nombre croissant d’études axées sur la chimiothérapie et la radiothérapie, qu’elles soient néoadjuvantes ou adjuvantes, leur rôle reste flou. Il y a un manque de données prouvant l’efficacité de la chimiothérapie adjuvante, des données récentes ont suggéré que la radiothérapie peut être utile pour prévenir les récidives . La radiothérapie adjuvante après la chirurgie, selon Johnstone et al. permet un meilleur contrôle local. Le rôle de l’IMRT dans le traitement de la paroi thoracique est actuellement en cours d’évaluation, car elle peut réduire le taux d’incidence de la radiotoxicité en diminuant l’irradiation des organes à risque (OAR). Dans une étude comparative de dosimétrie, les auteurs rapportent que le plan IMRT à la paroi thoracique et à la cible, par rapport aux traitements conventionnels, permet de diminuer la dose maximale, d’augmenter la dose minimale, ce qui entraîne une meilleure conformité et uniformité du volume cible .
Le rôle et l’efficacité de la chimiothérapie n’ont pas été établis car l’ensemble des données disponibles provient de groupes d’échantillons de petite taille, à partir desquels des conclusions définitives ne peuvent être tirées, mais probablement les patients avec un grade de malignité plus élevé, G3 et avec une récidive, pourraient bénéficier le plus d’une chimiothérapie néo ou adjuvante .
L’utilisation de la chimiothérapie néo/adjuvante s’est également avérée être associée à un meilleur contrôle local de la maladie dans une grande série rétrospective de patients atteints de sarcomes radio-induits de tous les sites, bien qu’elle ne soit pas associée à de meilleurs taux de rechute systémique ou de survie . La chimiothérapie adjuvante n’a pas apporté de bénéfice en termes de contrôle local ou de survie globale dans une étude sur les sarcomes des tissus mous à haut risque traités par chirurgie et radiothérapie. En tant que telle, il existe peu de preuves suggérant que la chimiothérapie néo-adjuvante apporte un bénéfice en termes de survie dans le cas du SARI, bien qu’elle puisse certainement être utile en tant que thérapie d’induction avant la chirurgie chez les personnes présentant une maladie localement avancée et qu’elle puisse en outre offrir aux patients une palliation efficace de la maladie. Les thérapies ciblées peuvent offrir un traitement alternatif chez les patients présentant une maladie progressive.
Dans notre série, en conséquence de la forte tendance à la récidive locale de ce néoplasme, nous avons décidé de proposer à tous les patients une seconde irradiation, sauf pour l’un d’entre eux pour les problèmes dosimétriques susmentionnés. Un patient a refusé la ré-irradiation immédiate et le traitement a été réalisé à la rechute. Il n’a pas été possible de programmer un traitement radiant homogène pour tous les patients, en raison de l’hétérogénéité de l’échantillon pour les doses d’irradiation précédemment utilisées, de la mauvaise compliance clinique dans un cas et, surtout, du manque d’indications claires de la littérature et des directives. Dans tous les cas, nous avons décidé de délivrer le traitement au moyen d’une technique à modulation d’intensité, afin de permettre une distribution adéquate de la dose, une réduction de l’exposition à la dose des tissus sains environnants, en particulier pour le parenchyme pulmonaire sous-jacent et le cœur.
Conclusions
La radiothérapie dans le traitement du cancer du sein est associée à un risque accru de sarcome ultérieur, mais le pourcentage de risque est très faible.
Le SRAI est une lésion rare et agressive des tissus mous avec des options de traitement limitées et des taux élevés de rechute locale et systémique.
Une observation attentive après une radiothérapie adjuvante est nécessaire. Le traitement standard implique une chirurgie avec mastectomie simple et une radiothérapie adjuvante. La chimiothérapie peut avoir un rôle dans la réduction de la maladie localement avancée bien qu’elle n’ait pas d’effet prouvé sur la survie.
L’angiosarcome est significativement plus fréquent dans les cas traités par radiothérapie, se produisant surtout dans le champ de rayonnement ou à proximité. La faible différence de risque de sarcome ultérieur pour les patientes atteintes d’un cancer du sein et recevant une radiothérapie ne supplante pas le bénéfice de la radiothérapie.
Cependant, notre série est trop petite pour tirer des conclusions finales et ceci est une limitation de l’étude. Une évaluation plus approfondie est nécessaire, également à travers un plus grand nombre d’études de cas, afin d’avoir une meilleure classification de la pathologie et de permettre une prise en charge multidisciplinaire plus précise.
Conflits d’intérêts
Aucun des auteurs n’a de conflits d’intérêts à divulguer.
Sources de financement
Aucune.
Approbation éthique
L’approbation a été donnée par le comité d’éthique de l’Université de Catane.
Consentement éclairé
Un consentement éclairé écrit a été obtenu du patient pour la publication de ce rapport de cas et des images qui l’accompagnent. Une copie du consentement écrit est disponible pour examen par le rédacteur en chef de ce journal sur demande.
Contributions des auteurs
Trovato Agata : Révision et édition de l’article.
Enregistrement des études de recherche
Aucune.
Divulgation
Aucun des auteurs n’a quelque chose à divulguer.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Angiosarcome primaire et secondaire du sein. Gland Surg 3 : 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Résultats à long terme chez les patients atteints d’angiosarcomes du sein associés à la radiation après une chirurgie et une radiothérapie pour le cancer du sein. Ann Surg Oncol 20 : 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma : a large-scale single-institution review. Cancer 104 : 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Cutaneous radiation-associated angiosarcoma of the breast : poor prognosis in a rare secondary malignancy. Ann Surg Oncol 19 : 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Gestion clinique de l’angiosarcome secondaire après une thérapie de conservation du sein. Rep Pract Oncol Radiother 19 : 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Radiation-induced sarcoma of the breast : a systematic review. Oncologue 17 : 405-418.
- Huang J, Mackillop WJ (2001) Risque accru de sarcome des tissus mous après radiothérapie chez les femmes atteintes d’un carcinome du sein. Cancer 92 : 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Angiosarcome associé à la radiation après un cancer du sein : taux de récidive élevé et survie médiocre malgré un traitement chirurgical avec résection R0. Ann Surg Oncol 19 : 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Gestion chirurgicale de l’angiosarcome radio-induit après une thérapie de conservation du sein. Am J Surg 203 : 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Angiosarcomes localisés : l’identification des facteurs pronostiques et l’analyse de l’impact du traitement. Une analyse rétrospective du groupe français sur les sarcomes (GSF/GETO) Eur J Cancer 49 : 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Thalidomide combiné à une chimiothérapie néoadjuvante dans les angiosarcomes du sein avec réponse pathologique complète : rapport de cas et revue de la littérature. Breast Care 8 : 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Chimiothérapie néoadjuvante pour les angiosarcomes primaires des tissus cutanés/mous : déterminer le comportement de la tumeur avant la résection chirurgicale. J Surg Oncol 111 : 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Métastase ganglionnaire controlatérale chez une femme avec un nouveau cancer du sein primaire : Maladie systémique ou diffusion locorégionale ? Int J Surg Case Rep 53 : 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement : Lignes directrices consensuelles pour les rapports de cas chirurgicaux. Int J Surg 34 : 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Secondary sarcomas after radiotherapy for breast cancer : sustained risk and poor survival. Cancer 115 : 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) L’amplification c-myc peut-elle discriminer de manière fiable un angiosarcome du sein postradiation ou primaire ? Cancer Radiother 19 : 168-174.
- Abbott R, Palmieri C (2008) Angiosarcome du sein après chirurgie et radiothérapie pour le cancer du sein. Nat Clin Pract Oncol 5 : 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarcome après une thérapie conservatrice du sein. Cancer 97 : 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast : local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys 27 : 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Évaluation dosimétrique du traitement IMRT intégré de la paroi thoracique et de la région supraclaviculaire pour le cancer du sein après une mastectomie radicale modifiée. Med Dosim 39 : 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) Une méta-analyse systématique des essais contrôlés randomisés de chimiothérapie adjuvante pour les sarcomes des tissus mous résécables localisés. Cancer 113 : 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Chimiothérapie adjuvante avec doxorubicine, ifosfamide et lenograstim pour les sarcomes des tissus mous réséqués (EORTC 62931) : un essai contrôlé randomisé multicentrique. Lancet Oncol 13 : 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Les cas de tuberculose mammaire augmentent en Sicile. Int J Surg Case Rep 53 : 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Rôle, moment et technique de la radiothérapie dans le sarcome synovial pleuropulmonaire pédiatrique. Future Oncol 12 : 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Radiothérapie à modulation d’intensité pour le mésothéliome pleural malin en rechute. Future Oncol 12 : 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Single-institution experience of intensity-modulated radiotherapy for malignant pleural mesothelioma at University of Catania. Future Oncol 14 : 17-21.
Citation
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) Une expérience d’étude en établissement unique d’angiosarcome secondaire du sein après un traitement conservateur du sein : Prise en charge multidisciplinaire. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114