Introduction
Le vasospasme coronaire spontané est associé à des modifications de l’activité du système nerveux autonome1 (déséquilibre sympathovagal) et à un dysfonctionnement endothélial2,3 (biodisponibilité réduite de l’oxyde nitrique). Il est considéré comme le mécanisme physiopathologique à l’origine de l’angor variant ou de l’angor de Prinzmetal et survient dans 1 à 5 % des procédures de diagnostic et des interventions percutanées, car celles-ci peuvent déclencher ou aggraver le spasme coronaire par le biais d’une lésion endothéliale ou d’un traumatisme.4 Sa localisation, sa distribution et sa gravité déterminent la gravité du contexte clinique, qui peut inclure un infarctus du myocarde, des arythmies sévères, un choc cardiogénique et même le décès.5 Le traitement en phase aiguë repose sur les vasodilatateurs des artères coronaires.
Rapport de cas
Un homme de 50 ans, fumeur, hypertendu, atteint d’une maladie rénale chronique sous dialyse régulière, mais sans antécédents cardiaques, de consommation de cocaïne, de syncope ou d’événements cardiovasculaires, a été admis pour une douleur thoracique au repos de courte durée survenue lors d’une séance de dialyse en soirée.
Il avait déjà été adressé pour une coronarographie invasive pour des épisodes similaires au cours des quelques mois précédents, bien qu’aucun signe d’ischémie significative n’ait été trouvé sur la scintigraphie de perfusion myocardique.
À son arrivée aux urgences, il était presque complètement asymptomatique (seulement une douleur résiduelle) et a été admis pour un angor instable (pas de changements ECG significatifs et marqueurs négatifs de nécrose myocardique). La fonction systolique ventriculaire gauche globale et segmentaire était préservée.
La stratification du risque d’infarctus du myocarde/décès était : (a) score GRACE : 5 % à l’hôpital et 13 % à 6 mois ; (b) score TIMI : 5 % à 14 jours.
Un cathétérisme cardiaque a été réalisé le lendemain, qui a révélé des lésions focales de type A dans l’artère descendante antérieure gauche (LAD) proximale et l’artère circonflexe moyenne (figure 1).
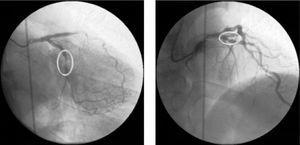
Coronarographie diagnostique en vues oblique antérieure droite 20°, caudale 20° et oblique antérieure droite 10°, crâniale 40°, montrant les lésions angiographiques correspondant à une sténose critique de l’artère descendante antérieure gauche proximale et à une sténose sévère de l’artère circonflexe moyenne.
Une angioplastie ad hoc a été réalisée sur les deux vaisseaux avec pose directe d’une endoprothèse (Fig. 2), en utilisant des dispositifs intracoronaires standards (3,0mm×12mm dans l’ADL proximale et 3.0mm×15mm dans l’artère circonflexe).
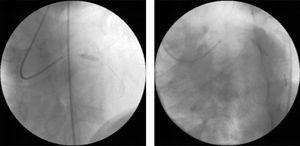
Intervention coronaire percutanée avec pose directe d’un stent sur les lésions observées à l’angiographie diagnostique : Stent DRIVER de 3 mm×12 mm dans l’artère descendante antérieure gauche proximale (à gauche) et stent DRIVER de 3 mm×15 mm dans l’artère circonflexe moyenne (à droite).
Le contrôle angiographique de la dernière lésion traitée (LAD proximal) a montré un bon résultat angiographique au niveau du site d’implantation du stent, mais une nouvelle lésion pré-stent était désormais visible dans l’artère circonflexe proximale (Fig. 3).
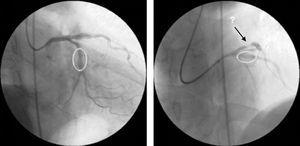
Coronarographie de contrôle après pose d’une endoprothèse sur l’artère descendante antérieure gauche proximale et l’artère circonflexe moyenne, montrant un bon résultat angiographique aux sites d’intervention, et une nouvelle lésion dans la circonflexe proximale.
Immédiatement après, il y a eu une chute de la pression artérielle et l’angiographie a révélé d’autres nouvelles lésions et un débit réduit dans tout l’arbre coronaire. Le patient a subi un choc cardiogénique et l’angiographie coronaire a montré une rétention de contraste en divers points de l’artère coronaire gauche, principalement intrastent, et un flux distal TIMI 0 (Fig. 4A). Les manœuvres de réanimation de base et avancées ont été commencées, une sonde de stimulation temporaire a été implantée (en raison d’un bloc auriculo-ventriculaire complet suivi d’une asystole ventriculaire) et une pompe à ballonnet intra-aortique a été insérée.
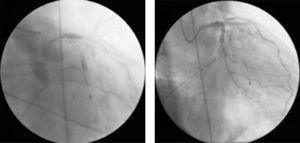
(A) Rétention du contraste en divers points de l’arbre coronaire et réduction brutale du flux coronaire (TIMI 0/1) ; (B) restauration du flux coronaire (TIMI 3) et résolution du vasospasme diffus sévère dans l’arbre coronaire gauche après administration de vérapamil intracoronaire.
Diverses causes pouvaient expliquer cette situation, notamment une dissection coronaire et un phénomène de no-reflow, mais la plus probable au vu du contexte clinique et angiographique était un vasospasme diffus sévère de l’arbre coronaire ; le vérapamil intracoronaire a donc été administré alors que le patient était encore soumis à des manœuvres de réanimation et en dissociation électromécanique. Cette mesure, associée au reste de l’arsenal pharmacologique et aux efforts de réanimation, a permis d’obtenir un flux TIMI 3 (figure 4B), un rythme sinusal et une élévation de la pression artérielle.
Une ventilation invasive et un soutien hémodynamique avec une pompe à ballonnet intra-aortique ont été nécessaires pendant 48 heures, et ont permis une amélioration progressive et une stabilisation clinique.
Pendant le séjour à l’hôpital, il y a eu divers épisodes d’angine associée à une élévation transitoire du segment ST lors de la surveillance ECG continue (figure 5), qui se sont résolus après l’administration de vasodilatateurs coronaires.
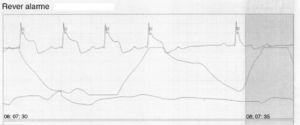
Tracé ECG montrant une angine associée à un élévation transitoire du segment ST pendant la surveillance continue.
Le patient a été renvoyé chez lui, asymptomatique, médicamenté avec des inhibiteurs calciques et des nitrates. Il a depuis été réadmis deux fois pour une angine instable, avec un contexte clinique similaire à celui de la première admission. Dans les deux cas, le patient avait complètement ou partiellement interrompu le traitement recommandé.
Lors de la dernière hospitalisation, une coronarographie invasive a été répétée, qui a de nouveau révélé des constatations coronaires qui auraient facilement pu être interprétées comme de nouvelles lésions, mais celles-ci se sont résolues après un traitement agressif aux nitrates intracoronaires (Fig. 6).
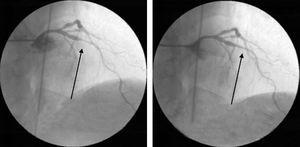
Coronarographie invasive lors de la dernière hospitalisation, montrant un spasme coronaire sévère de l’artère descendante antérieure gauche moyenne, qui s’est résolu après l’administration de nitrates intracoronaires.
Discussion
Les patients atteints d’angine de poitrine variante présentent une douleur thoracique typique au repos associée à un sus-décalage transitoire du segment ST, principalement la nuit ou tôt le matin6.
La coronarographie diagnostique, avec administration de nitrates intracoronaires et si nécessaire injection de contraste pour un cathétérisme non sélectif, exclut la possibilité d’un vasospasme coronaire par opposition à une maladie athérosclérotique obstructive dans la plupart des cas.7
Les caractéristiques cliniques et d’imagerie typiques de la maladie coronarienne vasospastique n’étaient pas toutes présentes chez notre patient à l’admission. Bien qu’il ait connu plusieurs épisodes angineux au repos, presque tous étaient survenus pendant les séances de dialyse du soir, et il n’y avait aucun signe d’ischémie significative sur la scintigraphie de perfusion myocardique réalisée dans le mois précédant la première admission à l’hôpital. Ces résultats pourraient être considérés comme appuyant l’hypothèse d’un angor vasospastique. Cependant, lors de l’évaluation initiale après l’admission, alors que le patient présentait toujours une angine résiduelle, les électrocardiogrammes en série n’ont pas montré de modifications significatives du ST-T et l’administration initiale de nitrates pendant la coronarographie diagnostique n’a pas modifié l’aspect angiographique des lésions observées. Ces deux dernières constatations ont contribué à la décision des opérateurs de procéder à une angioplastie coronaire, dans la conviction qu’il s’agissait d’un cas d’obstruction coronaire fixe.
Bien que le vasospasme coronaire ait tendance à se résorber spontanément, des épisodes prolongés peuvent entraîner un infarctus du myocarde, des arythmies et une mort cardiaque subite. Dans le cas présenté, l’intervention coronaire a joué un rôle majeur dans l’exacerbation du spasme coronaire, entraînant un choc cardiogénique,8 et la mort n’a été évitée que par un diagnostic rapide et un traitement approprié.
L’administration de vérapamil intracoronaire a été providentielle, car bien qu’il soit contre-indiqué dans le choc cardiogénique avec dissociation électromécanique, il a été la clé de la résolution du vasospasme sévère de ce patient et donc de sa survie.
Comme on l’a également vu chez notre patient, le vasospasme peut se reproduire dans des endroits différents du segment traité, et même dans plusieurs vaisseaux9.
La revascularisation coronaire (qu’elle soit percutanée ou chirurgicale) n’est pas indiquée dans les cas de spasme coronaire isolé sans sténose coronaire fixe.2 L’anatomie coronaire de notre patient a été réévaluée lors des admissions ultérieures, avec toute la prudence requise à la lumière de ce qui s’était passé lors de la première hospitalisation, et avec des doses généreuses de nitrates intracoronaires afin d’établir un diagnostic différentiel entre un vasospasme isolé (qui s’est en fait confirmé) et une maladie athérosclérotique obstructive.
Bien qu’ils n’aient pas été utilisés dans ce cas, l’échographie intravasculaire ou la tomographie par cohérence optique peuvent être précieux pour caractériser l’athérosclérose de la paroi artérielle, et ainsi fournir des informations supplémentaires importantes sur l’approche thérapeutique à adopter.
Les troubles du rythme cardiaque sont fréquents lors des crises vasospastiques, notamment le bloc auriculo-ventriculaire et les arythmies ventriculaires sévères.
Dans la plupart des cas d’angor variant, un traitement approprié par vasodilatateurs permet d’éviter de nouveaux épisodes de vasospasme. L’implantation d’un cardioverteur-défibrillateur doit être envisagée en cas d’angine vasospastique réfractaire compliquée de syncope et/ou d’arythmies ventriculaires sévères.10
Le pronostic de l’angine variante est bon si elle est associée à des artères coronaires normales et répond bien au traitement par inhibiteurs calciques ou nitrates. L’incidence d’infarctus du myocarde, d’arythmies malignes et de mort subite est faible chez ces patients.5
La persistance des symptômes est normalement associée à un tabagisme actif11 ou à des doses sous-optimales de médicaments anti-angineux, ce qui a été une fois de plus observé dans notre cas.
Conclusions
Le vasospasme coronaire n’est pas une entité bénigne et peut avoir une issue fatale. Il est donc impératif d’obtenir une vasodilatation coronaire efficace, pour laquelle le vérapamil peut être un bon choix, même dans les pires scénarios hémodynamiques.
L’administration de vasodilatateurs coronaires puissants (nitrates intracoronaires ou vérapamil) doit être gardée à l’esprit pour une évaluation précise de la gravité des lésions angiographiques avant de procéder à une intervention percutanée.
Conflits d’intérêts
Les auteurs n’ont aucun conflit d’intérêts à déclarer.