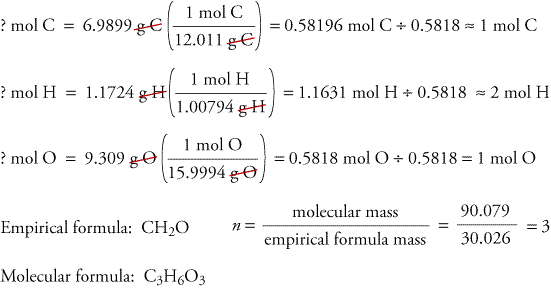Empirikus és molekuláris képletek meghatározása égési adatokból
A csak szenet és hidrogént (CaHb) vagy szenet, hidrogént és oxigént (CaHbOc) tartalmazó vegyületek empirikus és molekuláris képletei meghatározhatók az úgynevezett égéselemzéssel. Ennek az eljárásnak a lépései a következők
Mérjünk le egy mintát az elemzendő vegyületből, és helyezzük az alábbi képen látható készülékbe.
A vegyületet teljesen elégetjük. A csak szenet és hidrogént (CaHb) vagy szenet, hidrogént és oxigént (CaHbOc) tartalmazó vegyület égetésének egyetlen terméke a szén-dioxid és a víz.
A H2O-t és a CO2-t két csövön keresztül vezetjük. Az egyik csőben egy olyan anyag van, amely elnyeli a vizet, a másikban pedig egy olyan anyag van, amely elnyeli a szén-dioxidot. Mérjük meg mindkét csövet az égetés előtt és után. Az első cső tömegnövekedése az égés során keletkezett H2O tömege, a második cső tömegnövekedése pedig a keletkezett CO2 tömege.
Tegyük fel, hogy a vegyületben lévő összes szén átalakult CO2-vé, és a második csőben rekedt. Számítsuk ki a vegyületben lévő szén tömegét a képződött CO2 mért tömegében lévő szén tömegéből.
Tegyük fel, hogy a vegyületben lévő összes hidrogén H2O-vá alakult és az első csőben rekedt. Számítsuk ki a vegyületben lévő hidrogén tömegét a víz mért tömegében lévő hidrogén tömegéből.
Ha a vegyület a szén és a hidrogén mellett oxigént is tartalmaz, számítsuk ki az oxigén tömegét úgy, hogy a szén és a hidrogén tömegét kivonjuk a vegyület eredeti mintájának össztömegéből.
Az adatokat használjuk fel az empirikus és molekuláris képletek szokásos módon történő meghatározásához.
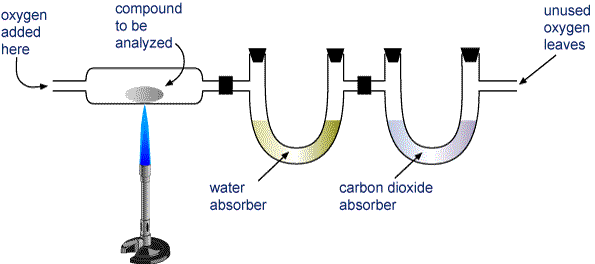
Az égéselemző készülék Egy szén és hidrogén (CaHb) vagy szén, hidrogén és oxigén (CaHbOc) tartalmú vegyületet teljesen elégetve H2O és CO2 keletkezik. A termékeket két csövön keresztül szívjuk át. Az első cső a vizet, a második cső pedig a szén-dioxidot veszi fel.
Az égésanalízisből származó adatokból történő empirikus és molekuláris képletek meghatározásának szemléltetésére tekintsük a trioxán nevű anyagot. A formaldehid, CH2O, tiszta gázként instabil, könnyen képez egy trioxán nevű anyag és egy paraformaldehid nevű polimer keverékét. Ezért a formaldehidet eladás és felhasználás előtt oldószerben, például vízben oldják fel. A szénből, hidrogénből és oxigénből álló trioxán molekuláris képlete két különböző kísérlet adatai alapján meghatározható. Az első kísérletben 17,471 g trioxánt égetünk el a fent látható készülékben, és 10,477 g H2O és 25,612 gCO2 keletkezik. A második kísérletben a trioxán molekulatömege 90,079.
Egy vegyület molekuláris képletét az empirikus képletéből és a molekulatömegéből kaphatjuk meg. (Ennek módját lásd a szövegben.) Ahhoz, hogy megkapjuk az empirikus képletet, meg kell határoznunk a 17,471 g trioxánban lévő szén, hidrogén és oxigén tömegét grammban. Ezért a következő általános lépéseket kell elvégeznünk:
Először is, a megadott adatokból számítsuk át a szén, hidrogén és oxigén grammjára.
Másodszor, határozzuk meg az empirikus képletet a szén, hidrogén és oxigén grammjából.
Harmadszor, határozzuk meg a molekuláris képletet az empirikus képletből és a megadott molekulatömegből.
Mivel feltételezzük, hogy a trioxánban lévő összes szén reakcióba lépett a CO2-ben, meg tudjuk találni a szén tömegét 17,471 g trioxánban,kiszámítva a szén tömegét 25,612 g CO2-ben.

Mivel feltételezzük, hogy a trioxánban lévő összes hidrogén H2O-vá reagált,a 17,471 g trioxánban lévő hidrogén tömegét úgy találjuk meg, hogy kiszámítjuk a hidrogén tömegét 10-ben.477 g H2O.

Mivel a trioxán csak szenet,hidrogént és oxigént tartalmaz, kiszámíthatjuk az oxigén tömegét, ha a szén és a hidrogén tömegét kivonjuk a trioxán össztömegéből.
? g O = 17,471 g trioxán – 6,9899 g C – 1,1724 g H = 9.309 g O
Most kiszámítjuk az empirikus képletet, az empirikus képlet tömegét és a molekuláris képletet.
MintaTanulmánylap: Molekulaformulák kiszámítása égési adatokból
Tipp- Egy csak szenet és hidrogént (CaHb) vagy szenet, hidrogént és oxigént (CaHbOc) tartalmazó vegyület molekulaformuláját szeretné kiszámítani, és adott a vegyület molekulatömege, valamint a vegyület adott tömegének elégetésekor keletkező CO2 és H2O tömege.
Általános eljárás
Kalkulálja ki a vegyületben lévő szén grammszámát úgy, hogy kiszámítja az adott mennyiségű CO2-ben lévő szén grammszámát.

Kalkulálja ki a vegyületben lévő hidrogén grammjainak számát az adott H2O mennyiségben lévő hidrogén grammjainak számításával.

Ha a vegyület oxigént tartalmaz, számítsuk ki a benne lévő oxigén grammszámát úgy, hogy a szén és a hidrogén tömegét kivonjuk a vegyület adott össztömegéből.
? g O = (adott) g összes – (számított) g C – (számított) g H
Kalkuláljuk ki a vegyület empirikus képletét a szén, hidrogén és oxigén grammjaiból.
Kalkuláljuk ki az empirikus képlet képletének tömegét, és a megadott molekulatömeget elosztjuk az empirikus képlet tömegével, hogy megkapjuk az n értéket.
Szorozzuk be az empirikus képlet minden egyes indexét n-nel, hogy megkapjuk a molekuláris képletet.
PÉLDA – Molekuláris képlet kinyerése égési adatokból:
A Dianabol az egyik anabolikus szteroid, amelyet néhány sportoló az izmok méretének és erejének növelésére használ. Hasonlít a férfi hormon tesztoszteronhoz. Egyes tanulmányok azt mutatják, hogy a szer kívánt hatásai minimálisak, és a mellékhatások, amelyek közé tartozik a sterilitás és a májrák és a szívbetegség megnövekedett kockázata, a legtöbb embert visszatartják a használatától. A Dianabol molekuláris képlete, amely szénből, hidrogénből és oxigénből áll, két különböző kísérlet adatai alapján meghatározható. Az első kísérletben 14,765 g Dianabol elégetése során 43,257 g CO2 és 12,395 g H2O keletkezik.A második kísérletben a Dianabol molekulatömegét 300,44-nek találják. Mi a Dianabol molekuláris képlete?
Az oldat:

.