Az oxalátion Lewis-szerkezete lépésről lépésre kirajzolódik ebben az útmutatóban. A C2O42- Lewis-szerkezetének megrajzolásához a teljes valenciaelektronok fogalmát használjuk. A C2O42- lewis szerkezetének befejezése után -2 töltés és stabilitás kell, hogy legyen. Ezekről a dolgokról ebben az oktatóanyagban fogsz tanulni.
Oxalátion | C2O42-
A karbonátionnak -2 töltése van. Az oxalátionban két szénatom van.
C2O42- Lewis szerkezet
Két szénatom kapcsolódik egy szénatomhoz. Ugyanígy a másik két oxigénatom is kapcsolódik a másik szénatomhoz. A C2O42- ion lewis szerkezetében az ion szimmetrikus a C-C kötés körül.
A C2O42- lewis szerkezetének rajzolásának lépései
A C2O42- lewis szerkezetének rajzolásához a következő lépések szükségesek, amelyeket ebben a tananyagban részletesen elmagyarázunk.
- Keresd meg a szén- és oxigénatomok valenciahéjának összes elektronszámát. Ezt használjuk az atomok körüli kötések, magányos párok számának meghatározásához.
- Az atomok körüli összes elektronpár
- Az atomok kiválasztása a maximális valencia szerint
- Magányos párok elhelyezése az atomokon
- A stabilitás ellenőrzése és az atomok töltésének minimalizálása, hogy a legstabilabb szerkezetet építsük fel a magányos párok kötésekké alakításával.
A lewis szerkezet rajzolásához a következő tények fontosak.
Az oxigénnek negatív töltést kell tartania a Lewis-struktúrában, mert az oxigén szereti megtartani az elektronokat, mint a szénatom.
Az oxigén elektronegativitása nagyobb, mint a széné.
A helyes lewis szerkezet megrajzolása fontos a CO32- rezonancia szerkezetének helyes megrajzolásához.
A C2O42-
A szén a periódusos rendszer 4. csoportjában helyezkedik el. Tehát a szénnek négy elektron van a valenciahéjában. Az oxigén a 6. csoportban található. Hat elektronja van a valenciahéjában.
- A szénatom által adott összes valenciaelektron = 4 * 2 = 8
A C2O42- ionban négy oxigénatom van, Ezért
- Az oxigénatomok által adott összes valenciaelektron = 6 *4 = 24
A C2O42- ionon -2 töltés van. Ezért még két elektron járul hozzá a valenciaelektronokhoz.
- Teljes valenciaelektronszám = 8 + 24 + 2 = 34
Teljes valenciaelektron-párok
Teljes valenciaelektron-párok = σ kötések + π kötések + magányos párok a valenciahéjakon
A teljes elektronpárokat úgy határozzuk meg, hogy az összes valenciaelektronok számát elosztjuk kettővel. A C2O42- ion esetében az összes elektronpár 17.
A C2O42- ion centrális atomja
Azért, hogy centrális atom legyen, fontos a nagyobb valenciával rendelkező képesség. A szénnek nagyobb esélye van arra, hogy a központi atom legyen (lásd az ábrát), mert a szén 4-es valenciát tud felmutatni. Az oxigén legnagyobb valenciája 2. Így most felépíthetjük a C2O42- ion vázlatát.
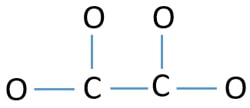
Magányos párok az atomokon
- A fenti vázlaton négy C-O kötés és egy C-C kötés van, ami öt kötést jelent. Ezért csak tizenkét (17-5 = 12) valenciaelektron-pár marad.
- Először is jelöljük meg ezt a tizenkét valenciaelektron-párt mint magányos párokat a külső atomokon (oxigénatomokon). Egy oxigénatom a nyolcas szabály szerint (az oxigénatom nem tarthat nyolcnál több elektront a valenciahéjában) három magányos párt vesz fel.
- Négy oxigénatom esetén tizenkét elektronpár fogy el. Most már nincs több magányos pár, amit az oxigénatomokon (külső atomokon) lévő magányos párok jelölése után a szénatomokon jelölni kell.
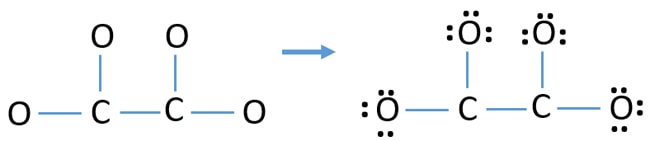
Az atomok töltései
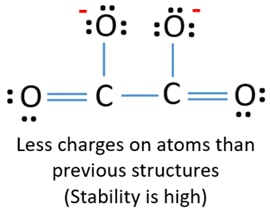
Az atomokon lévő elektronpárok jelölése után (ebben az esetben csak az oxigénatomokon) meg kell jelölnünk az egyes atomok töltéseit, ha van töltés. A töltések jelölése azért jelentős, mert az ion legjobb Lewis-szerkezetének meghatározására szolgál. A töltések jelölése után látni fogjuk, hogy minden oxigénatom -1 töltést kap, és mindkét szénatom +1 töltést kap.
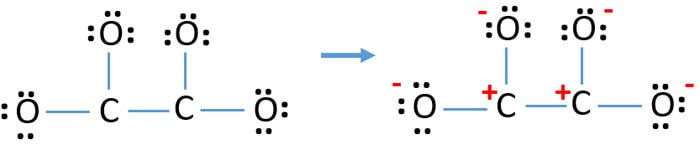
Ez a szerkezet nagyon instabil, mert az ionban mindenhol vannak töltések.
Vizsgáljuk a stabilitást és minimalizáljuk az atomok töltéseit a magányos párok kötéssé alakításával
- Az oxigénatomoknak negatív töltést kell tartaniuk, mert az oxigénatom elektronegativitása nagyobb, mint a szénatomé. Máskülönben azt mondhatjuk, hogy az oxigénatomok negatív töltések megtartásának képessége nagyobb, mint a szénatomoké.
- A rajzolt szerkezet nem stabil, mert minden atomnak van töltése (a Lewis szerkezetnek stabilnak kellene lennie, kevesebb töltéssel).
- Most meg kell próbálnunk minimalizálni a töltéseket a magányos párok vagy párok kötésekké alakításával. Tehát egy oxigénatom egy magányos párját alakítsuk át C-O kötéssé.
- Most van egy kettős kötés egy szénatom és egy oxigénatom között (egy C=O kötés). Most három egyszerű kötés van a szénatom és a másik három oxigénatom között (két C-O kötés).
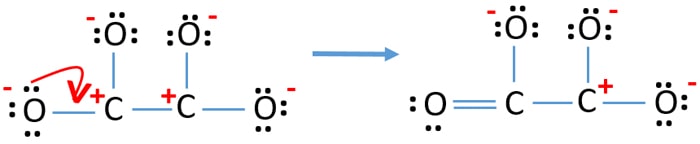
Az új szerkezetben az atomok töltései csökkentek az előző szerkezethez képest. Most már nincs töltés egy oxigénatomon és egy szénatomon. De három oxigénatomon (-1 negatív töltéssel) és a másik szénatomon még mindig van töltés. Most már érted, hogy ez a C2O42- szerkezet stabilabb, mint az előző szerkezet. De megpróbáljuk csökkenteni a töltéseket, amennyire csak lehetséges.
A töltések további csökkentése
A másik oxigénatom magányos párját C-O kötéssé alakíthatjuk az alábbiak szerint.
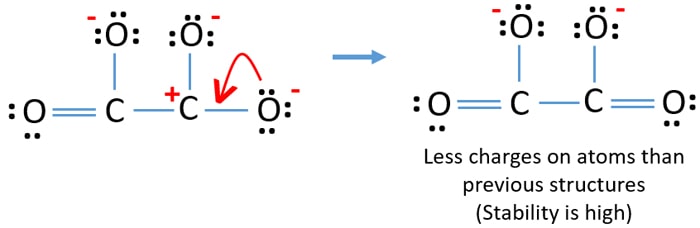
C2O42- (karbonát) ion lewis szerkezete
Kérdések
Kémiai kérdései és megtalálja a válaszokat
Kapcsolódó oktatóanyagok
.