A szén-tetrakloridot CCl4-ként is kifejezhetjük, és egy szénmolekulából és négy kloridmolekulából áll. A szén-tetraklorid nem poláris. Miért nem poláris a szén-tetraklorid? Azért nem poláris, mert a molekula dipólusmomentumai egyenletesen helyezkednek el a központi szénatom körül. Ez azt jelenti, hogy egyedi hatásaik kiegyenlítődnek, és a molekula semleges.
A négy klóratom szimmetrikusan helyezkedik el egy tetraéder négy sarkában, és mindegyiküket egyetlen kötés köti a molekula közepén lévő szénatomhoz. Ennek eredményeként a CCl4-nek nincs nettó pozitív vagy negatív dipólusmomentuma. Ha a klórtól eltérő atom helyezkedett volna el a molekulában bármely más helyen, a molekulának dipólusmomentuma lenne, és a CCl4 ennek következtében poláris lenne.”
“A szerves kémiát a szénvegyületek kémiájaként határozzuk meg”. – August Kekule
Ez a gyors válasz a széntetraklorid polaritását illetően. Hasznos lenne azonban általában a molekulák polaritásáról beszélni, és megvizsgálni a szén-tetrakloridot és annak tulajdonságait, hogy megértsük, miért nem poláris a természetben.
Mit jelent, hogy egy molekula poláris?
Amikor a poláris kifejezést halljuk, valószínűleg a Föld északi és déli pólusára gondolunk. Ezek az északi és déli pólusok a Föld ellentétes végein helyezkednek el, hasonlóan ahhoz, ahogyan egy akkumulátornak is lehet pozitív és negatív pólusa. A molekulák és az atomok közötti kötések is lehetnek polárisak. Egy molekula akkor tekinthető polárisnak, ha a molekulát alkotó atomok úgy helyezkednek el, hogy a molekula egyik vége pozitív töltésű, a másik vége pedig negatív töltésű.
Egy poláris molekula akkor jön létre, amikor egy magas elektronegativitású atom egyesül vagy kötődik egy gyengébb elektronegativitású atomhoz. A keletkező molekulának van egy magas elektronegativitású és egy alacsonyabb elektronegativitású vagy elektromos pólusú régiója. A poláris molekulák egyik leghíresebb példája a víz, és a víz poláris természetének köszönhető, hogy a földi élet alapjául szolgál.
A nem poláris molekulákból ezzel szemben hiányoznak az elektromos pólusok, és a bennük lévő elektronok egyenletesebben oszlanak el. A nem poláris molekulákból hiányzik a molekula mindkét végén egy-egy említésre méltó töltés. A legtöbb szénhidrogén-folyadék természeténél fogva nem poláris.
Egyszóval az olyan molekula, amelynek dipólusai nem egyenlítik ki egymást, poláris, míg a nem poláris molekulák azok, ahol az atomok töltései kioltják egymást, és a molekula egyik vagy másik végén sincs töltés.
Példák poláris molekulákra
Amint már említettük, a víz poláris molekula. Az oxigénatomok és a hidrogénatomok között létező kötések úgy vannak elosztva, hogy az atom mindkét oldala, mind az oxigén-hidrogén, mind a kötések egyenletesen helyezkednek el. Ez azt eredményezi, hogy az oxigén oldala, vagyis a molekula teteje enyhén negatív töltéssel rendelkezik, míg a hidrogénatomok, vagyis a molekula alja enyhén pozitív töltéssel rendelkezik.
Az etanol azért poláris molekula, mert a molekulán belül található oxigénatomok nagyobb elektronegativitással rendelkeznek, mint a többi atom. Az oxigénatomok a nagyobb elektronegativitási potenciáljuk miatt több elektront vonzanak magukhoz, és a molekulában lévő -OH kötéscsoportok összességében negatív töltéssel rendelkeznek, még ha a negatív töltés nagyon csekély is.
“Az élet csak azért létezik a világegyetemben, mert a szénatom bizonyos kivételes tulajdonságokkal rendelkezik.”. – James Jeans
VEZETÉS
A poláros molekulák további példái közé tartozik a kén-dioxid (SO2), a hidrogén-szulfid (H2S) és az ammónia (NH3).
Figyeljünk arra, hogy egy molekula állhat poláros kötésekből, és mégis lehet nem poláros. Példa erre a szén-dioxid, amely négy kötéssel rendelkezik, mégis a molekula dipólusmomentumai végül semlegesítik egymást, így a molekula nem poláris.
Példák a nem poláris molekulákra

A nem poláros molekulák példái közé tartozik a nitrogén, a metán, az ózon és az oxigén. Ezek homonukleáris molekulák vagy csak egy elem atomjaiból álló molekulák. A nem homonukleáris nem poláris molekulák közé tartozik a fent említett szén-dioxid és a metán. A toluol és a benzin is példa a nem poláris anyagokra. Általános szabályként a szénvegyületek nem polárisak, bár vannak kivételek, mint például a szén-monoxid. A szén-monoxid lineáris természetű, ami általában nem teszi a molekulát polárissá, azonban az oxigén és a szénmolekula közötti elektronegativitás-különbség elég jelentős ahhoz, hogy a molekula poláris legyen. Az alkinok nem oldódnak vízben, ezért nem poláris molekuláknak számítanak. Az inert vagy nemesgázok szintén a nem poláros molekulák közé sorolhatók, mivel a gázok csak az adott elem egyetlen atomjából állnak, mint például a neon, a hélium, az argon és a kripton.
Egy molekula polaritásának megjóslása
A molekulában lévő atomok elektronegativitási értékeinek vizsgálata segít meghatározni, hogy a molekula valószínűleg poláros vagy nem poláros lesz-e vagy sem. Az elektronegativitási értékek közötti jelentős különbségek arra utalnak, hogy az elektronok egyenlően oszlanak meg a molekula atomjai között. Mivel az elektronok közelebb lesznek az egyik atomhoz, mint a másikhoz, a molekula adott régiója poláris lesz, bár az egész molekula polaritásának meghatározásához az összes kötést figyelembe kell venni.
A molekula polaritásának vagy nem polaritásának meghatározó tényezője a molekula geometriája. Ha a molekula egyik vége negatív töltésű, míg a molekula másik vége pozitív töltésű, akkor a molekula poláros lesz. Ha azonban a töltések egyenletesen oszlanak el, és egy központi atom körül keringenek, a molekula valószínűleg nem poláris. Ennek segítségével megjósolhatod, hogy egy molekula poláris vagy nem poláris lesz-e. Nem minden molekulának van dipólusmomentuma, és ez egy kicsit megnehezítheti egy molekula polaritásának megjóslását. Például az olyan molekuláknak, amelyek megfordíthatók és tükrözhetők egy geometriai síkban, nincs dipólusmomentumuk, mert a dipólusmomentumok nem tartalmazhatnak egyetlen pontnál többet.
Tények a szén-tetrakloridról
A szén-tetrakloridot először Henri Victor Regnault francia kémikus fedezte fel az 1800-as évek közepén. A vegyi anyagot a klór és a kloroform kombinációjával fedezte fel. Ennek ellenére a szén-tetrakloridot manapság főként metánból nyerik. A szén-tetraklorid előállítása gyakran úgy működik, hogy a klórozási reakciók melléktermékeiből nyerik a vegyületet. Ide tartoznak a kloroform és a diklórmetán előállításának melléktermékei. A szén-tetraklorid meglehetősen illékony természetű, a száraztisztító vegyszerekhez hasonló szagot áraszt. A szén-tetraklorid oldószer is, ezért hasznos a nem poláros anyagok, például olajok és zsírok oldására.
A szén-tetrakloridnak sokféle alkalmazása van, tisztítószerként, hűtőközegként és tűzoltószerekben is használták már. A szén-tetrakloridot gyakran használják a lávalámpák készítéséhez, a viaszt nehezebbé téve.
“… A szénmolekulát gondolattal bélelték ki?”. – Saul Bellow
A szén-tetraklorid környezeti hatásai miatt az 1980-as évek óta meredeken csökkent a gyártása. A Montréali Jegyzőkönyv korlátozta a klórozott-fluorozott szénhidrogének gyártását, és mivel a szén-tetraklorid kulcsfontosságú összetevője a CFC-k előállításának, a szén-tetraklorid gyártása ennek következtében meredeken csökkent. A szén-tetraklorid káros egészségügyi hatásai szintén termelésének csökkenését okozták, és bár egykor széles körben használták oldószerként, ma már ritkán alkalmazzák ilyen célokra.
A szén-tetraklorid rendkívül mérgező a májra, és más májkárosító anyagokat gyakran hasonlítanak össze a szén-tetraklorid toxicitásával. A szén-tetraklorid nagy koncentrációi nemcsak a májat károsíthatják, hanem a veséket is károsíthatják. A szén-tetrakloridnak való tartós kitettség kómát vagy halált okozhat. A vegyi anyagnak való kitettség a rák kialakulásának esélyét is növelheti.
Miért poláros a szén-tetraklorid?
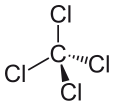
Azt követően, hogy láttuk, mitől lesz egy molekula poláros, és megnéztünk néhány példát a poláros molekulákra, most már jobban megérthetjük, hogy a szén-tetraklorid miért nem poláros molekula. Az első dolog, amit meg kell tennünk, amikor megpróbáljuk meghatározni, hogy egy molekula poláros vagy nem poláros-e, az a molekulán belüli atomok elektronegativitási értékeinek kiszámítása. Meg kell állapítani a két atom közötti kötés polaritását, és az összes kötést figyelembe kell venni, amikor megpróbáljuk meghatározni a molekula polaritását. A klorid és a szén elektronegativitási értékeinek különbsége azonban – a szén-tetraklorid esetében – nem az egyetlen tényező, amelyet figyelembe kell venni. A molekula alakját is figyelembe kell venni. Bár a molekulában dipólusok vannak jelen, a szén-tetraklorid lineáris alakja azt jelenti, hogy a molekulában lévő különböző dipólusmomentumok hatásai kioltják egymást, és a molekula ennek következtében semleges vagy nem poláris.