DOI: 10.17235/reed.2016.4095/2016
ORIGINAL PAPERS
Association between the location of colon polyps at baseline and surveillance colonoscopy – A retrospective study
Ana Oliveira, Paulo Freire, Paulo Souto, Manuela Ferreira, Sofia Mendes, Clotilde Lérias, Pedro Amaro, Francisco Portela and Carlos Sofia
Department of Gastroenterology. Centro Hospitalar e Universitário de Coimbra. Coimbra, Portugália.
Korrespondencia
ABSTRACT
Bevezetés: Számos tényezőt használnak a polip kiújulásának valószínűségének rétegzésére. Nincsenek azonban olyan tanulmányok, amelyek a kezdeti polipok és a kiújuló polipok elhelyezkedését összefüggésbe hoznák. E vizsgálat célja annak ellenőrzése volt, hogy a polipok elhelyezkedése a felügyeleti kolonoszkópián korrelál-e a korábban kimetszett polipok elhelyezkedésével a kiindulási kolonoszkópián.
Módszerek: Az összes polip jelenlétével és kimetszésével kolonoszkópiára bocsátott betegek retrospektív vizsgálata, amelyet felügyeleti kolonoszkópia követett. A polipok elhelyezkedését proximalis/distalisan a léphajlatra és a végbélre osztottuk. Az azonos vastagbélhelyen előforduló polipok jellemzőit és ismétlődési arányát is értékelték.
Eredmények: Az ismételt kolonoszkópián átesett 346 beteg közül 268-nál (77,4%) legalább 1 polipot fedeztek fel. Valamennyi szegmens esetében megnövekedett volt az ugyanazon a helyen ismétlődő polipok kockázata, és körülbelül négyszer magasabb volt a proximális (OR 3,5; CI 2,1-6,0) és a disztális vastagbélszakaszokban (OR 3,8; CI 2,1-6,8), majd háromszor magasabb a végbélben (OR 2,6; CI 1,5-4,6). Nem találtak különbséget a kiújulási arányok között ugyanazon szegmensben, figyelembe véve a polip morfológiáját, méretét, az alkalmazott polipektómiás technikát és a szövettani besorolást.
Következtetés: Úgy tűnik, hogy szignifikáns összefüggés van a polipok kiindulási helyzete és a felügyeleti kolonoszkópia között.
Kulcsszavak: Colon. Polip. Elhelyezkedés. Recurrence.
Bevezetés
A vastagbél és a végbél adenómái gyakori jóindulatú daganatos elváltozások, amelyeket a kolonoszkópiára jelentkező betegek mintegy 25%-ánál fedeznek fel (1). A vastagbélrák (CRC) világszerte a harmadik leggyakoribb daganatos megbetegedés és a rák okozta halálozás negyedik oka (2). A kolonoszkópia és a rákot megelőző elváltozások endoszkópos felismerése és reszekciója a CRC által okozott incidencia és mortalitás csökkenéséhez vezet (3). Úgy tűnik, hogy ez a kockázatcsökkenés a disztális vastagbél esetében erősebb. Mindazonáltal a kolonoszkópiával az incidencia 77%-os csökkenését és a CRC-vel kapcsolatos halálozás 29-37%-os csökkenését figyelték meg (4,5). A felügyeleti kolonoszkópia ajánlott a korábbi adenomatosus polipokkal rendelkező betegeknél, a metakrón, visszatérő és új elváltozások kockázata miatt (6). A felügyeleti kolonoszkópia során az adenomák megtalálásának kockázata a kezdeti kolonoszkópia eredményétől függ. Az arány magasabb az előrehaladott adenómás betegeknél, közepes a nem előrehaladott adenómás betegeknél, és alacsonyabb az adenómát nem mutató betegeknél (7). A kolonoszkópia fontossága ellenére az intervallumos vastagbélrákot egy korábbi, polipektómiával vagy negatív lelettel végződő kolonoszkópia után találják meg (3,8). Ez több tényező miatt fordulhat elő, például kihagyott elváltozások, hiányosan eltávolított polipok kiújulása vagy az előző kolonoszkópia óta kialakult új elváltozások miatt (9). A polipok kiújulásának valószínűségének rétegzésére több tényezőt is használnak, köztük a szövettan, a méret és a szám. Egyes tanulmányok a proximalis vastagbélnek mint a jövőbeni adenóma kiújulás markerének is kedveznek (10), sőt a proximalis vagy distalis kiújulás között is van némi összefüggés (7,11). Így e vizsgálat célja annak ellenőrzése volt, hogy a polipok elhelyezkedése a felügyeleti kolonoszkópián összefügg-e a korábban kimetszett polipok elhelyezkedésével a kiindulási kolonoszkópián.
Anyag és módszerek
Megvizsgáltunk retrospektív módon két kolonoszkópián átesett betegeket: egy indexkolonoszkópiát polipokkal és egy felügyeleti kolonoszkópiát polipokkal vagy polipok nélkül. Pozitív asszociációt definiáltunk a polipok kiújulásában ugyanazon a helyen, ha a megfigyelő kolonoszkópián legalább egy metakronikus polip volt ugyanabban a vastagbélszegmensben, mint az index-kolonoszkópián egy vagy több.
A betegeket a gasztroenterológiai osztályról vettük fel 2004 januárjától 2014 decemberéig. A felvételi kritériumok közé tartoztak a 18 év feletti betegek, akiknél két jó minőségű kolonoszkópiát végeztek, amelyek között legalább egy év telt el, és az alapkolonoszkópiában kimutatott összes polipot eltávolították. A jó minőségű kolonoszkópia kritériumai azt jelentették, hogy azt tapasztalt kolonoszkópos orvos végezte, a béltisztítás mértéke az Ottawa Bowel Preparation Scale (OBPS) alapján értékelve kiváló vagy jó volt, és a cecalis intubáció megvalósult. A betegek kórlapjait elemezték. Összegyűjtöttük a betegek demográfiai adatait, beleértve a nemet és az életkort. A kolonoszkópiás jelentések adatait rögzítettük, beleértve a polipok számát, méretét, morfológiáját és elhelyezkedését, valamint a reszekciós technikát. Az elváltozásokat a párizsi osztályozás (12) szerint osztályoztuk. A 0. típusú, nem polipoid elváltozásokat és a 20 mm-nél nagyobb polipokat kizárták. A polipok elhelyezkedését a léphajlathoz és a végbélhez proximálisan vagy distalisan elhelyezkedő polipok szerint osztályoztuk. A reszekciós technikát hideg biopsziás csipesszel végzett reszekcióra, standard snare kimetszésre és szubmukózális injekcióra, majd reszekcióra osztottuk. Ezeket az adatokat mindkét kolonoszkópiából gyűjtötték. A szövettani jelentést mindkét kolonoszkópia során az összes eltávolított és visszanyert polipról megkaptuk. A szövettani diagnózist a felülvizsgált bécsi osztályozás (13) szerint osztályozták. A polipokat a mirigyes felépítésük alapján is kategorizáltuk: tubuláris, tubulovillózus, villózus és serrated. Ezeket az adatokat használtuk fel az adenómák előrehaladott és nem előrehaladott adenómákra történő rétegzéséhez. Így előrehaladott adenomának tekintették, ha az 1 cm-es vagy annál nagyobb volt, és villózus szövettani felépítésű vagy magas fokú diszpláziát mutatott (6). A reszekciós margók szövettani elemzését a következők szerint osztályozták: teljes reszekció (R0), a reszekciós margókat nem lehetett teljes mértékben értékelni (Rx) vagy maradék lézió volt jelen (R1). Kizáró kritériumok közé tartoztak a vastagbélműtéten átesett vagy a kiindulási kolonoszkópiát megelőzően CRC-vel, gyulladásos bélbetegséggel vagy polipózis szindrómával rendelkező betegek.
A vizsgálatot az etikai bizottság jóváhagyta. Valamennyi szerző hozzáférhetett az adatokhoz, valamint átnézte és jóváhagyta a végleges kéziratot.
Statisztikai elemzések
Az előzetes adataink azt mutatják, hogy a felügyeleti kolonoszkópia során felfedezett polipok az esetek legalább 20%-ában ugyanazon a helyen jelennek meg, mint a kiindulási vizsgálatnál megfigyeltek. Az α értékét 0,05-re, a teljesítményt 80%-ra és az eset-kontroll arányt 1:2-re állítva úgy becsültük, hogy 195 betegre lenne szükség.
A kategorikus változókat gyakoriságban és százalékban fejeztük ki. A folyamatos változókat átlagban (standard deriváció, SD) fejeztük ki. A normalitás értékelésére a Kolmogorov-Smirnov-tesztet használtuk. A kategorikus változókat a Chi-négyzet teszttel, a folytonos változókat pedig a Student’s t teszttel hasonlítottuk össze normális eloszlású adatok esetén, illetve Mann-Whitney U-teszttel, ha az adatok nem normális eloszlást mutattak. A két kolonoszkópia eredményei közötti egyezés meghatározására a Cohen Kappa-tesztet használták. Az esélyhányadot (OR) 95%-os konfidenciaintervallummal (CI) számították ki; az 1,0-t nem tartalmazó CI azt jelezte, hogy a változók között szignifikáns kapcsolat áll fenn. Az adatok közötti különbségeket akkor tekintettük statisztikailag szignifikánsnak, ha a kétoldali p-érték kisebb volt, mint 0,05.
Először mindkét kolonoszkópia eredményeit elemeztük. Ezután kiszámították az alap- és a felügyeleti kolonoszkópia azonos helyére vonatkozó kiújulási arányok egyezését. Továbbá értékeltük azokat a lehetséges tényezőket, amelyek hozzájárulhatnak a polipok kiújulásához ugyanazon a helyen, mint például a polipok jellemzői vagy szövettani jellemzői.
Az adatok elemzését a Statistical Package for Social Sciences-SPSS (SPSS Inc. USA), IBM®, Mac OS X számítógépes szoftverrel (21. verzió).
Eredmények
A két jó minőségű kolonoszkópián átesett 346 beteg közül, akiknél az index-kolonoszkópián polipok voltak, 78 betegnél nem volt polip a felügyeleti kolonoszkópián. Így összesen 268 beteget vontak be a vizsgálatba (1. ábra). A betegek átlagéletkora 64 (SD 10) év volt, 29 és 82 év között, férfi túlsúlyban (64,9%).
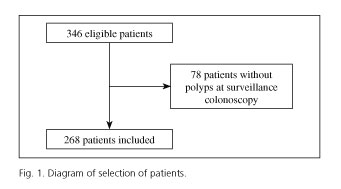
A két kolonoszkópia közötti átlagos időköz 37 (SD 20) hónap volt.
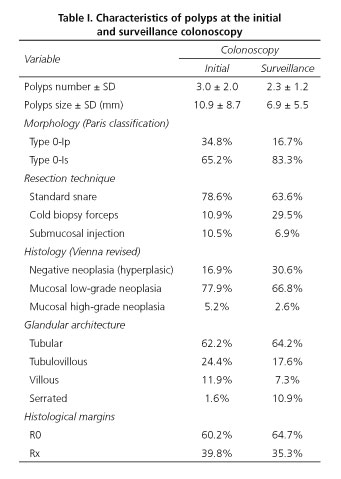
Az indító és a felügyeleti kolonoszkópián talált polipok jellemzőit az I. táblázat tartalmazza. A kezdeti kolonoszkópián a felfedezett és reszekált polipok átlagos száma 3,0 (SD 2,0), a felügyeleti kolonoszkópián pedig kevesebb mint 2,3 (SD 1,2) volt. A polipok jellemzőit tekintve az első kolonoszkópián az átlagos méret 10,9 mm volt (SD 8,7), a második kolonoszkópián a polipok kisebbek voltak, átlagosan 6,9 mm-esek (SD 5,5). Kezdetben a morfológia 34,8%-ban 0-Ip típusú, 65,2%-ban pedig 0-Is típusú volt; a második kolonoszkópián pedig továbbra is azt tapasztaltuk, hogy a szesszilis morfológia dominált, de nagyobb arányban, tekintve, hogy a 0-Is típusú polipok aránya 83,3% volt. A mirigyes architektúra mindkét esetben hasonló volt, kivéve a serrated polipok nagyobb előfordulását a felügyeleti kolonoszkópián (1,6% vs. 10,9%).
A kezdeti kolonoszkópián a betegek 42,5%-ának a proximális vastagbélben, 75,0%-ának a disztális vastagbélben és 30,2%-ának a végbélben volt polipja. A felügyeleti kolonoszkópián az eloszlás hasonló volt: 52,6% a proximális vastagbélben, 60,1% a disztális vastagbélben és 25,0% a végbélben. A kolonoszkópiák között a polipok elhelyezkedését illetően 44%-os volt az egyezés aránya. A II. táblázat mutatja a kiújulás valószínűségét ugyanabban a vastagbélszakaszban. A vastagbél minden szegmensében megnövekedett az ugyanazon a helyen lévő polipok kiújulásának kockázata. Ez a kockázat hasonló mind a proximális (OR 3,5; CI 2,1-6,0), mind a disztális vastagbélszegmensek esetében (OR 3,8; CI 2,1-6,8), majd a végbél (OR 2,6; CI 1,5-4,6) következik, p < 0,001. A Kappa értékek 0,29 (95% CI; 0,19-0,41) és 0,27 (0,16-0,38) voltak a proximális és a disztális vastagbél esetében, ami az egyezés közepes erősségét mutatja, és 0,20 (CI 0,08-0,33) a végbél esetében, ami gyenge egyezést jelent, p <0.001 (III. táblázat).


A különböző tényezők elemzése, amelyek hozzájárulhatnak a polip kiújulásához ugyanazon a helyen, nem mutat statisztikailag szignifikáns különbségeket (IV. táblázat). Ugyanakkor kis túlsúlyban volt a magasabb kiújulás ugyanazon a szegmentumon, ha a reszekciót szubmukózális injekcióval végezték (70,4%), szemben a biopsziás fogóval (68,3%) és a snare-rel (61,4%), valamint a hiperplasztikus polipok (75,7%) esetében, szemben az alacsony fokú (66,7%) vagy magas fokú diszpláziás polipokkal (66,7%). A szövettani margókban nem volt különbség, és bár az Rx (68,1%) gyakoribb volt, mint a teljes reszekció (53,3%), ennek nem volt statisztikai szignifikanciája (p = 0,511). Ugyancsak nem volt különbség a kiújulás valószínűségében ugyanazon a helyen a rétegzés után az előrehaladott adenoma (70,8%), a nem előrehaladott adenoma (61,9%) és a hyperplasztikus adenoma (75,7%) esetében, p = 0,216. (p = 0,216). A kolonoszkópiák közötti idő nem volt összefüggésben az ugyanazon a helyen lévő polipok kiújulásával (36 vs. 38 hónap).

Diszkusszió
Vizsgálatunkban szignifikáns összefüggést találtunk a kezdeti és a kiújuló polip helye között. Valamennyi vastagbélszegmens esetében a polipok jelenléte a kiindulási kolonoszkópián szignifikáns kockázatot jelent az ugyanabban a lokalizációban történő kiújulás szempontjából a felügyeleti kolonoszkópián. Ez a kockázat körülbelül négyszer nagyobb a disztális vastagbélben, amelyet szorosan követ a proximális vastagbél. A lokalizációs egyezés e magas arányának több lehetséges magyarázata is van. Először is, a kórtörténetben poliprezekcióval rendelkező betegeknél a kolonoszkópos orvos fokozottabb figyelmet fordíthat a korábbi polipfelismerés helyeire. Egy másik ok a nem teljes eltávolítás miatti polipok újbóli megjelenésével függ össze. A nem teljes reszekció mint kiújulási tényező csökkentése céljából kizártuk a lapos és nagyobb elváltozásokat. Ebben a vizsgálatban a rezekció szövettani határai (teljes vs. maradék lézió) szintén nem játszottak szerepet a kiújulási arányban. A polip kihagyási aránya 20% körüli, és az elváltozások méretének csökkenésével nő (14). Az adenomák kihagyása szintén magyarázatot adhat a kiújuló polipokra, bár ezt a tényezőt igyekeztünk csökkenteni azzal, hogy csak jó minőségű kolonoszkópiákat választottunk. A lokalizációs egyezés magas arányának másik lehetősége az új elváltozások kialakulásával függ össze. Ezeket az új elváltozásokat okozhatja a polipok eltávolítását követő gátló hatás hiánya (7), vagy a karcinogenezisnek kedvező helyi hatások, például az ismételt/tartós gyulladás vagy sérülés (9). Ezenkívül ezek az új elváltozások más és gyorsabb karcinogenezishez kapcsolódhatnak. Kimutatták, hogy a polypectomiát követő intervallumrákok a vártnál gyakrabban jelennek meg a korábbi polypectomia szegmensében (9). Ez a tanulmány megerősíti ezeket a korábbi eredményeket, mivel kimutatta, hogy a polipok ugyanott is hajlamosak kiújulni. Az intervallumrákok esetében a tanulmányok azt mutatják, hogy 70-80%-ban túlnyomórészt hiányzó, nem pedig új léziókról van szó (15,16).
Tudott, hogy az adenomák kiújulási aránya a kezdeti kolonoszkópia után 3-4 évvel 30-40% körülire becsülhető (8,17). Az adenomák kiújulásának kockázata a felügyeleti kolonoszkópián a korábbi kolonoszkópia leleteitől függ. A kockázat magasabb az előrehaladott és/vagy többszörös adenomák esetében (7,10,18). Ezzel a feltételezéssel elemeztük a polipok jellemzőit (méret, morfológia és szövettan), a reszekciós margókat (hiperpláziás vagy adenomatózus szövet jelenléte) és a polipektómia elvégzésének technikáját. Nem találtunk olyan statisztikailag szignifikáns tényezőket, amelyek hozzájárulhattak volna az ugyanazon a helyen történő kiújuláshoz. Még az előrehaladott adenomában történő rétegzés után sem volt kiújulási tényező.
Úgy tűnik, nincs összefüggés a csak hyperplasztikus polipokat tartalmazó kolonoszkópiát követő felügyeleti kolonoszkópia során az adenomák kimutatásának valószínűsége között (19). Vizsgálatunkban azt találtuk, hogy a második kolonoszkópiában megnövekedett a hiperpláziás polipok száma, bár a szövettani típus nem járult hozzá az ugyanazon a helyen történő kiújuláshoz. Ez a nyálkahártya hiperproliferációját kiváltó helyi reakcióval indokolható, mivel a hiperplasztikus polipok normális sejtkomponensekből állnak. A hiperplasztikus elváltozások mutációkat szerezhetnek, különösen K-ras, de BRAF mutációkat is, amelyek képesek ezeket az elváltozásokat rákká alakítani (20-22). Nemcsak a hyperplasztikus polipok, hanem a serrated polipok is rendelkeznek CRC-potenciállal (23). A serrated polipokat gyakrabban azonosították a második kolonoszkópia során (bár nem járultak hozzá a kiújulás tényezőjeként). Ez a patológusok elemzésének időpontjában mutatkozó különbségekkel magyarázható. Az általában hiperplasztikusnak minősített serrated polipokat ma már a serrated daganatokkal egy csoportba sorolják. A szessilis serrated polipok vagy serrated adenomák általában kicsik vagy laposak, gyorsabban nőhetnek, és a karcinogenezis más úton haladhatnak előre. A nem teljes eltávolítás magasabb arányával is járnak (24,25).
Vizsgálatunknak vannak korlátai. A vizsgálati populáció kis mintát tartalmaz, retrospektív módon rögzítették, és a vizsgálatot egy egyetemi kórházban végezték, így ezek az eredmények nem biztos, hogy reprezentatívak az általános populációra nézve. Tanulmányunkban nem vettük figyelembe sem a rák/polip kialakulásával összefüggésbe hozható potenciális kockázati tényezőket, mint a dohányzás (26), a vörös húsok fogyasztása és a magas testtömegindex (27), sem a védőfaktorokat, mint az acetilszalicilsav vagy a nem-szteroid gyulladáscsökkentők (28) és a gyümölcsfogyasztás (29). Bár magasan képzett kolonoszkóposok végezték az összes kolonoszkópiát, a csapatban több olyan orvos is részt vett, aki az alap- és a felügyeleti kolonoszkópia között váltott. Továbbá, mint korábban említettük, mindig figyelembe kell venni az adenomák kihagyásának lehetőségét.
Végeredményben úgy tűnik, hogy a polipok elhelyezkedése a kiindulási és a felügyeleti kolonoszkópián jelentős összefüggést mutat. Ez a jövőben hatással lehet a kolonoszkópiák technikai kivitelezésére és pontosságára, beleértve a figyelmeztetést azon szegmensek óvatos vizsgálatára, ahol korábban polipokat távolítottak el. Érdekes lenne a terephatás szerepének feltárása is, összehasonlítva az eltávolított polipok közelében lévő nyálkahártya szövettani jellemzőit és molekuláris jellemzőit a megmaradt nyálkahártyával. Ezek az eredmények további kutatásokat igényelnek, ideális esetben egy nagyobb vizsgálati populáción végzett prospektív és multicentrikus vizsgálat révén.
1. Giacosa A, Frascio F, Munizzi F. A kolorektális polipok epidemiológiája. Tech Coloproctol 2004;2:s243-7. DOI: 10.1007/s10151-004-0169-y.
2. Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, Methods and major patterns in GLOBOCAN 2012. Int J Cancer 2014;136(5):E359-86. DOI: 10.1002/ijc.29210.
3. Zauber AG, Winawer SJ, O’Brien MJ, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med 2012;366:687-696. DOI: 10.1056/NEJMoa1100370.
4. Brenner H, Chang-Claude J, Seiler CM, et al. Protection from colorectal cancer after colonoscopy: Egy populációs alapú, eset-kontroll vizsgálat. Ann Intern Med 2011;154:22-30. DOI: 10.7326/0003-4819-154-1-201101040-00004.
5. Baxter N, Goldwasser M, Paszat L, et al. Association of colonoscopy and death from colorectal cancer. Annals of Internal Medicine 2009;150:1-8. DOI: 10.7326/0003-4819-150-1-200901060-00306.
6. Lieberman DA, Rex DK, Sidney JW, et al. Guidelines for colonoscopy surveillance after cancer resection: A consensus update by the American Cancer Society and the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2012;143:844-57. DOI: 10.1053/j.gastro.2012.06.001.
7. Pinsky P, Schoen R, Weissfeld J, et al. The yield of surveillance colonoscopy by adenoma history and time to examination. Clin Gastroenterol Hepatol 2009;7:86-92. DOI: 10.1016/j.cgh.2008.07.014.
8. Lieberman DA, Weiss DG, Harford WV, et al. Five year colon surveillance after screening colonoscopy. Gastroenterology 2007;133:1077-85. DOI: 10.1053/j.gastro.2007.07.006.
9. Brenner H, Chang-Claude J, Jansen L, et al. Polipfelismerő kolonoszkópia után előforduló vastagbélrákok: A polipok helye és a rákok helye. Int J Cancer 2013;133:1672-9. DOI: 10.1002/ijc.28166.
10. Martínez ME, Samplier R, Marshall JR, et all. Az adenóma jellemzői mint az előrehaladott adenómák kiújulásának kockázati tényezői. Gastroenterology 2001;120:1077-83. DOI: 10.1053/gast.2001.23247.
11. Avidan B, Sonnenberg A, Schnell TG, et al. A daganatok újbóli előfordulása és kiújulása a szűrő kolonoszkópiát követő 5 éven belül. Am J Gastroenterol 2002;97:1524-9. DOI: 10.1111/j.1572-0241.2002.05801.x.
12. Párizsi workshop résztvevői. A felületes daganatos elváltozások párizsi endoszkópos osztályozása: nyelőcső, gyomor és vastagbél: November 30. és december 1. között, 2002. Gastrointest Endosc 2003;58:S3-S43.
13. Schlemper RJ, Riddell RH, Kato Y, et al. The Vienna classification of gastrointestinal epithelial neoplasia. Gut 2000;47:251-5. DOI: 10.1136/gut.47.2.251.
14. Heresbach D, Barrioz T, Lapalus MG, et al. Miss rate for colorectal neoplastic polyps: a back-to-back videokolonoszkópiák prospektív multicentrikus vizsgálata. Endoscopy 2008;40:284-90. DOI: 10.1055/s-2007-995618.
15. Pohl H, Robertson D. A kolonoszkópia után felfedezett vastagbélrákok gyakran el nem vett elváltozásokból erednek. Clin Gastroenterol Hepatol. 2010;8:858-64. DOI: 10.1016/j.cgh.2010.06.028.
16. Singh H, Nugent Z, Demers AA, et al. Rate and predictors of early/missed colorectal cancers after colonoscopy in Manitoba: a population-based study. Am J Gastroenterol 2010;105:2588-96. DOI: 10.1038/ajg.2010.390.
17. Schoen RE. Felügyelet pozitív és negatív kolonoszkópiás vizsgálatokat követően: problémák, hozamok és felhasználás. Am J Gastroenterol 2003; 98:1237-46.
18. Huang Y, Gong W, Su B, et al. A kolorektális adenóma kiújulása és megfigyelése polipektómia után egy dél-kínai populációban. J Gastroenterol 2010;45:838-45. DOI: 10.1007/s00535-010-0227-3.
19. Laiyemo AO, Murphy G, Sansbury L, et al. Hyperplastic polyps and the risk of adenoma recurrence in the Polyp Prevention Trial. Clin Gastroenterol Hepatol 2009;7:192-7. DOI: 10.1016/j.cgh.2008.08.031.
20. Chan TL, Zhao W, Leung SY, et al. BRAF és KRAS mutációk kolorektális hyperplasztikus polipokban és serrated adenomákban. Cancer Res 2003;63:4878-81.
21. Spring KJ, Zhao ZZ, Karamatic R, et al. A BRAF-mutációkkal rendelkező sessilis serrated adenomák magas prevalenciája: Kolonoszkópián átesett betegek prospektív vizsgálata. Gastroenterology 2006;131:1400-7. DOI: 10.1053/j.gastro.2006.08.038.
22. Morimoto LM, Newcomb PA, Ulrich CM, et al. A hyperplasztikus és adenomatosus polipok kockázati tényezői: Bizonyíték a rosszindulatú potenciálra? Cancer Epidemiol Biomarkers Prev 2002;11:1012-8.
23. Snover DC. A kolorektális karcinóma kialakulásához vezető serrated útvonal aktualizálása. Hum Pathol 2011;42:1-10. DOI: 10.1016/j.humpath.2010.06.002.
24. Pohl H, Srivastava A, Bensen SP, et al. Incomplete polyp resection during colonoscopy-Results of the complete adenoma resection (CARE) study. Gastroenterology 2013;144:74-80. DOI: 10.1053/j.gastro.2012.09.043.
25. Lazarus R1, Junttila OE, Karttunen TJ, et al. The risk of metachronous neoplasia in patients with serrated adenoma. Am J Clin Pathol 2005;123:349-59. DOI: 10.1309/VBAGV3BR96N2EQTR.
26. Botteri E, Iodice S, Bagnardi V, et al. Smoking and colorectal cancer: A meta-analysis. JAMA 2008;300:2765-78. DOI: 10.1001/jama.2008.839.
27. Song X, Pukkala E, Dyba T, et al. Body mass index and cancer incidence: A FINRISK tanulmány. Eur J Epidemiol 2014;29:477-87. DOI: 10.1007/s10654-014-9934-z.
28. Din FV, Theodoratou E, Farrington SM, et al. Az aszpirin és a NSAID-ok hatása a vastagbélrák kockázatára és túlélésére. Gut 2010; 59:1670-9. DOI: 10.1136/gut.2009.203000.
29. Koushik A, Hunter DJ, Spiegelman D, et al. Fruits, vegetables, and colon cancer risk in a pooled analysis of 14 cohort studies. J Natl Cancer Inst 2007;99:1471-83. DOI: 10.1093/jnci/djm155.