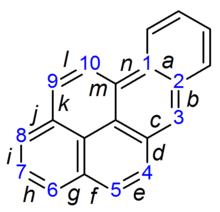
IdegrendszerSzerkesztés
A BaP patkányokban történő prenatális expozíciója ismert, hogy rágcsálómodellekben befolyásolja a tanulást és a memóriát. A BaP-t fogyasztó vemhes patkányokról kimutatták, hogy utódaik késői életében negatívan befolyásolták az agyműködést. Abban az időszakban, amikor a szinapszisok először alakulnak ki, és erősségüket az aktivitás szabályozza, a BaP csökkentette az NMDA NR2B receptor alegység mRNS expressziójaként mért NMDA receptor függő idegsejt aktivitást.
ImmunrendszerSzerkesztés
A BaP hatással van a fehérvérsejtek számára, gátolja, hogy egyesek közülük makrofágokká, a szervezet fertőzések elleni első védelmi vonalává differenciálódjanak. 2016-ban a molekuláris mechanizmust a makrofágmembrán lipidtámasz integritásának károsodásában fedezték fel, a membrán koleszterin 25%-os csökkenésével. Ez azt jelenti, hogy kevesebb immunreceptor CD32 (az immunreceptorok Fc családjának tagja) tudott IgG-hez kötődni és a fehérvérsejtet makrofággá alakítani. Ezért a makrofág membránok fogékonnyá válnak a bakteriális fertőzésekre.
Szaporodási rendszerSzerkesztés
Hím patkányokkal végzett kísérletek során kimutatták, hogy az inhalált BaP szubkrónikus expozíciója általában csökkenti a herék és mellékhere működését, alacsonyabb nemi szteroid/testoszteron termeléssel és spermiumtermeléssel.
KarcinogenitásSzerkesztés
A BaP metabolitjai mutagén és erősen karcinogén hatásúak, és az IARC az 1. csoportba tartozó karcinogénként tartja nyilván. Chemical agents and related occupations, Volume 10, A review of Human Carcinogens, IARC Monographs, Lyon France 2009
2016 júniusában a BaP benzokriczén néven felkerült az engedélyezés szempontjából különösen veszélyes anyagok REACH-listájára.
A 70-es évek óta számos tanulmány dokumentálta a BaP és a rákos megbetegedések közötti kapcsolatot. Nehezebb volt a rákos megbetegedéseket konkrét BaP-forrásokhoz kapcsolni, különösen az emberekben, és nehéz volt számszerűsíteni a különböző expozíciós módszerek (belégzés vagy lenyelés) által okozott kockázatokat. 2005-ben leírták az A-vitaminhiány és a dohányosok tüdőtágulása közötti kapcsolatot, amely a patkányokban A-vitaminhiányt kiváltó BaP-nek tulajdonítható.
Egy 1996-os tanulmány molekuláris bizonyítékot szolgáltatott a dohányfüstben lévő összetevők és a tüdőrák közötti kapcsolatról. Kimutatták, hogy a BaP olyan genetikai károsodást okoz a tüdősejtekben, amely megegyezik a legtöbb rosszindulatú tüdődaganat DNS-ében megfigyelt károsodással.
A főtt húsok rendszeres fogyasztását epidemiológiailag összefüggésbe hozták a vastagbélrák megnövekedett szintjével (bár ez önmagában nem bizonyítja a rákkeltő hatást),Egy 2005-ös NCI tanulmány megállapította, hogy a vastagbél adenómák fokozott kockázata összefügg a BaP bevitelével, és erősebben az összes élelmiszerből származó BaP bevitelével. Maguk az élelmiszerek azonban nem feltétlenül rákkeltőek, még akkor sem, ha nyomokban tartalmaznak rákkeltő anyagokat, mivel a gyomor-bélrendszer a külső réteg folyamatos leválásával védekezik a karcinómák ellen. Továbbá a méregtelenítő enzimek, mint például a citokrómok P450 fokozott aktivitással rendelkeznek a bélben az élelmiszerekkel terjedő toxinok elleni védelem érdekében. Így a legtöbb esetben a BaP kis mennyiségben metabolizálódik, mielőtt a vérbe kerülne. A tüdő egyik módon sem védett.
A citokróm P450 1A1 (CYP1A1) és a citokróm P450 1B1 (CYP1B1) detoxifikáló enzimek mind védő hatásúak, mind szükségesek a benzopirén toxicitásához. A CYP1A1 és CYP1B1 eltávolítására (knockout) módosított egértörzsekkel végzett kísérletek azt mutatják, hogy a CYP1A1 elsősorban védelmet nyújt az emlősöknek a BaP alacsony dózisaival szemben, és hogy e védelem eltávolítása nagy BaP-koncentrációkat halmoz fel. Hacsak a CYP1B1-et sem kapcsolják ki, a toxicitás a BaP bioaktiválásából ered, és a végső mérgező vegyület, a benzopirén-7,8-dihidrodiol-9,10-epoxid keletkezik.
Interakció a DNS-szelEdit

A BaP tulajdonképpen prokarcinogén, ami azt jelenti, hogy rákkeltő mechanizmusa a BaP diol-epoxiddá történő enzimatikus metabolizmusától függ. Interkalálódik a DNS-be, és az elektrofil epoxidot a nukleofil guaninbázisok megtámadják, és egy terjedelmes guaninadduktot képeznek.

Röntgenkrisztallográfiai és nukleáris mágneses rezonancia szerkezetvizsgálatok kimutatták, hogy ez a kötődés hogyan torzítja a DNS-t a kettős hélixes DNS-szerkezet összezavarásával. Ez megzavarja a DNS másolásának normális folyamatát és mutációkat okoz, ami megmagyarázza a rák előfordulását az expozíciót követően. Ez a hatásmechanizmus hasonló az aflatoxinéhoz, amely a guanin N7 pozíciójához kötődik.
Vannak arra utaló jelek, hogy a benzopiréndiol-epoxid kifejezetten a védő p53 gént veszi célba. Ez a gén egy transzkripciós faktor, amely szabályozza a sejtciklust, és így tumorszuppresszorként működik. Azáltal, hogy G (guanin) T (timidin) transzverziókat indukál a p53-on belüli transzverziós hotspotokban, valószínűsíthető, hogy a benzopirén-diol-epoxid bizonyos sejtekben inaktiválja a tumorszupressziós képességet, ami rákhoz vezet.
A benzopirén-7,8-dihidrodiol-9,10-epoxid három enzimatikus reakció rákkeltő terméke:
- A benzopirént először a citokróm P450 1A1 oxidálja, és különböző termékeket képez, köztük (+)benzopirén-7,8-epoxidot.
- Ezt a terméket az epoxid-hidroláz metabolizálja, megnyitva az epoxidgyűrűt, így (-)benzopirén-7,8-dihidrodiol keletkezik.
- A végső karcinogén a citokróm P450 1A1-gyel való újabb reakció után keletkezik, így a (+)benzopirén-7,8-dihidrodiol-9,10-epoxid keletkezik. Ez a diol-epoxid az, amely kovalensen kötődik a DNS-hez.
A BaP a citoszolban lévő AHR-hez (aril-szénhidrogén receptor) kötődve indukálja a citokróm P4501A1-t (CYP1A1). A kötődés után a transzformált receptor transzlokálódik a sejtmagba, ahol dimerizálódik az ARNT-vel (aril-hidrokarbon receptor nukleáris transzlokátor), majd a DNS-ben lévő xenobiotikus válaszelemekhez (XRE-k) kötődik, amelyek bizonyos gének előtt helyezkednek el. Ez a folyamat növeli bizonyos gének, nevezetesen a CYP1A1 transzkripcióját, amit a CYP1A1 fehérje fokozott termelődése követ. Ez a folyamat hasonló a CYP1A1 bizonyos poliklórozott bifenilek és dioxinok általi indukciójához. Úgy tűnik, hogy a CYP1A1 aktivitása a bélnyálkahártyában megakadályozza, hogy a bevitt benzopirén nagyobb mennyiségben kerüljön a portális vérbe és a szisztémás keringésbe. A CYP1A1 intestinális, de nem hepatikus expressziója a TOLL-szerű receptor 2-től (TLR2) függ, amely egy eukarióta receptor a bakteriális felszíni struktúrák, például a lipoteichoic sav számára.
Mellett a BaP-ről kimutatták, hogy aktivál egy transzpozont, a LINE1-et az emberben.