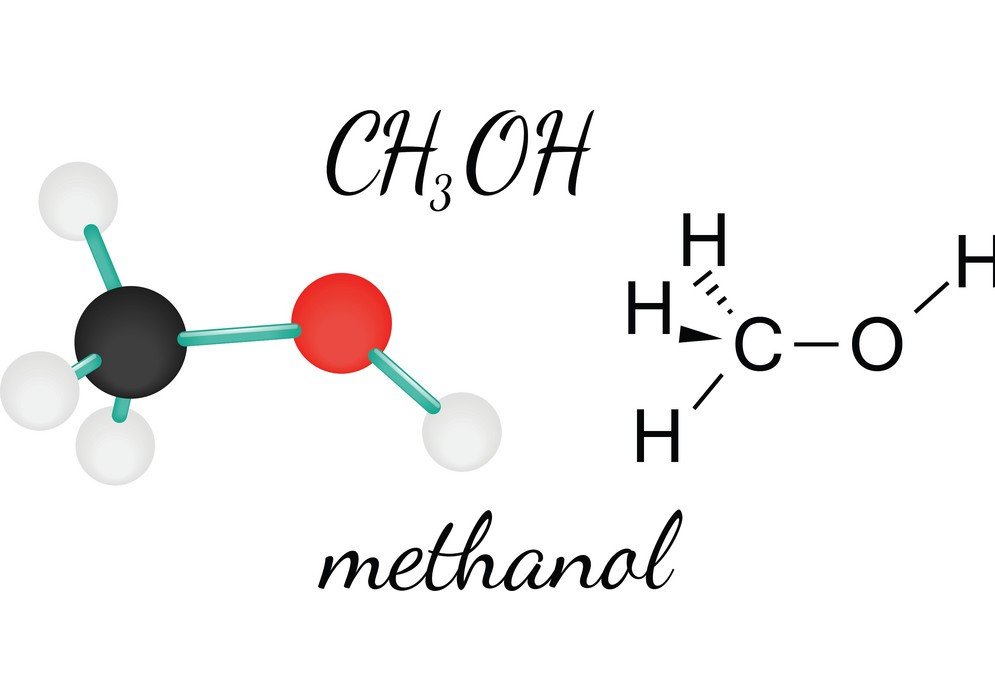
CH3OH vagy metanol egy gyúlékony, színtelen és illékony folyadék, amelynek jellegzetes alkoholos szaga van. A metanol tanulmányozásával megismerhetjük a molekula molekulaformáját, kötésszögét és polaritását. A CH3OH polaritása az egyik legfontosabb jellemző, mivel segít megismerni a vegyület egyéb tulajdonságait, például az oldhatóságát, elektromos töltéseit és még sok mást. A metanol polaritásának megértéséhez először nézzük meg a kötésszögeket és az atomok elrendeződését a CH3OH molekulában.

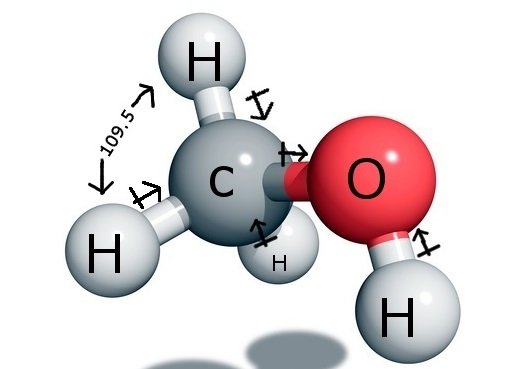
CH3OH kötésszögek
A központi szénatom négy kötést képez a vegyületben, hármat a hidrogénatommal és egyet a hidroxil ( OH) csoporttal. És mivel ez a szénatom sp3 hibridizációval rendelkezik és tetraéder alakot alkot, a kötésszögek 109,5 fokosak a kötőatomjaival.
Az oxigén ezzel szemben egy szigma kötést képez, de két magányos párral rendelkezik, így a kötésszögében a kötéspár-magányos pár taszítóerők miatt hajlás van. Ez 104,5 fokra csökkenti a kötésszöget.
A szén mindhárom hidrogénatomjával 109,5 fokos kötésszöget zár be, a hidroxilcsoporttal pedig 104,5 fokos kötésszöget zár be.
A CH3OH poláris?
Az adott vegyület polaritása a vegyület nettó dipólusmomentumától függ. Ezt a nettó dipólusmomentumot a molekula atomjain lévő elektromos töltések megfigyelésével ismerhetjük meg. Itt a metanolban mind a szén-, mind az oxigénatomok ( amelyek a vegyület geometriai központjának tekinthetők) elektronegatív atomok. Az oxigén azonban elektronegatívabb, mint a szén vagy a hidrogén a vegyületben.
ACH3OH nem lehet nem poláris, mert a metanol molekula atomjai között elektromos töltéskülönbség van. Az oxigénnek nagyobb az elektronsűrűsége a két magányos elektronpárja miatt. Ez az oxigénatom felé mutató nettó dipólust okoz, ami a CH3OH-t polárissá teszi.
Az elektromos töltések mellett a CH3OH molekula aszimmetrikus, ami kiiktatja a nem polaritás lehetőségét. A nem poláros molekula szimmetrikus szerkezetű, mivel a dipólus-dipólus momentum kioltódik. Mivel azonban a metanol alakja elhajlik, ez aszimmetrikus szerkezet kialakulásához vezet, ami azt eredményezi, hogy a nettó elektromos dipólusmomentum negatív vége az oxigénatom felé mutat. A CH3OH tehát poláros molekula.
Most, hogy ismerjük a CH3OH molekula polaritását, nézzük át néhány fizikai tulajdonságát:
- A metanol ( CH3OH) forráspontja 64,7 °C.
- A metanol olvadáspontja -97,6 °C.
- A metanol molekulatömege 32,04 g/mol.
- Poláris oldószer, és faalkoholnak is nevezik, mivel egykor fa desztillációjával állították elő.
- A vegyület szaga az etanolhoz képest az édesebb oldalon van.
A CH3OH felhasználása
- A metanolt szénhidrogének előállítására és más vegyi anyagok, például formaldehid szintézisére is használják.
- Fagyásgátlóként használják csövekben.
- A CH3OH-t alacsony olvadáspontja miatt több országban benzinadalékként is használják.
- A vegyületet üzemanyagként is használják a belső égésű motorokban.
- Néhány gyógyszeripari vállalat tiszta metanolt használ más vegyületek szintéziséhez.
Remélem, ez a cikk segít megérteni a molekula polaritását, fizikai tulajdonságait és felhasználását. A CH3OH poláris molekula, mivel a dipólus-dipólusmomentum nem szűnik meg aszimmetrikus alakja miatt.