Molecular Chaperones
A molekuláris chaperonok a sejtek homeosztázisában kulcsszerepet játszó fehérjék széles köréből állnak, és a fehérjék hajtogatásának segítéséért felelősek, a multimer fehérjék összeszereléséért, a fehérjék transzlokációjáért a sejten belül és a sejten keresztül, a nem kívánt vagy rosszul hajtogatott fehérjék lebontásáért a normális sejtfolyamatok során, valamint a fehérjék stabilizálásáért az aggregáció megakadályozásával és a stresszhelyzetben történő újbóli hajtogatás segítésével (Lindquist, 1986; Lindquist és Craig, 1988).
A chaperon-aktivitással rendelkező fehérjéket kezdetben a hősokk során túlexpresszált fehérjékként fedezték fel, és ezért hősokkfehérjéknek (Hsp) nevezték el őket. A hősokk mellett más stresszfeltételek, például szén-, nitrogén- vagy foszfátlimitáló körülmények is ismertek voltak a molekuláris chaperonok indukálására. Ezeket a fehérjéket molekulatömegük alapján öt nagy családba sorolják: (a) Hsp100 család, (b) Hsp90 család, (c) Hsp70 család, (d) Hsp60 család és (e) kis hősokkfehérje család (sHsp) (Bohen et al., 1995; Schirmer et al., 1996; Bukau és Horwich, 1998). A chaperonokat hatásmódjuk alapján is osztályozzák a következőkre: (a) Foldázok, olyan chaperonok, amelyek ATP felhasználásával segítik a kibomlott fehérjék visszahajtását, pl. Hsp70 és Hsp60, (b) Holdázok, olyan chaperonok, amelyek megkötik a hajtási intermediereket és megakadályozzák az aggregációt, pl. sHsp és Hsp40, és (c) Disaggregázok, olyan chaperonok, amelyek aktívan szétbontják a káros fehérjeaggregátumokat, ami azok kis fragmentumaihoz vezethet, pl. az AAA + ATPáz szupercsalád tagjai és a Hsp100. Ez a fajta besorolás kevés kivétellel igaz (Richter és mtsai., 2010; Kim és mtsai., 2013). A chaperonok által segített fehérje-összehajtás mechanizmusaival kapcsolatos ismereteink nagy része a Hsp60 és Hsp70 chaperoncsaládokkal kapcsolatos munkákból származik. Ez az áttekintés a molekuláris chaperonok Hsp60 osztályára összpontosít, kiemelve az atipikus szerkezetű és funkciójú Hsp60-akat.
Hsp60 család/Chaperoninek
A 60 kDa tömegű chaperonok nagy oligomer gyűrűket alkotnak, és chaperoninokként is említik őket. A chaperoninokat a társ-chaperoninok igénye és a sejtszintű elhelyezkedésük alapján két csoportba sorolhatjuk tovább. Az I. típusú chaperoninok a prokarióták citoplazmájában, az eukarióták mitokondriumában és kloroplasztiszában találhatók. Szükségük van a ko-kaperonin, azaz a Hsp10 segítségére, amely a gyűrű sapkájaként működik. A jól tanulmányozott I. típusú chaperonin az Escherichia coli-ban GroEL-GroES rendszerként ismert. Homológjai a Cpn60/Cpn20 a kloroplasztiszokban és az mtHsp60/mtHsp10 a mitokondriumban (Cheng et al., 1989; Hayer-Hartl et al., 1995; Dickson et al., 2000). A II. típusú chaperoninok az eukarióták citoplazmájában és az archaebakteriális mikroorganizmusokban találhatók. Ezek beépített fedéllel rendelkeznek, ezért működésükhöz nincs szükségük co-chaperoninokra (Ranson és mtsai., 1998). A II. típusú chaperoninokra példa az eukarióta TriC/CCT gépezet (TCP-1 gyűrűkomplex/chaperonin tartalmú TCP-1 komplex), amely 8 alegységből áll, valamint a termoszóma az archaebaktériumokban. Az I. típusú chaperoninokkal ellentétben a II. típusú chaperoninok szubsztrátfüggetlen befogásához a prefoldin és a Hsp70 homológok segítségére van szükség (Iizuka és mtsai., 2004; Cuéllar és mtsai., 2008). Nemrégiben egy harmadik csoportról, az úgynevezett III-as típusú chaperoninokról számoltak be, amelyek szerkezetileg hasonlóak a II-es típusú chaperoninokhoz, de mechanisztikailag és filogenetikailag különböznek mind az I-es, mind a II-es típusú chaperoninoktól, pl. a Carboxydothermus hydrogenoformans chaperonin (Ch-CPN) (Techtmann és Robb, 2010; An et al., 2017; 1. ábra). Az I., II. és III. típusú chaperoninokat I., II. és III. csoportos chaperoninoknak is nevezik.
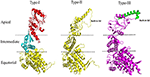
1. ábra. Az I., II. és III. típusú chaperoninok szerkezeti jellemzői. Az I. típusú, a II. típusú és a III. típusú chaperoninok összehasonlító szerkezetelemzése. A szerkezeteket az RCSB-ből töltöttük le PDB-kóddal: 1AON, 3RUW, illetve 5X9U. Az I. típusú chaperonint apikális, intermediális és ekvatoriális doménekre határoltuk, amelyek analóg régióit a II. és III. típusú chaperoninoknál szaggatott vonalakkal ábrázoltuk. A II. típusú chaperonin szerkezetében van egy jellegzetes beépített fedél, amely az I. típusú chaperonin GroES co-chaperonin szerepét tölti be. A III. típusú chaperoninok szerkezetileg hasonlóak a II. típusú chaperoninokhoz a beépített fedővel. A fedél szekvenciája, szerkezete és funkciója azonban különbözik a II-es és a III-as típusú chaperoninokban (An és mtsai., 2017). Az ábra létrehozásához a PyMOL programot (PyMOL Molecular Graphics System, 1.3 verzió) használtuk.
Structure-Function of Type I Chaperonins: Prokaryotic Cytosol
E. coli GroEL-GroES
Structural and functional studies on E.. coli GroEL-ről kimutatták, hogy egy tetradekamer szerkezetet alkot, amely két egymásra rakott heptamer gyűrűből áll, és egy üreget képez, amely a GroES megkötésekor jellegét túlnyomórészt hidrofóbról hidrofilre változtatja. A szubsztrátfehérje hajtogatása ebben az üregben történik a GroES ko-kaperonin segítségével, amely egy sapkaszerű heptamer szerkezetű (Mande és mtsai., 1996). Minden GroES monomer 10 kDa méretű. A GroEL monomer három doménre, nevezetesen apikális, intermedier és ekvatoriális doménre oszlik. Mindegyik monomer ~57 kDa méretű.
A GroEL-GroES által közvetített szubsztrátfehérje hajtogatásra két modellt javasoltak. Aszimmetrikus/szekvenciális modell, amely széles körben elfogadott. Ebben a modellben a GroEL és a GroES sztöchiometrikusan 2:1 arányban van jelen (14:7 alegységarány). A másik, szimmetrikus/szimultán modellként ismert modellben, amely a közelmúltban megfigyelt GroEL-GroES komplexen alapul, a GroEL mindkét gyűrűjét a GroES ko-kaperinon 1:1, azaz (GroEL-GroES)2 sztöchiometriai arányban, 14:14 alegységarányban fedezi (Sameshima et al., 2008; Ye és Lorimer, 2013; Fei et al., 2014). Szimmetrikus (GroEL-GroES)2 komplexet figyeltek meg szubsztrátfehérje jelenlétében és hiányában is, ami egy átmeneti köztes állapotra utal a hajtogatási reakcióciklusban.
Az I. típusú chaperoninok szerkezete-funkciója: endoszimbiontikus organellumok
Kloroplasztisz és mitokondriális chaperoninok
A kloroplasztisz chaperoninokat jellemzően Cpn60 (GroEL homológok) és Cpn10 (GroES homológok) néven említik. A Cpn60 chaperoninok több alegységből állnak, amelyek két rokon, de különböző α és β típusra oszlanak szét (Dickson et al., 2000; Hill és Hemmingsen, 2001). A bakteriális chaperoninokkal ellentétben, amelyek több alegységet tartalmaznak és a homo-oligomerizációt részesítik előnyben (Ojha et al., 2005; Gould et al., 2007), a kloroplasztisz chaperoninok hetero-oligomereket képeznek a kétféle chaperonin α és β alegységével. A heterogenitás a ko-kaperoninok szerkezetében is fennáll. A Cpn10 a standard ko-kaperinoninhoz hasonló, 10 kDa-os alegységekből álló heptamer egygyűrűs szerkezetet alkot (Koumoto és mtsai., 2001; Sharkia és mtsai., 2003). A Cpn20 két Cpn10-szerű polipeptidszekvenciával rendelkezik, amelyek tandemben kapcsolódnak egymáshoz. A tisztított Cpn20 20 kDa alegységet tartalmazó tetramer gyűrűszerű szerkezetben létezik. In vitro teljesen funkcionális, segíti a denaturált fehérje visszaalakítását mind a kloroplasztisz Cpn60, mind az E. coli GroEL jelenlétében (Tang és mtsai., 2006). Sőt, a Chlamydomonas reinhardtii Cpn10 csak a Cpn20 jelenlétében segíti a GroEL-t (Tsai és mtsai., 2012). A kloroplasztisz chaperoninok oligomer összeszerelésében tehát jelentős heterogenitás tapasztalható.
A humán mitokondriális chaperonin, az mtHsp60 ismert, hogy a GroEL-GroES rendszertől eltérő fehérjehajtogató mechanizmussal rendelkezik (mitokondriális fehérje), és egyetlen heptamer gyűrűt igényel a fehérje hajtogató funkciójának ellátásához a társ-chaperoninjával, az mtHsp10-el együtt (Viitanen et al., 1992; Nielsen és Cowan, 1998). A mitokondriális chaperonin kristályszerkezete azonban a társ-chaperoninnal, az mtHsp60-mtHsp10-vel komplexben egy egyedülálló köztes szakaszt ábrázol, ahol az mtHsp60-mtHsp10 egy szimmetrikus, kettős gyűrűs, labdarúgó-szerű szerkezetet alkot, (mtHsp60)14 + 2 (mtHsp10)7 .
I. típusú chaperoninok: nem kanonikus jellemzők
Multiple Chaperonins Across Species
A teljesen szekvenált genomok elemzése arra utal, hogy a genomiális szekvenciaadatok mintegy 30%-a rendelkezik a chaperoninokat kódoló génszekvenciák több példányával (Lund, 2009; Kumar et al., 2015). Ezeknek a többszörös chaperoninoknak a kiterjedt filogenetikai elemzésen alapuló eloszlása arra utal, hogy a chaperonin gének többszörös kópiái túlnyomórészt öt törzsben fordulnak elő, nevezetesen: (a) Actinobacteria törzs, (b) Firmicutes törzs, (c) Cyanobacteria törzs, (d) Chlamydia törzs, és (e) α-Proteobacteria törzs (Kumar et al., 2015).
Actinobaktériumok
Actinobaktériumok Gram-pozitív baktériumok, genomjukban magas G + C tartalommal rendelkeznek, pl. Mycobacterium tuberculosis, Mycobacterium leprae és Bifidobacterium longum. Ezek a fajok jellemzően a chaperonin gének két példányával rendelkeznek, az egyik példány egy operonszerű struktúrában van jelen. A Cpn60 másik kópiája független génként létezik a Cpn10 gén jelenléte nélkül (Rinke de Wit és mtsai., 1992). Az aktinobakteriális chaperonin gének a HrcA transzkripciós faktor szabályozási kontrollja alatt állnak, amely az upstream CIRCE (controlling inverted repeat of chaperone expression) szekvenciához kötődik (Duchêne et al., 1994; Grandvalet et al., 1998). Bizonyos esetekben a szabályozást a HspR transzkripciós faktor az upstream HAIR (HspR Associated Inverted Repeat) szekvenciához való kötődése közvetíti (Barreiro et al., 2004).
Firmicutes
A firmicutes Gram-pozitív baktériumok, genomjukban alacsony G + C tartalommal rendelkeznek, pl. Staphylococcus aureus, Desulfitobacterium dehalogenans és C. hydrogenoformans. A Firmicutes ismert, hogy rendelkeznek mind prokarióta-szerű I. típusú chaperonin génekkel, mind pedig archael-szerű, III. típusú chaperonin kategóriába sorolt chaperonin génekkel. Az I. típusú chaperoninok operonikus elrendeződésben helyezkednek el a co-chaperoninnal, míg a III. típusú chaperonin gén a dnaK operonban található. Mind az I., mind a III. típusú chaperonin géneket a HrcA transzkripciós faktor szabályozza (Techtmann és Robb, 2010).
Chlamydiae
A chlamydiae többnyire obligát intracelluláris patogének, pl. Chlamydia trachomatis, Chlamydia pneumonia és Chlamydia psittaci. A Chlamydia-fajok a chaperonin gének három példányával rendelkeznek (McNally és Fares, 2007). Az operonikus elrendeződés azt sugallja, hogy a chaperonin géneknek csak egy példánya létezik a társ-chaperoninjával együtt. A többi chaperonin gén azonban külön-külön található. A chlamydia chaperonin gének szabályozása összetett. A chaperonin gén első példányát hősokk indukálja, és a HrcA-CIRCE rendszer szabályozza. A chaperonin gén második kópiája akkor indukálódik, ha a chlamydia monocitákban vagy makrofágokban van (Kol et al., 1999), a chaperonin gén harmadik kópiája pedig akkor, ha a chlamydia Hep-2 sejtekben van (Gérard et al., 2004). A chaperonin gének ilyen típusú expressziója és szabályozása életciklus-specifikus mintázatra és független funkcionális szerepre utal.
α-proteobaktériumok
A rhizobiumok, amelyek az α-proteobaktériumok osztályába tartoznak, a hüvelyes növényekkel társulva a gyökérgümőkben élő, nitrogénkötésben részt vevő szimbiózisok, pl. Bradyrhizobium japonicum, Rhizobium leguminosarum. A Rhizobiumok tartalmazzák a legtöbb chaperonin-kópiát. A B. japonicum a chaperonin gének hét példányával rendelkezik (Fischer és mtsai., 1993). A R. leguminosarum egy jól jellemzett organizmus, amely a chaperonin gének három kópiájával rendelkezik. A génelrendeződés mindezen organizmusokban arra utal, hogy a chaperonin gén három kópiája külön operont alkot a megfelelő co-chaperonin génekkel (George és mtsai., 2004). Az egyik chaperonin-operon azon a genomszigeten található, amely a nitrogénkötésben részt vevő géneket tartalmazza. Ezt a nitrogénkötő géneket szabályozó NiF faktorok szabályozzák (Ogawa és Long, 1995). A chaperonin gén második kópiája nem jól tanulmányozott, és ismert, hogy számos modell szubsztrátfehérje chaperonáló tulajdonságában vesz részt (George és mtsai., 2004).
Cyanobaktériumok
Ayanobaktériumok nagyrészt fotoszintetizáló baktériumok, pl. Synechococcus platensis, Prochlorococcus marinus és Anabaena variabilis. A cianobaktériumfajok genomszekvenciáinak mintegy 90%-a a chaperonin gének két példányát tartalmazza, amelyek közül az egyik egy operonba rendeződik, míg a másik chaperonin gén külön kódolt. Egyes cianobaktériumfajok a chaperonin gének három példányát tartalmazzák, ahol a chaperonin gének közül kettő a megfelelő társ-chaperoninnal együtt helyezkedik el az operonban, míg a chaperonin gének harmadik példánya független (Lund, 2009; Kumar et al., 2015). Az operonikus elrendeződésben a ko-kaperoninnal együtt létező chaperonin gének esszenciális gének, míg a ko-kaperonintól függetlenül létező gének nem esszenciálisak (Sato és mtsai., 2008). A két cianobakteriális chaperonin gén pozitívan az RpoH és negatívan a HrcA fehérjék által szabályozott. Hősokk hatására az egyik chaperonin gén gyorsan, míg a másik chaperonin gén fokozatosan indukálódik (Kojima és Nakamoto, 2007; Rajaram és Apte, 2010). A hősokk hatására fokozatosan indukálódó chaperonin génről ismert, hogy közvetlenül részt vesz a fotoszintézisben.
Evolúciós vonal
Amint egyre több genomszekvencia válik elérhetővé, a chaperonin gének elemzése arra utal, hogy a chaperonin gének több példányának eloszlása és gyakorisága a különböző filákban és organizmusokban folyamatosan növekszik (Lund, 2009; Kumar et al., 2015). Annak megértése érdekében, hogy a chaperonin gének többszörös előfordulásának oka vagy horizontális géntranszfer vagy génduplikáció, a GroEL fehérjék fajonkénti filogenetikai elemzését végeztük el, amely kimutatta, hogy a GroEL gének többszörös kópiáinak létezésének okai nem egységesek. Néhány esetben génduplikációs eseményt evolúciós szelekció követett, mint például a myxobakteriális GroEL-ek, a mykobakteriális GroEL első és második példánya és néhány rizobium GroEL-je esetében. A mycobakteriális GroEL harmadik homológja, néhány rhizobialis GroEL és metanoszarkinális GroEL esetében horizontális géntranszfer történt (Goyal et al., 2006; Kumar et al., 2015).
Laborunkban korábban azt javasoltuk, hogy a mycobakteriális GroEL duplikálódott és különböző szelekciós nyomáson ment keresztül, hogy megkülönböztető strukturális és funkcionális szerepet töltsön be az evolúció során (Goyal et al., 2006). A rekombinánsan tisztított M. tuberculosis GroEL-eken végzett biofizikai és biokémiai vizsgálatok kimutatták, hogy a GroEL1 és GroEL2 alacsonyabb oligomerként létezik, szemben az E. coli tetradekamer GroEL szerkezetével (Qamra és mtsai., 2004). Az M. tuberculosis GroEL2 kristályszerkezete dimer formában kiemelte a határfelületi régióban található különböző maradékok jelenlétét, amelyek valószínűleg felelősek az oligomerizáció megváltozásáért (2. ábra; Qamra és Mande, 2004). Az M. tuberculosis GroEL1-en végzett génkeverési és doméncsere-vizsgálatok arra utalnak, hogy az ekvatoriális domén felelős a sikertelen oligomerizációért. Az apikális domén ellenáll a nagy inszercióknak és delécióknak (Kumar és mtsai., 2009). Ezzel nagyjából egy időben kimutatták, hogy a GroEL1 úgy fejlődött, hogy promiszkuzív módon köt nukleinsavakat (Basu et al., 2009), és az oligomerizációt szerin-maradékok foszforilációja segíti elő (Kumar et al., 2009). Mivel a GroEL2 köztudottan esszenciális chaperonin a Mycobacteriumokban, míg a GroEL1 oligomer összeszerelődése poszttranszlációsan szabályozott, arról számoltak be, hogy a tetradekamer összeszerelődés és a pontos domének közötti kommunikáció előfeltétele a chaperonin aktivitásnak (Chilukoti et al., 2015).
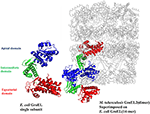
2. ábra. Az M. tuberculosis GroEL2 kristályszerkezete az E. coli GroEL-ES szerkezetére szuperponálva. Az M. tuberculosis GroEL2 (PDB ID:1SJP) szerkezete alacsonyabb oligomer állapotot (dimer) mutat. Kékkel, zölddel és pirossal színezve az apikális, az intermediális és az ekvatoriális domén. A szürke színnel ábrázolt E. coli GroEL-hez (PDB ID: 1AON) képest az M. tuberculosis GroEL2 szerkezetében az alegységek közötti kölcsönhatás az apikális doménen keresztül valósul meg, míg az E. coli GroEL szerkezetében az alegységek közötti kölcsönhatás az ekvatoriális doménen keresztül. Az M. tuberculosis GroEL2 egyetlen alegysége az aszimmetrikus modellt képviselő E. coli GroES kötött GroEL gyűrűhöz igazodik. A GroES szerkezetet az egyszerűség kedvéért eltávolítottuk. Az E. coli GroEL egyetlen alegysége az M. tuberculosis GroEL2-vel összehasonlító elemzés céljából azonos színkódolású doménekkel van ábrázolva. Az ábra létrehozásához a PyMOL programot (PyMOL Molecular Graphics System, 1.3 verzió) használtuk.
Funkcionális sokféleség
Nagyon fontos megvizsgálni, hogy a chaperoninok több példányának jelenléte felelős-e a kanonikus chaperoninokként való viselkedésért, vagy pedig új funkciók betöltése érdekében divergáltak. Az is fontos, hogy ezek a többszörös chaperoninok közös szubsztrátokon vagy a szubsztrátok különböző poolján hatnak-e. A GroEL-ek nagymértékben konzerváltak a különböző fajokban, és kimutatták, hogy más baktériumokból származó chaperoninok homológjai képesek működni az E. coli-ban, ami a szubsztrátfehérjék átfedésére és a GroEL funkció közös mechanizmusára utal. A szubsztrátfehérjék GroEL-lel való kölcsönhatásai hidrofób természetűek, így a konformációs változás által közvetített, az apikális és az ekvatoriális domének expozíciója az üregben kulcsszerepet játszik a szubsztrátfelismerésben és segíti a fehérje hajtogatást. A szubsztrátfehérjék GroEL-hez való kötődése a szekvencia-hasonlóságot nem mutató fehérjék α/β doméneken keresztül történik (Kerner és mtsai., 2005; Kumar és Mande, 2011), és további vizsgálatok szerint a GroEL szelektíven inkább globuláris szubsztrátokat köt, mint nyújtott polipeptideket (Robinson és mtsai., 1994; Goldberg és mtsai., 1997). A chaperoninok egy szervezetben található többszörös kópiáiról is beszámoltak, amelyek új funkciók betöltésére fejlődtek ki. Egy rovarszimbiontában, a Xenorhabdus nematophila-ban található GroEL homológról kimutatták, hogy mérgező a rovarokra, amit az alfa-kitinhez való kötődés közvetít. E GroEL-homológok mutációs elemzése arra utal, hogy az ilyen jellegű aktivitáshoz kritikus aminosav különbözik az esszenciális chaperonintól (Joshi és mtsai., 2008). M. tuberculosisban a GroEL2 generalista chaperoninként működik (Hu és mtsai., 2008), míg a GroEL1-ről azt jelentették, hogy nukleoidokhoz kapcsolódik (Basu és mtsai., 2009). Így nyilvánvaló, hogy a groEL gének génduplikációja a chaperoninok funkcionális diverzitásához és/vagy az intracelluláris fehérje folding eltérő szubsztrát spektrumához vezetett.
Post-transzlációs módosítások/Biofilmképződés
A fehérjék poszt-transzlációs módosításait az organizmusok a fiziológiai folyamataik modulálására és a folyamatosan változó környezethez való alkalmazkodásra használják (Bernal et al., 2014). A chaperoninekről beszámoltak, hogy bizonyos organizmusokban poszttranszlációsan módosulnak, és ez a módosítás funkciójuk elnyerésével/vesztésével jár. Például az M. tuberculosis sejtlizátum frakcionálása kimutatta, hogy a GroEL1 tetradekamer formája csak szerin-maradékokon történő foszforiláció után érhető el (Kumar és mtsai., 2009). Hasonlóképpen egy másik jelentésben kimutatták, hogy a foszforiláció treonin-maradványokon történik (Canova és mtsai., 2009). Mindkét megfigyelés arra utal, hogy a GroEL1 oligomerizációja poszttranszlációs módosítás eredménye.
Sok kórokozó kikerüli a veleszületett immunválaszt és antibiotikumokkal szemben rezisztenssé válik azáltal, hogy biofilmet képez a hámsejteken (Hall-Stoodley és Stoodley, 2005). A GroEL biofilmképzésben betöltött szerepét néhány organizmusban tisztázták. Például a M. smegmatis GroEL1 mutánsa nem képes biofilmet képezni. Mechanisztikus vizsgálatok kimutatták, hogy a M. smegmatis GroEL1 kölcsönhatásba lép a KasA enzimmel, amely kritikus a biofilmképzésben részt vevő mikolsav bioszintézisben (Ojha és mtsai., 2005). Érdekes módon nemrégiben arról számoltak be, hogy a B. anthracis patogén törzsben a GroEL foszforilálódik, és ezáltal modulálja a biofilmképződést. Ezek az eredmények rávilágítanak arra, hogy a GroEL foszforilációjának funkcionális következményei vannak (Arora és mtsai., 2017). Az acetiláció egy másik poszttranszlációs módosítás, amely az E. coli és M. tuberculosis chaperoninokhoz kapcsolódik, azonban ennek a módosításnak még nem tulajdonítottak funkcionális szerepet (Liu és mtsai., 2014). Hasonlóképpen, a mitokondriális co-chaperonin (mtHsp10) acetil-modifikáción megy keresztül és szabályozza a mitokondriális fehérjék hajtogatását tápanyagfelesleg esetén (Lu et al., 2015).
C-terminális változatosság
Változatos vizsgálatok kiemelik a GroEL C-terminális maradékainak fontosságát a chaperonin általános működésében (Tang et al., 2006; Chen et al., 2013). A chaperoninok többszörös kópiájára vonatkozó esetekben a C-terminális maradékok eltérő mintázattal rendelkeznek. Míg a GroEL (E. coliból származó) C-terminálisa egy 13 maradékból álló motívummal (GGM)4M rendelkezik, addig más organizmusokból származó GroEL homológok (amelyek több példányban tartalmaznak chaperoninokat) eltérő C-terminális motívumokkal rendelkeznek, mint például:
a) Histidinben gazdag C-terminális, pl. Mycobacteria (Colaco és MacDougall, 2014)
b) Mintázat nélküli C-terminális, pl., Rhizobia (George et al., 2004)
c) Hasonló (GGM)4M ismétlődések, pl. Myxobacteria (Wang et al., 2013)
d) GGM-szerű farok hiánya, pl. Methanosarcina (Figueiredo et al., 2004)
Egyértelműen látható, hogy a különböző szervezetek számos chaperonin paralógja rendelkezik GGM-szerű C-terminussal. A genomiális szerveződés széles skálája figyelhető meg ezekben a chaperoninokban. Ezenkívül különbségek mutatkoznak a társ-kaperoninnal való koexpressziójukban és a funkciójuk esszencialitásában is. Így ezek a paralógok zavarba ejtő módon vagy esszenciálisak, vagy nem esszenciálisak, társ-kaperoninjukkal együtt expresszálódnak, vagy nem expresszálódnak együtt, és valószínűleg házvezető chaperoninokként működnek. Másrészt a GGM-szerű C-terminussal nem rendelkező chaperoninok valószínűleg új funkciók betöltésére fejlődtek ki (Ojha et al., 2005; Wang et al., 2013; 3. ábra).

3. ábra. Többszörös chaperoninok baktériumokban, amelyek C-terminális diverzitást mutatnak. A reprezentatív bakteriális GroEL homológok C-terminális régióit kiemelő szekvenciaillesztés az E. coli GroEL-lel. A különböző baktériumokból kiválasztott több GroEL utolsó C-terminális maradékai eltérést mutatnak az E. coli GroEL kanonikus (GGM)4M motívumától, amelyet a szaggatott piros doboz mutat. A szekvenciákat a www.uniprot.org oldalról szereztük be, és a MEGA6-ban a MUSCLE algoritmus (www.megasoftware.net) segítségével illesztettük egymáshoz. Az összehangolt szekvenciák formázása a Jalview alignment viewer (www.jalview.org) segítségével történt. Az igazításban szereplő rezidensek a Jalview alapértelmezett Clustal színsémáját követik.
Következtető megjegyzések
Az I. típusú chaperoninok az intracelluláris fehérje hajtogatásban betöltött szerepük miatt fontosak. A GroEL-GroES rendszer a baktériumokban a citoszolikus fehérjék mintegy 10-15%-ának hajtogatását segíti. A GroEL különböző struktúrái, amelyeket apo-formában, nukleotidhoz kötött formában, valamint a GroES ko-kaperoninnal alkotott komplexben oldottak meg, megpróbálják megmagyarázni e chaperoninek fehérje hajtogatásban betöltött szerepét (Saibil és mtsai., 2013). A többféle chaperonin létezése és változatos funkciókban betöltött szerepük evolúciós nyomásra utal a különböző környezeti feltételekhez való alkalmazkodás irányába. Az M. tuberculosis GroEL2 szerkezete kiemeli az alacsonyabb oligomer állapotot és az exponáltabb hidrofób felületeket, valószínűleg a szubsztrátkészlet növelése és az energiakonzerválás érdekében (Qamra és Mande, 2004; Qamra és mtsai., 2004; Kumar és Mande, 2011). A hisztidinben gazdag C-terminálisok több chaperoninban való jelenlétének köszönhetően azt javasolták, hogy ezek alternatív biológiai funkciókban segítsenek. A M. smegmatis GroEL1 vashoz való kötődése segíthet a biofilmképzésben (Ojha és mtsai., 2005). A M. tuberculosis groEL1 knockout törzs túlélési hibája alacsony levegőztetési körülmények között segíthet az oxigénérzékelésben a fémekhez való közvetlen kötődéssel, vagy segíthet bizonyos metalloproteinek hajtogatásában (Sharma és mtsai., 2016). Más homológ chaperonin fehérjék szerkezete valószínűleg választ fog adni a chaperonin homológok új funkcióival kapcsolatos számtalan kérdésre.
Author Contributions
A felsorolt szerzők mindegyike érdemben, közvetlenül és intellektuálisan hozzájárult a munkához, és jóváhagyta azt a publikáláshoz.
Kérdések összeférhetetlenségi nyilatkozata
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönet
MYA köszöni a Senior Research Fellowship pénzügyi támogatását a Department of Biotechnology (DBT), Ministry of Science and Technology, Government of India. A szerzők hálásan köszönik a DBT BT/PR15450/COE/34/46/2016 és BT/PR3260/BRB/10/967/2011 támogatásai révén az SCM laboratóriumban végzett munkához nyújtott pénzügyi támogatást.
An, Y. J., Rowland, S. E., Na, J. H., Spigolon, D., Hong, S. K., Yoon, Y. J., et al. (2017). Egy termofil baktériumból származó archaeal-szerű chaperonin strukturális és mechanisztikus jellemzése. Nat. Commun. 8:827. doi: 10.1038/s41467-017-00980-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Arora, G., Sajid, A., Virmani, R., Singhal, A., Kumar, C. M. S., Dhasmana, N., et al. (2017). A GroEL Ser/Thr protein kináz PrkC által közvetített szabályozása kritikus a Bacillus anthracis biofilmképződéséhez. NPJ Biofilms Microbiomes 3:7. doi: 10.1038/s41522-017-0015-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Barreiro, C., González-Lavado, E., Pátek, M., and Martín, J. F. (2004). A groES-groEL1, groEL2 és dnaK gének transzkripciós elemzése Corynebacterium glutamicumban: a hősokk indukálta promóterek jellemzése. J. Bacteriol. 186, 4813-4817. doi: 10.1128/JB.186.14.4813-4817.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Basu, D., Khare, G., Singh, S., Tyagi, A., Khosla, S., and Mande, S. C. (2009). A Mycobacterium tuberculosis új nukleoid-asszociált fehérjéje a GroEL szekvencia-homológja. Nucleic Acids Res. 37, 4944-4954. doi: 10.1093/nar/gkp502
PubMed Abstract | CrossRef Full Text | Google Scholar
Bernal, V., Castaño-Cerezo, S., Gallego-Jara, J., Écija-Conesa, A., de Diego, T., Iborra, J. L., et al. (2014). A bakteriális fiziológia szabályozása a fehérjék lizin acetilációjával. N. Biotechnol. 31, 586-595. doi: 10.1016/j.nbt.2014.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohen, S. P., Kralli, A., and Yamamoto, K. R. (1995). Hold ’em and fold’ em: chaperonok és jelátvitel. Science 268, 1303-1304.
PubMed Abstract | Google Scholar
Bukau, B., and Horwich, A. L. (1998). A Hsp70 és Hsp60 chaperon gépek. Cell 92, 351-366. doi: 10.1016/S0092-8674(00)80928-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Canova, M. J., Kremer, L., and Molle, V. (2009). A Mycobacterium tuberculosis GroEL1 chaperonja a Ser/Thr protein kinázok szubsztrátja. J. Bacteriol. 191, 2876-2883. doi: 10.1128/JB.01569-08
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, D. H., Madan, D., Weaver, J., Lin, Z., Schröder, G. F., Chiu, W., et al. (2013). A GroEL/ES vizualizálása egy hajtogató fehérje kapszulázása közben. Cell 153, 1354-1365. doi: 10.1016/j.cell.2013.04.052
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, M. Y., Hartl, F. U., Martin, J., Pollock, R. A., Kalousek, F., Neupert, W., et al. (1989). A mitokondriális hősokkfehérje hsp60 nélkülözhetetlen az élesztő mitokondriumokba importált fehérjék összeszereléséhez. Nature 337, 620-625. doi: 10.1038/337620a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Chilukoti, N., Kumar, C. M., and Mande, S. C. (2015). A Mycobacterium tuberculosis GroEL2-je feltárja a szerkezeti hajlékonyság fontosságát a chaperonin funkcióban. J. Bacteriol. 198, 486-497. doi: 10.1128/JB.00844-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Colaco, C. A., and MacDougall, A. (2014). Mikobakteriális chaperoninok: a farok csóválja a kutyát. FEMS Microbiol. Lett. 350, 20-24. doi: 10.1111/1574-6968.12276
PubMed Abstract | CrossRef Full Text | Google Scholar
Cuéllar, J., Martín-Benito, J., Scheres, S. H., Sousa, R., Moro, F., López-Viñas, E., et al. (2008). A CCT-Hsc70 NBD szerkezete a Hsp70 szubsztrátoknak a chaperoninhoz való eljuttatásának mechanizmusára utal. Nat. Struct. Mol. Biol. 15, 858-864. doi: 10.1038/nsmb.1464
PubMed Abstract | CrossRef Full Text | Google Scholar
Dickson, R., Weiss, C., Howard, R. J., Alldrick, S. P., Ellis, R. J., Lorimer, G., et al. (2000). A fehérje hajtogatásban aktív magasabb növényi kloroplasztisz chaperonin 60 tetrakamerák rekonstrukciója. J. Biol. Chem. 275, 11829-11835. doi: 10.1074/jbc.275.16.11829
PubMed Abstract | CrossRef Full Text | Google Scholar
Duchêne, A. M., Thompson, C. J., and Mazodier, P. (1994). A groEL gének transzkripciós elemzése a Streptomyces coelicolor A3(2)-ban. Mol. Gen. Genet. 245, 61-68. doi: 10.1007/BF00279751
PubMed Abstract | CrossRef Full Text | Google Scholar
Fei, X., Ye, X., LaRonde, N. A., and Lorimer, G. H. (2014). A GroEL kialakulása és struktúrái:GroES2 chaperonin footballs, a fehérje hajtogatásának funkcionális formája. Proc. Natl. Acad. Sci. U.S.A. 111, 12775-12780. doi: 10.1073/pnas.1412922111
PubMed Abstract | Ref Full Text | Google Scholar
Figueiredo, L., Klunker, D., Ang, D., Naylor, D. J., Kerner, M. J., Georgopoulos, C., et al. (2004). Egy archeális GroEL/GroES chaperonin rendszer funkcionális jellemzése: a szubsztrátkapszulázás jelentősége. J. Biol. Chem. 279, 1090-1099. doi: 10.1074/jbc.M310914200
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischer, H. M., Babst, M., Kaspar, T., Acuña, G., Arigoni, F., and Hennecke, H. (1993). Egy gro-ESL-szerű chaperonin multigén család egyik tagja Bradyrhizobium japonicumban a szimbiotikus nitrogénkötő génekkel együtt szabályozott. EMBO J. 12, 2901-2912.
PubMed Abstract | Google Scholar
George, R., Kelly, S. M., Price, N. C., Erbse, A., Fisher, M., and Lund, P. A. (2004). A Rhizobium leguminosarum három GroEL homológja eltérő in vitro tulajdonságokkal rendelkezik. Biochem. Biophys. Res. Commun. 324, 822-828. doi: 10.1016/j.bbrc.2004.09.140
PubMed Abstract | CrossRef Full Text | Google Scholar
Gérard, H. C., Whittum-Hudson, J. A., Schumacher, H. R., and Hudson, A. P. (2004). Három Chlamydia trachomatis hsp60-kódoló gén differenciális expressziója aktív vs. tartós fertőzésekben. Microb. Pathog. 36, 35-39. doi: 10.1016/j.micpath.2003.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldberg, M. S., Zhang, J., Sondek, S., Matthews, C. R., Fox, R. O., and Horwich, A. L. (1997). A GroEL nevű chaperoninhoz kötött fehérje-összehajló intermedier natív-szerű szerkezete. Proc. Natl. Acad. Sci. U.S.A. 94, 1080-1085. doi: 10.1073/pnas.94.4.1080
PubMed Abstract | CrossRef Full Text | Google Scholar
Gould, P. S., Burgar, H. R., and Lund, P. A. (2007). A Rhizobium leguminosarum homológ cpn60 gének funkcionálisan nem egyenértékűek. Cell Stress Chaperones 12, 123-131. doi: 10.1379/CSC-227R.1
CrossRef Full Text | Google Scholar
Goyal, K., Qamra, R., and Mande, S. C. (2006). Többszörös génduplikáció és gyors evolúció a groEL génben: funkcionális következmények. J. Mol. Evol. 63, 781-787. doi: 10.1007/s00239-006-0037-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Grandvalet, C., Rapoport, G., and Mazodier, P. (1998). hrcA, amely a Streptomyces albus G-ben a groEL gének represszorát kódolja, egy második dnaJ génhez kapcsolódik. J. Bacteriol. 180, 5129-5134.
Google Scholar
Hall-Stoodley, L., and Stoodley, P. (2005). Biofilmképződés és -szóródás, valamint az emberi kórokozók átvitele. Trends Microbiol. 13, 7-10. doi: 10.1016/j.tim.2004.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Hayer-Hartl, M. K., Martin, J., and Hartl, F. U. (1995). A GroEL és GroES aszimmetrikus kölcsönhatása az asszisztált fehérjehajtogatás ATPáz ciklusában. Science 269, 836-841. doi: 10.1126/science.7638601
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, J. E., and Hemmingsen, S. M. (2001). Arabidopsis thaliana I. és II. típusú chaperoninok. Cell Stress Chaperones 6, 190-200. doi: 10.1379/1466-1268(2001)006<0190:ATTIAI>2.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Hu, Y., Henderson, B., Lund, P. A., Tormay, P., Ahmed, M. T., Gurcha, S. S., et al. (2008). Egy Mycobacterium tuberculosis mutáns, amelyből hiányzik a groEL homológ cpn60.1, életképes, de nem vált ki gyulladásos választ a fertőzés állati modelljeiben. Infect. Immun. 76, 1535-1546. doi: 10.1128/IAI.01078-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Iizuka, R., So, S., Inobe, T., Yoshida, T., Zako, T., Kuwajima, K., et al. (2004). A helikális kiemelkedés szerepe az archeális II. csoportú chaperonin konformációváltozásában és molekuláris chaperon aktivitásában. J. Biol. Chem. 279, 18834-18839. doi: 10.1074/jbc.M400839200
PubMed Abstract | CrossRef Full Text | Google Scholar
Joshi, M. C., Sharma, A., Kant, S., Birah, A., Gupta, G. P., Khan, S. R., et al. (2008). Egy rovarölő GroEL fehérje kitinkötő aktivitással a Xenorhabdus nematophilából. J. Biol. Chem. 283, 28287-28296. doi: 10.1074/jbc.M804416200
PubMed Abstract | CrossRef Full Text | Google Scholar
Kerner, M. J., Naylor, D. J., Ishihama, Y., Maier, T., Chang, H. C., Stines, A. P., et al. (2005). A chaperonin-függő fehérje-összehajtás proteom-szintű elemzése Escherichia coli-ban. Cell 122, 209-220. doi: 10.1016/j.cell.2005.05.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, Y. E., Hipp, M. S., Bracher, A., Hayer-Hartl, M., and Hartl, F. U. (2013). Molekuláris chaperonok funkciói a fehérje hajtogatásban és a proteosztázisban. Annu. Rev. Biochem. 82, 323-355. doi: 10.1146/annurev-biochem-060208-092442
PubMed Abstract | CrossRef Full Text | Google Scholar
Kojima, K., and Nakamoto, H. (2007). A groE transzkripció újszerű fény- és hőérzékeny szabályozása HrcA vagy CIRCE hiányában cianobaktériumokban. FEBS Lett. 581, 1871-1880. doi: 10.1016/j.febslet.2007.03.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Kol, A., Bourcier, T., Lichtman, A. H., and Libby, P. (1999). A Chlamydia és a humán hősokkfehérje 60s aktiválja az emberi érrendszeri endothelt, a simaizomsejteket és a makrofágokat. J. Clin. Invest. 103, 571-577. doi: 10.1172/JCI5310
PubMed Abstract | CrossRef Full Text | Google Scholar
Koumoto, Y., Shimada, T., Kondo, M., Hara-Nishimura, I., and Nishimura, M. (2001). Kloroplasztiszok egy új Cpn10 mellett a Cpn20 mint co-chaperoninok az Arabidopsis thaliana-ban. J. Biol. Chem. 276, 29688-29694. doi: 10.1074/jbc.M102330200
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumar, C. M., Khare, G., Srikanth, C. V., Tyagi, A. K., Sardesai, A. A., and Mande, S. C. (2009). A mikobakteriális GroEL könnyített oligomerizációja: bizonyíték a foszforiláció által közvetített oligomerizációra. J. Bacteriol. 191, 6525-6538. doi: 10.1128/JB.00652-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumar, S., and Mande, S. (2011). Fehérje chaperonok és nem fehérje szubsztrátok: a GroEL szubsztrát promiszkuitásáról. Curr. Sci. 100, 1646-1653.
Google Scholar
Kumar, C. M., Mande, S. C., and Mahajan, G. (2015). Többszörös chaperoninok baktériumokban-új funkciók és nem kanonikus viselkedés. Cell Stress Chaperones 20, 555-574. doi: 10.1007/s12192-015-0598-8
CrossRef Full Text | Google Scholar
Lindquist, S. (1986). A hősokkválasz. Annu. Rev. Biochem. 55, 1151-1191. doi: 10.1146/annurev.bi.55.070186.005443
PubMed Abstract | CrossRef Full Text | Google Scholar
Lindquist, S., and Craig, E. A. (1988). A hősokkfehérjék. Annu. Rev. Genet. 22, 631-677. doi: 10.1146/annurev.ge.22.120188.003215
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, F., Yang, M., Wang, X., Yang, S., Gu, J., Zhou, J., et al. (2014). Az acetilom-elemzés a lizin acetiláció változatos funkcióit tárja fel a Mycobacterium tuberculosisban. Mol. Cell. Proteomics 13, 3352-3366. doi: 10.1074/mcp.M114.041962
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, Z., Chen, Y., Aponte, A. M., Battaglia, V., Gucek, M., and Sack, M. N. (2015). Az elhúzódó koplalás azonosítja a 10-es hősokkfehérjét, mint Sirtuin 3 szubsztrátot, amely egy új mechanizmust tár fel, amely a mitokondriális fehérjék acetilációját összekapcsolja a zsírsav-oxidációs enzim hajtogatásával és működésével. J. Biol. Chem. 290, 2466-2476. doi: 10.1074/jbc.M114.606228
PubMed Abstract | CrossRef Full Text | Google Scholar
Lund, P. A. (2009). Többszörös chaperoninok baktériumokban – miért olyan sok? FEMS Microbiol. Rev. 33, 785-800. doi: 10.1111/j.1574-6976.2009.00178.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Mande, S. C., Mehra, V., Bloom, B. R., and Hol, W. G. (1996). A Mycobacterium leprae hősokkfehérje chaperonin-10 szerkezete. Science 271, 203-207. doi: 10.1126/science.271.5246.203
PubMed Abstract | CrossRef Full Text | Google Scholar
McNally, D., and Fares, M. A. (2007). A Chlamydiae több groEL gén paralógja közötti funkcionális eltérések in silico azonosítása. BMC Evol. Biol. 7:81. doi: 10.1186/1471-2148-7-81
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, K. L., and Cowan, N. J. (1998). Egyetlen gyűrű elegendő a produktív chaperonin-mediált hajtogatáshoz in vivo. Mol. Cell 2, 93-99. doi: 10.1016/S1097-2765(00)80117-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Ogawa, J., and Long, S. R. (1995). A Rhizobium meliloti groELc locus szükséges a korai nod gének NodD transzkripciós aktivátor általi szabályozásához. Genes Dev. 9, 714-729. doi: 10.1101/gad.9.6.714
PubMed Abstract | CrossRef Full Text | Google Scholar
Ojha, A., Anand, M., Bhatt, A., Kremer, L., Jacobs, W. R., and Hatfull, G. F. (2005). GroEL1: egy dedikált chaperon, amely részt vesz a mikolsav bioszintézisben a biofilmképződés során a mikobaktériumokban. Cell 123, 861-873. doi: 10.1016/j.cell.2005.09.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Qamra, R., and Mande, S. C. (2004). A Mycobacterium tuberculosis 65 kilodaltonos hősokkfehérjének, a chaperonin 60.2-nek kristályszerkezete. J. Bacteriol. 186, 8105-8113. doi: 10.1128/JB.186.23.8105-8113.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Qamra, R., Srinivas, V., and Mande, S. C. (2004). A Mycobacterium tuberculosis GroEL homológjai szokatlanul alacsonyabb oligomerként léteznek, és megőrzik a szubsztrátfehérjék aggregációjának elnyomására való képességüket. J. Mol. Biol. 342, 605-617. doi: 10.1016/j.jmb.2004.07.066
PubMed Abstract | CrossRef Full Text | Google Scholar
Rajaram, H., and Apte, S. K. (2010). A groESL operon expressziójának differenciális szabályozása hőre és fényre adott válaszként Anabaena-ban. Arch. Microbiol. 192, 729-738. doi: 10.1007/s00203-010-0601-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Ranson, N. A., White, H. E., and Saibil, H. R. (1998). Chaperoninok. Biochem. J. 333(Pt 2), 233-242. doi: 10.1042/bj3330233
PubMed Abstract | CrossRef Full Text | Google Scholar
Richter, K., Haslbeck, M., and Buchner, J. (2010). A hősokkválasz: élet a halál küszöbén. Mol. Cell 40, 253-266. doi: 10.1016/j.molcel.2010.10.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Rinke de Wit, T. F., Bekelie, S., Osland, A., Miko, T. L., Hermans, P. W., van Soolingen, D., et al. (1992). A mikobaktériumok két groEL gént tartalmaznak: a második Mycobacterium leprae groEL gén egy operonban rendeződik a groES-szel. Mol. Microbiol. 6, 1995-2007. doi: 10.1111/j.1365-2958.1992.tb01372.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Robinson, C. V., Gross, M., Eyles, S. J., Ewbank, J. J., Mayhew, M., Hartl, F. U., et al. (1994). A GroEL-hez kötött alfa-laktalbumin konformációjának tömegspektrometriás vizsgálata. Nature 372, 646-651. doi: 10.1038/372646a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Saibil, H. R., Fenton, W. A., Clare, D. K., and Horwich, A. L. (2013). A GroEL nevű chaperonin szerkezete és allosztériája. J. Mol. Biol. 425, 1476-1487. doi: 10.1016/j.jmb.2012.11.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Sameshima, T., Ueno, T., Iizuka, R., Ishii, N., Terada, N., Okabe, K., et al. (2008). Labda- és golyó alakú GroEL-GroES komplexek léteznek együtt a reakcióciklus során. J. Biol. Chem. 283, 23765-23773. doi: 10.1074/jbc.M802541200
PubMed Abstract | CrossRef Full Text | Google Scholar
Sato, S., Ikeuchi, M., and Nakamoto, H. (2008). Egy groEL paralóg expressziója és funkciója a Thermosynechococcus elongatus termofil cianobaktériumban hő- és hidegstressz alatt. FEBS Lett. 582, 3389-3395. doi: 10.1016/j.febslet.2008.08.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Schirmer, E. C., Glover, J. R., Singer, M. A., and Lindquist, S. (1996). HSP100/Clp fehérjék: egy közös mechanizmus magyarázza a különböző funkciókat. Trends Biochem. Sci. 21, 289-296. doi: 10.1016/S0968-0004(96)10038-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharkia, R., Bonshtien, A. L., Mizrahi, I., Weiss, C., Niv, A., Lustig, A., et al. (2003). A kloroplasztisz chaperonin 10 és chaperonin 20 oligomer állapotáról. Biochim. Biophys. Acta 1651, 76-84. doi: 10.1016/S1570-9639(03)00237-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharma, A., Rustad, T., Mahajan, G., Kumar, A., Rao, K. V., Banerjee, S., et al. (2016). A Mycobacterium tuberculosis Cpn60.1 (GroEL1) szokatlan chaperoninjának biológiai funkciójának megértése felé. Tuberc. Edinb. Scotl. 97, 137-146. doi: 10.1016/j.tube.2015.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Tang, Y. C., Chang, H. C., Roeben, A., Wischnewski, D., Wischnewski, N., Kerner, M. J., et al. (2006). A GroEL-GroES nanoketrec szerkezeti jellemzői, amelyek a kapszulázott fehérje gyors hajtogatásához szükségesek. Cell 125, 903-914. doi: 10.1016/j.cell.2006.04.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Techtmann, S. M., and Robb, F. T. (2010). Archaeal-like chaperoninok baktériumokban. Proc. Natl. Acad. Sci. U.S.A. 107, 20269-20274. doi: 10.1073/pnas.1004783107
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsai, Y. C., Mueller-Cajar, O., Saschenbrecker, S., Hartl, F. U., and Hayer-Hartl, M. (2012). A zöld algák és növények chaperonin kofaktorai, a Cpn10 és Cpn20, hetero-oligomer gyűrűkomplexként működnek. J. Biol. Chem. 287, 20471-20481. doi: 10.1074/jbc.M112.365411
PubMed Abstract | CrossRef Full Text | Google Scholar
Viitanen, P. V., Lorimer, G. H., Seetharam, R., Gupta, R. S., Oppenheim, J., Thomas, J. O., et al. (1992). Az emlős mitokondriális chaperonin 60 egyetlen toroidális gyűrűként működik. J. Biol. Chem. 267, 695-698.
PubMed Abstract | Google Scholar
Wang, Y., Zhang, W. Y., Zhang, Z., Li, J., Li, Z. F., Tan, Z. G., et al. (2013). A duplikált GroEL chaperoninok funkcionális divergenciájában szerepet játszó mechanizmusok a Myxococcus xanthus DK1622-ben. PLoS Genet. 9:e1003306. doi: 10.1371/journal.pgen.1003306
PubMed Abstract | CrossRef Full Text | Google Scholar
Ye, X., and Lorimer, G. H. (2013). A szubsztrátfehérje a GroE chaperoninokat aszimmetrikusról szimmetrikus ciklusra kapcsolja a nukleotidcsere katalizálásával. Proc. Natl. Acad. Sci. U.S.A. 110, E4289-E4297. doi: 10.1073/pnas.1317702110
PubMed Abstract | CrossRef Full Text | Google Scholar