Egy bioreaktornak rengeteg funkciót kell ellátnia, ezért felmerülhet a kérdés, hogyan képes mindezt elvégezni. Milyen alkatrészekre van szüksége? Honnan tudja, hogy jelenleg milyenek a körülmények a bioreaktorban, és hogyan tudja korrigálni azokat? És végül, csak a perspektíva kedvéért: hogyan veszi a szakaszos bioprocessz során rögzített adatokat, hogyan jeleníti meg azokat értelmes módon, majd hogyan menti és értékeli azokat, miközben rendszerezve tartja őket?
A következőkben a legfontosabb folyamatparaméterekkel és a szabályozásukhoz szükséges mechanizmusokkal foglalkozunk:
- Kultúra keverése
- Hőmérsékletszabályozás
- PH szabályozás
- Tápanyagok adagolása
- Gázosítás
- Nyomás. szabályozás
- Habképződés megakadályozása
Kultúra keverése
A bioreaktorban lévő kultúrát mindig alaposan össze kell keverni. Ha a tápanyagok a bioreaktorban nem oszlanak el elég jól, a bioreaktor bizonyos részein a körülmények jelentősen eltérnek az ideálistól. A pH például túl savas lehet, vagy a tápanyagellátás elégtelen lehet. Az ilyen eltérések nemcsak a tervezett bioprocessz hatékonyságát csökkentik, hanem elősegíthetik a genetikai módosításokat is. A hőmérséklet-eloszlás további aggodalomra ad okot. Egyenletes keverés nélkül az edény szélén lévő mikroorganizmusok vagy sejtkultúrák szó szerint megfőnek, míg a középen lévők megfáznak. Ha valaha is melegített már levest mikrohullámú sütőben, majd nagy várakozással megette keverés nélkül, akkor tudja, mire gondolunk.
A tipikus keverési sebesség többek között a termesztett organizmustól függően változik:
| Organizmus | Keverési sebesség | ||||
| Baktérium, Élesztő, gombák | 500 – 1500 min-1 | ||||
| emlősök, Rovar- vagy növényi sejtek | 30 – 300 min-1 | ||||
A keverési sebesség beállítása akár mikroorganizmusok, akár növényi, állati vagy rovarsejtek tenyésztése esetén nagyon fontos, mivel ezek különbözőképpen reagálnak a nyírási stresszre, ill.e., a keverés által okozott mechanikai igénybevételre. A sejtvonaltól függően a sejtkultúrák sokkal intenzívebben reagálhatnak a túl erős keverésre, azaz egyszerűen elpusztulnak, ezt a tendenciát a tudósok pontosabban (és diplomatikusabban) “nyírási stresszre való érzékenységként” írják le. A keverési sebesség változtatásával az oxigén elérhetősége változtatható a biofolyamat során, így biztosítható az optimális sejtnövekedés.
Hőmérséklet mérése és szabályozása
A mikroorganizmusok és a sejtkultúrák egyaránt rendelkeznek olyan enzimekkel, amelyek bizonyos hőmérsékleti és pH-tartományokban működnek a legjobban. Ha a körülmények kívül esnek ezeken a tartományokon, a kívánt biofolyamat sokkal lassabban halad, mivel a növekedés és az anyagcsere teljesítménye nagymértékben függ ezektől az enzimektől, azaz a katalitikusan aktív fehérjéktől. A legrosszabb esetben a kedvezőtlen környezeti feltételek akár el is pusztíthatják őket. Az emlős sejtkultúrák egy nagyon szűk hőmérséklettartományban érzik magukat a legjobban – ez a hőmérséklet az ő szemszögükből csak akkor van jelen, ha a tenyésztőedényben a hőmérséklet 37 °C.
A hőmérséklet meghatározására ezért a bioreaktorban egy Pt100 szenzorként ismert platina ellenállásérzékelőt használnak. Ennek ellenállása 0 °C-on 100 Ω, és megfelelő kalibrálás esetén elég jól lefedi az elvárt, biológiailag releváns mérési tartományt.
A jellemző hőmérséklettartomány többek között a termesztett organizmustól függően változik:
| Organizmus | Hőmérsékleti tartomány | ||||
| Baktériumok, Élesztők, gombák | +20 °C-tól +60 °C-ig | ||||
| emlősök, Rovar- vagy növénysejtek | +25 °C-tól +37 °C-ig | ||||
Ha szobahőmérséklethez közeli vagy az alatti hőmérsékleten dolgozik, aktív hűtőrendszerre, például keringtető hűtőrendszerre van szüksége. A legtöbb biofolyamat esetében a hőmérsékletnek állandónak kell maradnia a teljes tenyésztés alatt. Egyes termékek esetében azonban, mint például a penicillin vagy a rekombináns fehérjék (azaz a genetikailag módosított szervezetek felhasználásával előállított biotechnológiával előállított fehérjék) esetében a hőmérséklet megváltoztatása a növekedési fázis végén aktiválja a termékképzés szempontjából fontos géneket, és ezért előnyös. A sejtkultúrákat alkalmazó termelési módszerek esetében a hőmérsékletet néha a biofolyamat végén is csökkentik (a biotechnológiában “hőmérsékletváltás” néven ismert technika), hogy a késztermék a későbbi felhasználás során stabil maradjon.
A hőmérséklet szabályozására többféle módon használhatunk fűtő- és/vagy hűtőkört:
-
-
- Egy elektromos fűtőblokk beépített hűtési spirállal
- A sterilizálás után a tenyésztőedény köré tekert szilikon fűtőbetét
- Kettős köpeny, amelyben víz kering. A hőmérséklet beállítása elektromos fűtőberendezéssel vagy gőzzel és a hűtővíz bevitelére szolgáló mágnesszeleppel történik
-
A pH mérése és szabályozása
A pH mérése és szabályozása nagyon fontos szempont a biofolyamatoknál, mivel a pH változása jelentősen megváltoztathatja a növekedési feltételeket – általában súlyos következményekkel. A táptalajok általában tartalmaznak puffereket, azaz olyan anyagokat, amelyek enyhítik a sav vagy bázis hozzáadása által okozott túlságosan hirtelen pH-változást. Mivel a táptalajba csepegtetett sav számos sejtvonalat károsíthat, a tudósok gyakran gondosan dúsítják a sejtkultúrában használt gázkeveréket CO2-vel, ahelyett, hogy folyékony savat adnának hozzá. A gáz ilyenkor feloldódik a táptalajban, így a szén-dioxid egy pufferrel együtt befolyásolja a pH-t.
Típusos pH-tartományok a termesztett szervezettől függően:
| Organizmus | pH | ||||
| Baktériumok, élesztők, gombák | 4.5 – 7.0 | ||||
| Emlősejtek | 6.7 – 7.4 | ||||
| Rovarsejtek | 6.2 – 6.9 | ||||
| Növényi sejtek | 5.5 | ||||
A pH mérésére a bioprocessz során minden egyes bioreaktor fel van szerelve egy pH-érzékelővel, az úgynevezett pH kombinált elektródával. A bioreaktor képes korrigálni a pH esetleges eltéréseit; ehhez savas és/vagy lúgos oldatot bocsátanak rendelkezésre, amelyet csöveken és szivattyúkon keresztül csatlakoztatnak a tenyésztőedényhez. A sav és a bázis koncentrációját ügyesen kell megválasztani ahhoz, hogy ez működjön – ha túl magas, a koncentrált sav vagy bázis cseppjei károsíthatják a mikroorganizmusokat és a sejtkultúrákat, mielőtt azok a bioreaktorban eloszlanának. Ha viszont a koncentráció túl alacsony, akkor a kezelőknek több savat vagy bázist kell hozzáadniuk, szükségtelenül hígítva a táptalajt.
Tápanyagok hozzáadása
A bioprocessz során a mikroorganizmusok általában sokféle tápanyagot fogyasztanak. A tápközeg alapösszetétele általában vízből, a szervezet számára felhasználható energiaforrásból (pl. glükóz), valamint a szükséges tápanyagokból (szén, nitrogén és foszfor), sókból és nyomelemekből áll. A szervezettől függően más olyan vegyületekre is szükség van, amelyeket nem lehet saját maga szintetizálni (vitaminok, esszenciális aminosavak stb.).
A bioperszonikus folyamat stratégiájától függően ezeket a tápanyagokat vagy mind rendelkezésre bocsátják a bioperszonikus folyamat kezdetén (szakaszos bioperszonikus folyamat), vagy idővel adják hozzá, mint például a feed-batch vagy a folyamatos folyamat során.
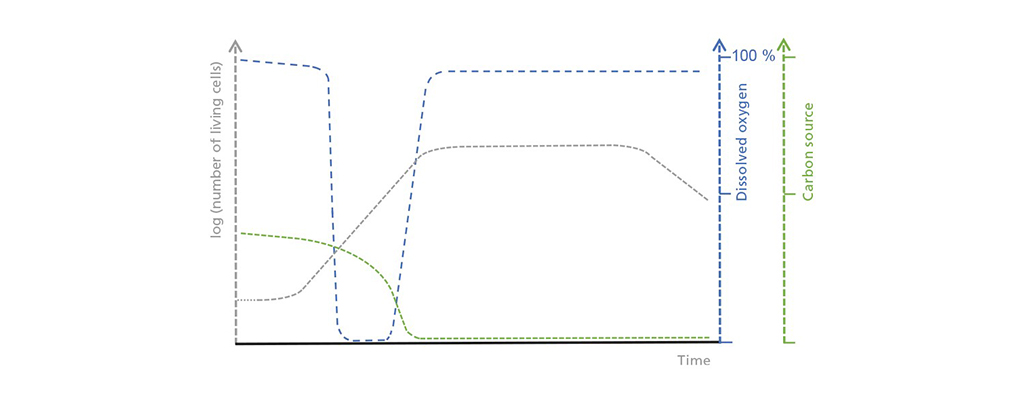
Az élő sejtek koncentrációja, az oldott oxigén és a limitáló szénforrás közötti összefüggések sematikus ábrázolása szakaszos üzemben. A kezdeti késleltetési fázisban az élősejtek száma csak lassan növekszik, ami a szénforrás mérsékelt, de egyenletes felvételéhez vezet. Az exponenciális növekedési fázisban az oxigénfogyasztás addig növekszik, amíg meghaladja a lehetséges oxigénbevitelt. Amint a szénforrás kimerül, megkezdődik a stacionárius fázis, amelyet egy holt fázis követ, amely során az élősejtek száma drasztikusan csökken.
Ha többet szeretne megtudni a különböző táplálási stratégiákról, nézze meg blogbejegyzésünket: The Difference Between Batch, Fed-batch and Continuous Processes.
Gázosítás
A bioprocessz során a bioreaktor steril gázkeveréket, például levegőt juttat a táptalajba. Az állandó keverés nem csak a tápanyagokat osztja el – a tenyésztőedényben keletkező gázbuborékok méretét is csökkenti, így hatékonyan juttat oxigént a tápoldatba. Ez azért fontos, mert a mikroorganizmusok és sejtkultúrák csak a tápoldatban oldott oxigént képesek felvenni.
Az oxigénigény változó: az aerob baktériumoknak oxigénre van szükségük, míg mások a gázkeverékeket, például a szintézisgázt (“syngas”) kedvelik. Az anaerob organizmusok viszont teljesen nélkülözhetik a gázosítást, csak a táptalaj szervetlen és szerves anyagaiból, például nitrátból vagy fumarátból táplálkoznak.
A mikroorganizmusokkal ellentétben a sejtkultúrákat nem csak levegővel gázosítják – a gázkeverék oxigéntartalmát tiszta nitrogénnel és tiszta oxigénnel is lehet befolyásolni. A pontos összetétel a sejttenyésztési alkalmazástól függ. Ahhoz, hogy a gáz atmoszférája állandó legyen, a bioreaktornak pontos szabályzórendszerekre van szüksége.
A bioprocessz kezdetén például a tenyészetnek gyakran kevesebb oxigénre – és így kisebb gázbevitelre – van szüksége, mivel a növekedés még lassan halad. Később azonban a gyorsabb növekedés sokkal több oxigént igényel. Amellett, hogy a bioreaktor biztosítja a kívánt gáz vagy gázkeverék állandó ellátását, a megfelelő mennyiségű gázt is a megfelelő időben szolgáltatja. Ehhez a bioreaktor gáznyílásokkal rendelkezik, amelyek az épületből, egy kompresszorból vagy egy gázpalackból származó, nyomás alatt lévő levegőhöz csatlakoznak.
A gázadási sebességet általában percenként literben mérik. Annak érdekében, hogy a különböző bioreaktorokra alkalmazható általános paramétert kapjunk, a sebességet gyakran fajlagos gázadási sebességként is feltüntetik, amely a munkatérfogat (edénytérfogat percenként, vvm) többszörösére vonatkozik, és min-1-ben fejezik ki. A mikrobiális biofolyamatokra jellemző érték a munkatérfogat 1-1,5-szerese percenként. Egy 4 L hasznos térfogatú bioreaktor esetében a maximális gázképződési sebesség tehát 4 L * 2 L L-1 min-1 = 8 L min-1. A sejtkultúrákban ezzel szemben a maximális sebesség gyakran a munkatérfogat 10-15%-a percenként, hogy a gázbuborékokat kicsiben tartsák, és így megakadályozzák a habképződést és a sejtek károsodását a kipukkadó buborékok miatt.
A gázsebesség változtatása azonban nem az egyetlen módja annak a hatékonyságnak a szabályozására, amellyel a bioreaktor oxigént és más gázokat juttat a táptalajba. Minél nagyobb a bioreaktorban lévő összes gázbuborék összességének felülete – azaz minél finomabban eloszlanak maguk a gázbuborékok – annál hatékonyabban kerül át az oxigén a gázból a folyékony fázisba. Ez azt jelenti, hogy például a keverési sebesség növelése javíthatja a mikroorganizmusok oxigénellátását, mivel a keverő még kisebbé teszi a gázbuborékokat, és így növeli a bioreaktorban lévő összes gázbuborék teljes felületét.
A pO2 pontos szabályozása – és így a gázosítási sebesség és a gázösszetétel pontos szabályozása – nagyon fontos, mivel normál esetben a pO2 nem lehet a kultúra növekedését gátló tényező. Ha azonban nem megfelelően szabályozzák, a pO2 valóban limitáló tényezővé válik.
Mivel a bioreaktorba táplált gáz általában száraz, a gázosítás során a bioreaktorból származó nedvesség a kilépő áramban összegyűlhet. Nagy gázosítási sebességnél nemcsak a töltési szint csökkenne, hanem a nedvesség eltömítené a kilépő szűrőt is, megakadályozva a megfelelő szellőzést, és lehetővé téve a nyomás felépülését. Ennek a hatásnak az elkerülése érdekében a bioreaktorokat hatékony kipufogóhűtővel látják el, ahol a kipufogógázban lévő nedvesség lecsapódik és vissza tud csöpögni a bioreaktorba, mielőtt elérné a kipufogószűrőt.
A nyomás mérése és szabályozása
Minél nagyobb a nyomás az edényben, annál több oxigén oldódik. Az üvegből készült tenyésztőedények gyakran csak 0,5 bar nyomásig engedélyezettek, ami még egy közepesen megtöltött kerékpárgumi nyomásának a felét sem éri el. Magasabb üzemi nyomáson a kissé sérült üvegből készült tenyésztőedények megrepedhetnek, ami biztonsági kockázatot jelent. Ezért a kipufogószűrő szárazon tartásával és rendszeres cseréjével mindig biztosítsa a bioreaktor szabad, nyomásmentes kipufogóvezetékét – ezzel természetesen a tenyésztőedény épségét is biztosítja. Az üvegből készült tenyésztőedényekkel ellentétben a rozsdamentes acél bioreaktorokat magasabb nyomásra tervezték, és már alapkonfigurációjukban is akár 2 bar nyomásra (egy jól megtöltött kerékpárgumi) is alkalmasak. Ráadásul az ilyen rendszerek gyakran fel vannak szerelve nyomásszabályozó mechanizmussal, amely a bioreaktorban lévő nyomásérzékelőn és a kipufogóvezetékben lévő arányos szelepen alapul. Ezek nemcsak mérni tudják a bioreaktorban lévő nyomást – hanem aktívan szabályozni is képesek azt.

A habképződés megakadályozása
A fürdőkádakon és söröspoharakon kívül a hab meglehetősen népszerűtlen mellékhatás, különösen a bioreaktorokban. A hab a tenyésztőedényben a folyékony és a gázfázis közötti határfelületen képződik, és gyorsan utat találhat a fedőlap alá. A legrosszabb esetben eltömíti a kipufogószűrőt, ami viszont gátolja a gázáramlást. A legtöbb bioreaktort ezért a habképződés elleni küzdelemre szolgáló rendszerrel látják el. A fejtérben lévő mechanikus habbontók a meglehetősen nagy rozsdamentes acél bioreaktorok számára vannak fenntartva, míg a kisebb bioreaktorokban kémiai szereken (például PPG, Struktol vagy szilícium alapú habmentesítő szereken) alapuló habelhárító rendszerek találhatók.
A tipikus habelhárító rendszer egy, a tenyésztőedényben meghatározott magasságban elhelyezett érzékelőből áll. Ha a hab magassága eléri az érzékelőt, egy tartályból habzásgátlót pumpálnak a tenyésztőedénybe. Ezek a habzásgátló szerek a folyadék-gáz határfelületen aktívak, és növelik a habbuborékok összeomlási hajlamát. Különösen makacs esetekben, amikor a hab nem oldódik fel azonnal, ismételje meg az eljárást egy előre beállított idő után (“shot & delay” stratégia). A habzásgátló használata esetén óvatosságra int – ha a szükségesnél kicsit is többet adagol, akkor a habzásgátló második bőrként feküdhet a folyadék felszínén, ami akadályozza a gázcserét. A habzásgátló szerek a hatékony oxigénátadást is akadályozzák, mivel a felületi feszültség változása elősegíti a gázbuborékok összeomlását a bioreaktorban, ezáltal csökkentve a gázcseréhez rendelkezésre álló felületet. A megfelelő szer kiválasztása az adott biofolyamat függvénye is, mivel a baktériumok és sejtek eltérően reagálnak bizonyos vegyi anyagokra.
Bónusz: A SCADA szoftver használatának előnyei
Mostanában a bioreaktorban keletkező eredményeket a lehető legközpontibb módon kell gyűjteni és kiértékelni, mivel csak így lehet hatékonyan alkalmazni a modern, nagy adatmennyiségű algoritmusokat, hogy több információt generáljunk és jobban megértsük, hogyan működik egy folyamat. Ez a SCADA-szoftver feladata. Első lépésben a bioreaktor összes adatát ki lehet olvasni – a felhasználó részéről különösebb ráfordítás nélkül – és központilag tárolni, hogy azokat önmagukban ki lehessen értékelni, vagy más tételes adatokkal össze lehessen hasonlítani. Ez gyorsan ötleteket ad új kísérletekhez és esetleg összetett tételes stratégiákhoz. Egy professzionális SCADA szoftver segítségével ezeket könnyen megtervezheti, majd vezérelheti a bioreaktort, amely ideális esetben teljesen automatizált folyamat lesz. Ezenkívül a SCADA-szoftver a bioreaktor környezetének számos komponensét is integrálja. Ezek közé tartoznak a folyamatoptimalizálás eszközei a kísérlettervezési (DoE) technikával vagy a nagy teljesítményű szoftveres érzékelők, amelyekkel egyidejűleg további információkat lehet közvetlenül a tételes folyamat paramétereiből kiszámítani, sőt, akár szabályozni is lehet ezeket a paramétereket. Például a légzési hányados (RQ) felhasználható az anyagcsere-aktivitás becslésére az ürített szén-dioxid és az elnyelt oxigén arányának segítségével.
A lehetőségek olyan sokfélék – különösen, ha a bioreaktor és a SCADA-szoftver tökéletesen illeszkedik egymáshoz -, hogy nem is tudnánk mindet leírni. Ha többet szeretne megtudni mindarról, amit egy modern SCADA szoftver kínál, nézze meg az eve® bioprocess platform szoftver

.