08 Aug 2019
Mondjuk az ApoE-t és az Alzheimer-kórt, és a beszélgetés az E4 allélra, a betegség legerősebb fogékonysági génjére terelődik. Az ApoE-nek azonban van egy másik oldala is, az ApoE2. Bár ez az izoforma véd az Alzheimer-kór ellen, a tudósok alig tanulmányozták. Most az ApoE2-t vizsgálják, mivel a tudósok azt kérdezik, hogy egyes emberek pontosan hogyan tartják meg szellemi éleslátásukat idős korukig. Az Alzheimer’s Association július 14-18. között Los Angelesben tartott nemzetközi konferenciáján az ApoE genotípusok vizsgálata 5000 boncolással megerősített Alzheimer-kór eseteiben kimutatta, hogy a két E2-kópiával rendelkező embereknél a demencia kockázata 90 százalékkal csökken a közös E3/E3 genotípussal rendelkezőkhöz képest. Más munkák szerint ennek az lehet az oka, hogy az ApoE2 csökkenti az amiloid és a tau patológiát, és növeli a szürkeállomány térfogatát a kritikus agyi régiókban. Úgy tűnik, hogy az E2 előnyei specifikusak az Alzheimer-kórra, nem általánosak a neurodegenerációra.
ApoE az agy fő koleszterinhordozó fehérjéje. Azóta vizsgálják, hogy az 1990-es évek elején felfedezték az Alzheimer-kór kockázati génjeként, de újabban az amiloid és tau aggregátumok lerakódására adott gliális válaszok központjaként tűnik fel (2018. aug. hírek; 2017. szept. hírek). A gén három polimorf allél formájában létezik – E2, E3 és E4 -, amelyek gyakorisága világszerte 8 százalék, 78 százalék, illetve 14 százalék. Több mutáns forma is ismert, például az úgynevezett heidelbergi, pittsburghi és christchurchi mutáció (Feussner és mtsai., 1992; Kamboh és mtsai., 1999; Wardell és mtsai., 1987).
ApoE4 messze a legnagyobb figyelmet kapja az AD-kutatók részéről, mivel a vizsgált populációtól függően akár 15-szörösére is megnöveli az AD kockázatát, és az AD-ben szenvedők 40 százalékában fordul elő. Az E2, a védő allél, kevés figyelmet kapott, mivel a három közül ez a legkevésbé gyakori, és nagyrészt hiányzik az AD-mintákból. Az E2 egy példányával rendelkező embereknél fele akkora az esély az Alzheimer-kór kialakulására, mint a gyakoribb E3/E3 genotípussal rendelkezőknél. De van-e ezen túlmenően hatása a további E2-nek? “Nem tudtuk eddig, hogy az E2 dózisának van-e differenciált kockázata, vagyis hogy az E2/2 kockázata szignifikánsan alacsonyabb-e, mint az E2/3-é” – mondta Eric Reiman a tanulmány bemutatásakor.
Azért, hogy ezt kiderítsék, Reiman és kollégái a phoenixi Banner Alzheimer Intézetből, Gyungah Jun a Bostoni Egyetemről, Joseph Arboleda a Massachusetts Eye and Ear, Yakeel Quiroz a Massachusetts General Hospitalból, valamint az AD Genetics Consortium munkatársai úgy döntöttek, hogy sok agyból származó adatokat vizsgálnak meg. Az ADGC 5 007 agyában elemezték mindhárom ApoE-allél hozzájárulását a demencia kockázatához és patológiájához. Ez a minta 4 018 boncolással megerősített Alzheimer-demenciás esetet, valamint 989 patológiailag és kognitív szempontból nem érintett donort tartalmazott. Amellett, hogy elegendő számot biztosít az E2/E2 homozigóták vizsgálatához, ez a kohorsz elkerülte a félrediagnosztizálás zavaró tényezőjét, mivel kizárta a nem Alzheimer-kórra visszavezethető demenciákat, valamint azokat az embereket, akiknek a halál időpontjában Alzheimer-kórképük volt, de nem volt demenciájuk.
Amint az várható volt, az ApoE2 homozigóták ritkák voltak – a több mint 5000 ember közül mindössze 24-en, azaz 0,5%-uk. A többi genotípushoz képest sokkal kisebb valószínűséggel fordult elő náluk Alzheimer-kór. Az E2 homozigóták az esetek 0,1 százalékát tették ki, de az egészséges kontrollok 1,9 százalékát. Ezzel szemben az ApoE4/4 homozigóták az esetek 15,6 százalékát tették ki, a kontrolloknak pedig csak 1 százalékát. Más szóval a 24 ApoE2/2-esből 19 volt kognitív szempontból egészséges, de a 633 ApoE4/4-esből csak 10.
Az E2 homozigóták kockázata 66 százalékkal csökkent még az E2/3 hordozókhoz képest is, 87 százalékkal csökkent a leggyakoribb genotípushoz, az E3/3-hoz képest, és 99,6 százalékkal csökkent az E4/4-esekhez képest. Alapvetően az E4/4-esek többsége Alzheimer-demenciában szenved, míg az ApoE 2/2-esek közül csak kevesen.
A két E2 allél megléte kevesebb amiloid plakk és tau neurofibrilláris csomó patológiával korrelált. Az ApoE2 védő hatása a tau patológiára még akkor is nyilvánvaló volt, ha az amiloid plakk terheléssel korrigálták. Ez tükrözi azokat a közelmúltbeli állatkísérletes adatokat, amelyek arra utalnak, hogy az ApoE4 az amiloidtól függetlenül rontja a tau patológiát (Shi és mtsai., 2017).
Az új tanulmány fő megállapítása egybecseng Pieter-Jelle Visser (Maastrichti Egyetem, Hollandia) és munkatársai korábbi tanulmányával. Ők egy 7583 fős mintában 16 ApoE2/2-hordozót találtak, akik közül 10 volt kognitívan normális és amiloid-negatív, míg a mintában szereplő 386 ApoE4/4-hordozó közül 301-en Alzheimer-demenciában szenvedtek. Ez a minta azonban nem volt patológiailag megerősített (Jansen és mtsai., 2015).
Mennyire fontos a neuropatológiai megerősítés? Reiman és munkatársai összehasonlították a boncolással igazolt kohorszból származó kockázati becsléseket a 23 857 élő személyből álló kohorszból számítottakkal, akiknél klinikailag valószínűsíthető Alzheimer-demenciát diagnosztizáltak vagy kognitívan normálisak voltak, és amiloidstátuszuk ismeretlen volt. Ebben az elemzésben a 2/2 védő hatását és a 4/4 miatt megnövekedett kockázatot egyaránt alulbecsülték. A tudósok például azt találták, hogy az E4/E4-hez kapcsolódó esélyhányados az E3/E3-hoz képest a klinikai mintában 10,7 volt, szemben a patológiailag igazolt esetek 31,22-vel. Az E2 és az E4 dózishatását is alulbecsülték az élő mintában. Így a boncolási elemzés aktualizált és valószínűleg pontosabb kockázati becsléseket ad az összes ApoE-genotípusra, vélik Reiman és munkatársai, legalábbis ezekre a nem hispániai fehér kutatási résztvevőkre vonatkozóan.
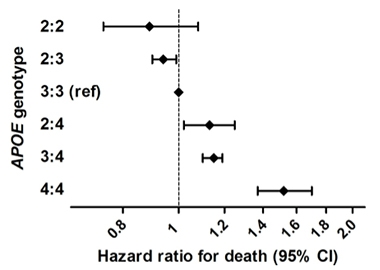
Élet meghosszabbítása. Egy nagy epidemiológiai vizsgálatban, amely hat, európai felmenőkkel rendelkező emberek népességen alapuló kohorszát egyesítette, az ApoE2 homozigótáknál kisebb volt a halálozás kockázata, mint más genotípusoknál. Az ApoE4 homozigótáknál volt a legnagyobb a kockázat.
Az ApoE Alzheimer-kórra gyakorolt hatása köztudottan különbözik az etnikai csoportok között. Ilyen típusú vizsgálatra van szükség változatosabb alanyokkal, több E2/2 homozigótával, és figyelembe véve az ApoE allélok lehetséges hatásait a túlélésre, ami torzíthatja az eredményeket. Reiman mindazonáltal elmondta: “Eredményeink arra utalnak, hogy az ApoE2 homozigozitás az Alzheimer-kór kivételesen alacsony kockázatával jár, hogy az APOE és variánsainak hatása az Alzheimer-kór kockázatára lényegesen nagyobb, mint azt korábban gondolták, és hogy nyomós okunk van arra, hogy felfedezzük azokat a kezeléseket, amelyek elősegítik ezt a védőhatást.”
Ez egybevág Sudha Seshadri, University of Texas Health, San Antonio, Frank Wolters, Erasmus Medical Center, Rotterdam, Hollandia, és munkatársai közelmúltbeli eredményeivel. Hat népességalapú kohorszból származó 38 537 emberen végzett vizsgálatukban túlélési előnyt találtak az ApoE2-hordozók számára (Wolters és mtsai., 2019). Azonosítottak 239 E2 homozigótát, akik a leghosszabb életet élték. Az E2 hatását csak részben magyarázták a vérzsírra vagy az érrendszeri betegségekre gyakorolt hatásával. Az E4 homozigótáknál volt a legmagasabb a halálozási kockázat, és ezt nagyrészt a demenciával való összefüggés magyarázta. Seshadri az Alzforumnak elmondta, hogy a kutatók az Alzheimer-kór és a kognitív változások, valamint az amiloid és tau PET-mérések vizsgálatát is meg fogják vizsgálni ebben a mintában.
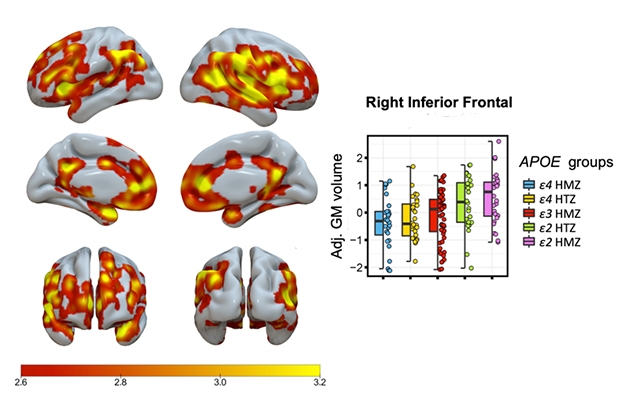
Bitről bitre. Az árnyékolás a szürkeállomány térfogatának szignifikáns, lépcsőzetes, ApoE genotípussal összefüggő növekedését mutató területeket jelzi, ahol az E4/4 homozigótáknál a legalacsonyabb, az E2/2-eseknél pedig a legmagasabb a térfogat. A grafikon egy agyi régió adatait mutatja.
Hogyan adhat az ApoE2 rugalmasságot? Hogy ezt kiderítsék, Gemma Salvadó, Barcelonaβeta Brain Research Center, Spanyolország, bemutatott egy tanulmányt, amelyben ő és szerzőtársai különböző mintákból származó képalkotó adatokat gyűjtöttek össze minél több idősebb ApoE2 homozigóta esetében. Céljuk az volt, hogy összehasonlítsák az E2/2-esek agyszerkezetét más ApoE genotípusokéval.
Az E2-t korábban egészséges embereknél az agy morfológiájában bekövetkező finom változásokkal hozták összefüggésbe, beleértve a hippokampusz lassabb sorvadását idős korban és a nagyobb hippokampuszokat középkorban (Chiang és mtsai., 2010; Fennema-Notestine és mtsai., 2011). Gyermekkorban az E2-hordozókról azt jelentették, hogy vastagabb entorhinális kérgük van, mint az E3 homozigótáknak vagy az E4-hordozóknak (Shaw és mtsai., 2007). Ezek a tanulmányok azonban mind olyan emberekre összpontosítottak, akiknek csak egy E2-kópiájuk volt.
Azért, hogy kiderítse, mire képes ez a plusz E2, Salvadó összegyűjtötte és elemezte a barcelonai ALFA-vizsgálat (Molinuevo és mtsai. 2016), az Amszterdami Egyetemi Orvosi Központ kohortja, az OASIS nyílt hozzáférésű képalkotó vizsgálatok és az ADNI kognitívan nem sérült emberek MRI-adatait. Összesen 28 E2/E2 homozigótát talált. Mindegyiküket összepárosította öt másik, ugyanabból a központból származó alannyal az életkor, a nem és az iskolai végzettség alapján, valamint minden más ApoE-genotípusból eggyel. Ez összesen 168 alanyt adott, átlagéletkoruk 62 év volt.
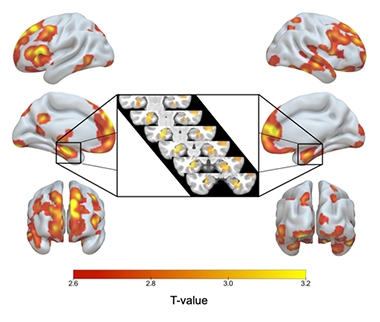
ApoE2/2 Over 3/3. A piros-sárga árnyékolás azokat az agyi régiókat jelöli, ahol az ApoE2 homozigótáknak több szürkeállományuk volt, mint az E3 homozigótáknak, beleértve mindkét hippocampit (inzert).
Az E2/2-esek E3/3-as párosaikhoz képest nagyobb szürkeállomány-térfogattal rendelkeztek a hippokampuszukban és más, az AD-re jellemző területeken, beleértve a mediális temporális kéreg, az alsó temporális, a temporális pólus, a prekuneus és a felső parietális területeket. Az E2 homozigótáknak több szürkeállományuk volt az öregedés kognitív rugalmasságával kapcsolatos területeken is, nevezetesen az anterior cinguláris és a mediális prefrontális területeken (Arenaza-Urquijo és mtsai., 2019; Harrison és mtsai., 2018). Az E2/3 heterozigótákkal összehasonlítva az E2 homozigóták kevés szignifikáns különbséggel büszkélkedhettek a szürkeállományban, de még nagyobb hippokampuszuk volt, mint a 2/3-osoknak.
Salvadó a szürkeállomány térfogatának fokozatos, genotípusfüggő növekedéséről számolt be, ahol az E4/4 homozigótáknak volt a legkisebb, az E3/3-asoknak a közepes, az E2/3-asoknak a nagyobb, az E2/2-eseknek pedig a legnagyobb térfogatuk (lásd az alábbi képet).

ApoE2/2 Over 2/3. A következő protektív genotípushoz, az ApoE2/3-hoz képest az E2 homozigótáknak csak néhány kis területen van több szürkeállományuk.
A nő úgy véli, hogy a nagyobb szürkeállomány a stratégiai agyterületeken segíthet az E2 homozigótáknak megbirkózni az Alzheimer-kórral, ha és amennyiben az megjelenik. Mivel az ApoE2 már gyermekkorban felduzzasztja az entorhinális kéregállományt, az ellenálló képesség a fejlődési folyamatokból eredhet, mondta.”
“Ezek nagyon fontos eredmények” – kommentálta Reiman. “Azt sugallják, hogy ha a sorvadás olyan, mint a gumiabroncsok futófelületének erodálása, akkor az E2 homozigóták több futófelülettel indulhatnak” – mondta. Salvadó megpróbálja kiterjeszteni a vizsgálatot, hogy több homozigótát vizsgáljon további kohorszokból, és más képalkotási módokat is vizsgáljon.”
Terry Goldberg, Columbia Egyetem, New York, évek óta tanulmányozza az ApoE2 által közvetített neuroprotektivitás lehetséges mechanizmusait (Conejero-Goldberg és mtsai., 2014). Az AAIC-en Goldberg az ApoE allélok és az Alzheimer-kór neuropatológiájának kapcsolatáról mutatott be eredményeket, és az elemzést kiterjesztette más betegségekre is.
A Nemzeti Alzheimer Koordinációs Központ adatbázisából származó 1557 agy adatait használta fel, amelyek klinikai és neuropatológiai értékeléssel is rendelkeztek. Mivel olyan kevés E2 homozigóta volt, Goldberg az E2/E2 és E2/E3 genotípusokat csoportosította, így a minta 130 főből állt. Ebben az összevont csoportban minden negyedik agyban volt AD neuropátiás elváltozás, szemben az E3/3-asok 40 százalékával, az E3/4-esek 65 százalékával és az E4/4-esek 85 százalékával. A korábbi munkákkal összhangban az E2-hordozóknál volt a legenyhébb amiloid-patológia, a legkevesebb neuritikus plakk és a legenyhébb tau-patológia. A statisztikai mediációs elemzés azt sugallta, hogy az ApoE2 és a csökkent csomósodás közötti kapcsolat részben az amiloidra gyakorolt hatásán keresztül ment végbe, és részben független volt az amiloidtól. Ez egybevág Reiman eredményeivel.
Ebben az adathalmazban is az ApoE2 erősen védett, még akkor is, ha Goldberg nem elemezte a homozigótákat: Az E2 az E3-hoz képest felére, az E4-hez képest pedig 90 százalékkal csökkentette az amiloid- és tau-kórosodás kockázatát.
Melyik az erősebb, az E2 vagy az E4? Az E2/E4 és az E3/E4 genotípusokat összehasonlítva Goldberg hasonló mértékű patológiát talált. Ha valami, akkor az E2/E4 párosítás rosszabb volt. Ez arra utal, hogy az E4 felülírja az E2 védő hatását. “Mondhatnánk, hogy az E4 mérgező” – vonta le a következtetést Goldberg. Ez azt sugallja, hogy a víruskonstrukciókat használó terápiák, amelyek E2-t juttatnak az E4-et expresszáló agyszövetbe, nem biztos, hogy hasznosak – mondta.
Mi a helyzet más neurodegeneratív betegségekkel?
A szakirodalom vegyes eredményeket kínál az E2 és E4 frontotemporális demenciában. Egyes tanulmányok szerint az E2 elősegíti a kockázatot (2016. márciusi hírek), míg mások védelmet tulajdonítanak neki, és a kockázatot az E4-nek tulajdonítják (Mishra és mtsi., 2017). Az AAIC-en Goldberg arról számolt be, hogy az E2 a frontotemporális demencia 103 esete közül a TDP-43 súlyosabb patológiájával, a Pick-kór 28 esete és a progresszív szupranukleáris bénulás 51 esete közül pedig a tau patológiájával állt összefüggésben. Figyelmeztetett, hogy ezek a számok olyan kicsik, hogy az eredmények hamisak lehetnek. Goldberg nem tudja, hogy ezeknél a betegeknél C9ORF72 vagy progranulin mutáció volt-e, és a TDP-43 felhalmozódása korfüggő lehet. Az α-szinuklein patológia esetében Goldberg azt találta, hogy az ApoE4 elősegíti, az E2 pedig csökkenti a Lewy-test patológia terjedését a középagyi eredetén kívülre, a limbikus és neokortikális területekre
Ezek a tanulmányok együttesen rávilágítanak arra, hogy újra felértékelődik az ApoE óriási hatása az AD patogenezisére (lásd például Wu és Zhao, 2016). Az E2 által nyújtott mélyreható védelem valószínűleg újra felkelti az érdeklődést a gyógyszerfejlesztők körében, akik korábban már próbálkoztak és kudarcot vallottak, de most talán jobbnak látják, ha újra megvizsgálják ezt a célpontot.-Pat McCaffrey
Hírek Idézetek
- ApoE: Közös mikrogliális bűnös az öregedésben, az Alzheimer-kórban és a tauopátiában? 11 Aug 2018
- Az ApoE4 mindent rosszabbá tesz, ami Tau, az elejétől a végéig 20 Sep 2017
- Et Tu, ApoE2? Paper Claims Allele Boosts Risk for Dementia-in ALS 1 Mar 2016
Paper Citations
- Feussner G, Funke H, Weng W, Assmann G, Lackner KJ, Ziegler R.Severe type III hyperlipoproteinemia associated with unusual apolipoprotein E1 phenotype and epsilon 1/’null’ genotype. Eur J Clin Invest. 1992 Sep;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST. Az apolipoprotein E gén (APOE*4 Pittsburgh) új mutációja összefügg a késői Alzheimer-kór kockázatával. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoprotein E2-Christchurch (136 Arg—-Ser). A humán apolipoprotein E új variánsa egy III. típusú hiperlipoproteinémiában szenvedő betegnél. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.Az ApoE4 jelentősen súlyosbítja a tau által közvetített neurodegenerációt a tauopátia egérmodelljében. Nature. 2017 Sep 28;549(7673):523-527. Epub 2017 Sep 20 PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Az agyi amiloid patológia prevalenciája demencia nélküli személyeknél: metaanalízis. JAMA. 2015 May 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE vizsgálók.Az APOE genotípus hatása a túlélésre: Hat népességalapú kohorsz 38 537 résztvevőjének eredményei (E2-CHARGE). PLoS One. 2019;14(7):e0219668. Epub 2019 Jul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .Hippocampus atrófia aránya és CSF biomarkerek idős APOE2 normális alanyokban. Neurológia. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.Presence of ApoE ε4 allele associated with thinner frontal cortex in middle age. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN.Cortical morphology in children and adolescents with different apolipoprotein E gene polymorphisms: an observational study. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.The ALFA project: Az Alzheimer-kór korai patofiziológiai jellemzőinek azonosítására szolgáló kutatási platform. Alzheimers Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3 PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P. The metabolic brain signature of cognitive resilience in the 80+: beyond Alzheimer pathologies. Brain. 2019 Apr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ. agyi morfológia, kogníció és β-amyloid a kiváló memóriateljesítményű idősebb felnőtteknél. Neurobiol Aging. 2018 Jul;67:162-170. Epub 2018 Mar 27 PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE. APOE2 fokozza az Alzheimer-kór elleni neuroprotekciót több molekuláris mechanizmuson keresztül. Mol Psychiatry. 2014 Febr. 4; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium: Gene-based association studies report genetic links for clinical subtypes of frontotemporal dementia. Brain. 2017 Apr 5; PubMed.
- Wu L, Zhao L. ApoE2 és Alzheimer-kór: ideje közelebbről megvizsgálni. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
További olvasmányok
Nincs elérhető további olvasmány