
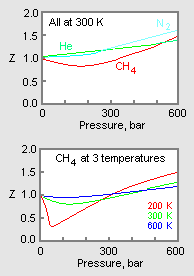
1. ábra: A gázok összenyomhatósági tényezőinek példadiagramjai
Az összenyomhatósági tényező (Z) hasznos termodinamikai tulajdonság az ideális gáztörvény módosítására, hogy figyelembe vegye a valós gázok viselkedését. Azt méri, hogy egy valós gáz termodinamikai tulajdonságai mennyire térnek el az ideális gáztól elvártaktól. Úgy lehet elképzelni, mint a valós gáz tényleges térfogatának és az ideális gáz által a tényleges térfogattal azonos hőmérsékleten és nyomáson megjósolt térfogatnak az arányát.
Az ideális gáz esetében a Z értéke mindig 1. A valós gázok esetében az érték pozitív vagy negatív irányban is eltérhet, a gáz intermolekuláris erőinek hatásától függően. Minél közelebb van egy valós gáz a kritikus pontjához vagy a telítési pontjához, annál nagyobbak a gáz eltérései az ideális viselkedéstől.
Az 1. ábra felső ábrája azt mutatja, hogyan változik a kompresszibilitási tényező különböző gázok esetében azonos hőmérsékleten és nyomáson. Az alsó grafikon azt szemlélteti, hogyan változik egy gáz (például metán) összenyomhatósági tényezője adott nyomáson a hőmérséklet függvényében.
Ez a cikk csak a gázok összenyomhatósági tényezőjével foglalkozik, és nem tér ki a folyadékok vagy gőz-folyadék keverékek összenyomhatóságára.
Tartalom
- 1 A gázok összenyomhatósági értékeinek meghatározása
- 1.1 Általánosított összenyomhatósági tényező grafikonok tiszta gázokra
- 1.2 Általánosított összenyomhatósági tényező grafikonok gázkeverékekre
- 1.3 A van der Waals-egyenlet
- 1.3.1 A van der Waals-egyenlet módosított változatai
- 1.3.1.1 Redlich-Kwong
- 1.3.1.2 Soave-Redlich-Kwong
- 1.3.1.3 Peng-Robinson
- 1.3.1 A van der Waals-egyenlet módosított változatai
- 1.4 Viriális állapotegyenlet
- 1.5 Egyéb állapotegyenletek
- 1.6 A gázállandó jelölése
- 2 Hivatkozások
Gázok összenyomhatósági értékeinek meghatározása
Az ideális gáztörvényt a következőképpen határozzuk meg:
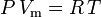
és a nem-idealitással korrigált ideális gáztörvény meghatározása:
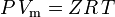
| hol: | |
| P | = nyomás |
|---|---|
| Vm | = a gáz moláris térfogata |
| Z | =. összenyomhatósági tényező |
| R | = egyetemes gázállandó |
| T | = hőmérséklet |
és így:
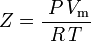
ami a legegyszerűbb és legszélesebb körben használt valós gázállapotegyenlet (EOS). Ennek az állapotegyenletnek a fő korlátja, hogy a gáz összenyomhatósági tényezője, Z, nem állandó, hanem gázonként, valamint a vizsgált gáz hőmérsékletével és nyomásával változik. Kísérleti úton kell meghatározni.
Ahol kísérleti adatok állnak rendelkezésre bizonyos gázokra vonatkozóan, ezek az adatok felhasználhatók a Z és a nyomás függvényében állandó hőmérsékleten, vagy a Z és a nyomás függvényében különböző hőmérsékleteken az adott gázokra vonatkozó grafikonok készítéséhez (mint például az 1. ábrán). Az ilyen grafikonok hasznosak ahhoz, hogy könnyen megkapjuk a Z interpolált értékeit a kísérletileg meghatározott értékek között.
A kompresszibilitási tényező, mint már említettük, a következőképpen is kifejezhető:
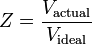
A kompresszibilitási tényezőt három rezsim befolyásolja:
- a Z értéke 1 felé tendál, ahogy a gáznyomás közelít a 0-hoz, ahol minden gáz az ideális viselkedés felé tendál
- a Z értéke köztes nyomáson kisebb, mint 1, mert a molekulák közötti vonzóerők miatt a tényleges térfogatok kisebbek, mint az ideális értékek
- a Z értéke nagyobb, mint 1, és végül a végtelen felé tendál. nagy nyomáson azért, mert a molekulák közötti taszítóerők miatt a tényleges térfogatok nagyobbak az ideális értékeknél
Tiszta gázok általánosított összenyomhatósági tényező grafikonjai
Az összenyomhatósági tényező és a redukált hőmérséklet közötti egyedi összefüggés, Tr, és a redukált nyomás, Pr, közötti kapcsolatot először van der Waals ismerte fel 1873-ban, és a megfelelő állapotok kétparaméteres elve néven ismert. A megfelelő állapotok elve azt az általánosítást fejezi ki, hogy egy gáznak a molekulák közötti erőktől függő tulajdonságai univerzális módon kapcsolódnak a gáz kritikus tulajdonságaihoz. Ez biztosítja a legfontosabb alapot a molekuláris tulajdonságok összefüggéseinek kidolgozásához.
A gázok összenyomhatóságát illetően a megfelelő állapotok elve azt jelzi, hogy bármely tiszta gáznak azonos csökkentett hőmérsékleten, Tr, és azonos csökkentett nyomáson, Pr, azonos összenyomhatósági tényezővel kell rendelkeznie.
A redukált hőmérsékletet és nyomást a következőképpen határozzuk meg:
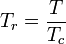 és
és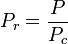
Tc és Pc a gáz kritikus hőmérsékletének és kritikus nyomásának nevezzük. Ezek az egyes gázok jellemzői: Tc az a hőmérséklet, amely felett nem lehet egy adott gázt cseppfolyósítani, Pc pedig az a minimális nyomás, amely egy adott gáz cseppfolyósításához szükséges a kritikus hőmérsékleten. Együttesen határozzák meg egy folyadék kritikus pontját, amely felett az adott folyadék különböző folyékony és gázfázisai nem léteznek.
A valós gázok nyomás-térfogat-hőmérséklet (PVT) adatai tiszta gázonként eltérőek. Ha azonban a különböző egykomponensű gázok összenyomhatósági tényezőit a nyomás függvényében ábrázoljuk a hőmérséklet-izotermákkal együtt (ahogy az 1. ábra alsó ábráján a metán esetében látható), sok grafikon hasonló izoterma-alakot mutat.
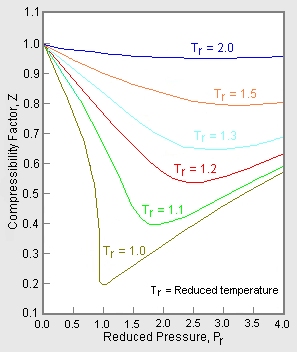
2. ábra: Példa egy általánosított összenyomhatósági tényező grafikonra
Azért, hogy egy olyan általánosított grafikont kapjunk, amely sok különböző gáz esetében használható, a csökkentett nyomást és hőmérsékletet, Pr és Tr, használjuk az összenyomhatósági tényező adatainak normalizálására. A 2. ábra egy példa 10 tiszta gáz, nevezetesen metán, etán, etilén, propán, n-bután, i-pentán, n-hexán, nitrogén, szén-dioxid és gőz több száz kísérleti P-V-T adatpontjából levezetett általánosított összenyomhatósági tényező grafikonjára.
Léteznek részletesebb, általánosított, akár 25 vagy több különböző tiszta gázon alapuló összenyomhatósági tényező grafikonok, mint például a Nelson-Obert grafikonok. Az ilyen grafikonok pontossága állítólag 1-2 százalékon belül van 0,6-nál nagyobb Z értékek esetén, és 4-6 százalékon belül 0,3-0,6 Z értékek esetén.
Az általánosított összenyomhatósági tényező grafikonok jelentősen hibásak lehetnek az erősen poláris gázok esetében, amelyek olyan gázok, amelyeknél a pozitív és negatív töltésközpontok nem esnek egybe. Ilyen esetekben a Z becslése akár 15-20 százalékkal is hibás lehet.
A hidrogén, a hélium és a neon kvantumgázok nem felelnek meg a megfelelő állapotok viselkedésének, és e három gáz redukált nyomását és hőmérsékletét a következő módon kell újra meghatározni, hogy az általánosított grafikonok használata esetén javuljon a kompresszibilitási tényezőik előrejelzésének pontossága:
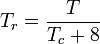 és
és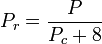
ahol a hőmérsékleteket Kelvin fokban, a nyomásokat pedig atmoszférában adjuk meg.
Általánosított összenyomhatósági tényező grafikonok gázkeverékekre
A tiszta gázokra vonatkozó általánosított összenyomhatósági tényező grafikonok (mint például a 2. ábra vagy a Nelson-Obert grafikonok) gázkeverékekre is használhatók a W. B. Kay által 1936-ban javasolt Kay-szabály alkalmazásával. Ez a szabály egy gázkeverék P-V-T viselkedését úgy jósolja meg, hogy meghatározza a gázkeverék összenyomhatósági tényezőjét csökkentett hőmérsékleten és csökkentett nyomáson, amelyet az álkritikus hőmérséklet, Tpc és az álkritikus nyomás, Ppc alapján határoznak meg, amelyeket a következőképpen határoznak meg:
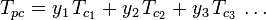
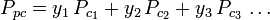
| hol: | |
| Tpc | = a gázelegy pszeudokritikus hőmérséklete |
|---|---|
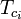 |
= a gázelegy valamely komponensének kritikus hőmérséklete |
| Ppc | = a pszeudokritikus hőmérséklet. gázelegy nyomása |
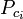 |
= a gáz egyik komponensének kritikus hőmérséklete |
| yi | = a gáz egyik komponensének mol (vagy térfogat) hányadosa |
A pszeudoredukált hőmérséklet, Tpr, és az álredukált nyomás, Ppr, a tiszta gázok általános kompresszibilitási tényezőjének grafikonjaihoz a következők:
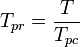 és
és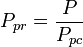
A földgázra (amely szénhidrogén és más gázok keveréke) vonatkozó összenyomhatósági tényező grafikon az interneten elérhető pszeudoredukált hőmérséklet és nyomás használatával.
A van der Waals-egyenlet
A van der Waals-egyenletet 1873-ban dolgozták ki, és a következőképpen fejezhető ki:
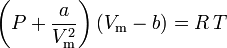
hol:
a a gázmolekulák közötti vonzás erősségének mértékegysége b a gázmolekulák által elfoglalt térfogatot veszi figyelembe, ami csökkenti a rendelkezésre álló nyitott térfogatot
A van der Waals-egyenlet átrendezhető a következőképpen:
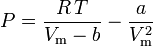
és az összenyomhatósági tényező a következőképpen írható fel:
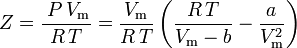
és most már van egy egyenletünk Z meghatározására az a és b van der Waals paraméterek segítségével:
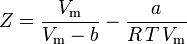
Bár a-t és b-t “Van der Waals-állandónak” nevezzük, ezek nem valódi állandók, mert gázonként változnak; viszont függetlenek a P, V és T értékektől. Más szóval, a vizsgált gázra nézve állandóak. Egy adott gáz kritikus hőmérsékletének és nyomásának ismeretében a és b az adott gázra az alábbi egyenletekből kapható:
 és
és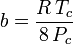
Például az etán kritikus nyomása 4-es.884 MPa, a kritikus hőmérséklet pedig 305,43 K (32,3˚C). Az R 8,3145 Pa m3 K-1 mol-1 egyetemes gázállandóval számolva a fenti egyenletekből a = 0,557 m6 Pa mol-2 és b = 6,500×10-5 m3 mol-1.
Az a és b táblázatos értékei különböző gázokra az említett hivatkozásokban, valamint a szakirodalom számos más forrásában megtalálhatók.
A van der Waals-egyenlet módosított változatai
A kompresszibilitási tényezőknek a van der Waals-állapotegyenlet segítségével történő meghatározása előrelépés az általánosított kompresszibilitási táblázatok használatával szemben. Vannak azonban a van der Waals-állapotegyenletnek olyan módosított változatai, amelyek még nagyobb javulást biztosítanak. A kőolaj-finomítás, a petrolkémiai termelés, a földgázfeldolgozás, a kriogén desztilláció és a kapcsolódó iparágak területén dolgozó mérnökök által talán leggyakrabban használt állapotegyenletek a következők: az 1949-ben kifejlesztett Redlich-Kwong-egyenlet, az 1972-ben kifejlesztett Soave-Redlich-Kwong-egyenlet és az 1976-ban kifejlesztett Peng-Robinson-egyenlet. Ez a három egyenlet lényegében a van der Waals-egyenlet módosított változata. Az összehasonlító egyenletek a következők:
Redlich-Kwong
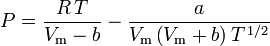
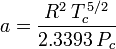 és
és
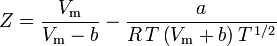
Soave-Redlich-Kwong
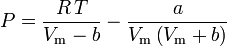
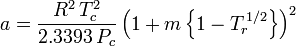 és
és
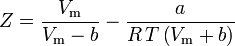
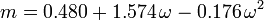
A Soave-Redlich-Kwong és a Peng-Robinson egyenletekben paraméterként használt akcentrikus tényezőt, ω-t először Pitzer és társai vezették be 1955-ben. A következőképpen fejezhető ki:
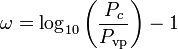
ahol Pvp a gáz telített gőznyomása 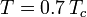 hőmérsékleten.
hőmérsékleten.
Peng-Robinson
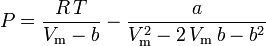
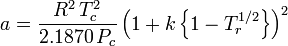 és
és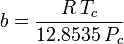
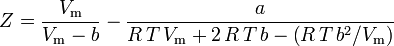
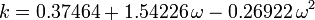
Viriális állapotegyenlet
A legalapvetőbb állapotegyenlet , mivel a legmegalapozottabb elméleti alapokkal rendelkezik, a viriális állapotegyenlet:
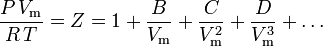
Először 1885-ben Thiesen javasolta empirikus alapon, majd 1901-ben Kamerlingh-Onnes fejlesztette tovább. A B-re vonatkozó statisztikai-mechanikai kifejezést először Ornstein vezette le doktori disszertációjában. Az egyenletet később 1927-ben H.D. Ursell fejlesztette tovább a molekulák közötti erők statisztikai-mechanikai (klaszteres) elemzéséből származó elméleti alapon.
A B, C és D paramétereket második, harmadik és negyedik viriális együtthatónak nevezzük. Az együtthatók nem konstansok, mivel gázonként, valamint a vizsgált gáz hőmérsékletétől függően változnak. Néha B(T), C(T) és D(T) alakban írjuk őket, hogy jelezzük, hogy a hőmérséklet függvényei. Az együtthatók számszerű értékét kísérletileg kell meghatározni.
A második viriális együttható adja a gáz nem ideális viselkedésére vonatkozó korrekció legnagyobb részét. Emiatt a virialis egyenletet néha a második együtthatót tartalmazó kifejezés után csonkolják. Ha azonban a harmadik együttható is rendelkezésre áll, az egyenletet általában a harmadik együtthatót tartalmazó kifejezés után vágják le. A negyedik együttható ritkán áll rendelkezésre.
A tiszta gázokra és gázkeverékekre vonatkozó viriális együtthatók átfogó összeállítását a korábban a Texas A&M University, College Station, Texas, jelenleg pedig a National Institute of Standards and Technology (NIST), Boulder, Colorado székhelyén működő Termodinamikai Kutatóközpont viriális együttható adatbázisából készítették el. Ennek az összeállításnak a legutóbbi változatát 2003-ban tették közzé. A NIST megvásárolható egy szoftverprogram is, a NIST Reference Fluid Thermodynamic and Transport Properties Database (REFPROP), amely tartalmazza a második és harmadik viriális együtthatókat, valamint számos más termodinamikai tulajdonságot.
Egyéb állapotegyenletek
A valós gázok viselkedésének előrejelzésére számos más állapotegyenlet is létezik. Talán a legismertebbek az 1929-ben kidolgozott Beattie-Bridgeman-egyenlet és az 1940-ben kidolgozott Benedict-Rubin-Webb-egyenlet. Ezek általában bonyolultabbak, mint a fent tárgyalt egyenletek.
A gázállandó jelölése
Az ebben a cikkben használt gázállandó az univerzális gázállandó, R, amely minden gázra érvényes. Létezik egy fajlagos gázállandó is, amelyet Rs-ként jelölhetünk, és a következő módon definiálható: Rs = R / M, ahol M a molekulatömeg.
Sajnos a szakirodalomban sok szerző néha az R-t használja fajlagos gázállandóként anélkül, hogy ezt így jelölné, vagy jelezné, hogy ez a fajlagos gázállandó. Ez félreértéshez vezethet és vezet is.
- 1,0 1,1 1,2 1,3 1,4 McQuarrie, Donald A. és Simon, John D. (1999). Molekuláris termodinamika. University Science Books. ISBN 1-891389-05-X.
- 2.0 2.1 2.2 2.3 2.4 Yunus A. Çengal és Robert H. Turner (2004). A termál-áramlástan alapjai, 2. kiadás. McGraw-Hill Professional. ISBN 0-07-245426-1.
- 3.0 3.1 3.2 3.3 3.4 Smith, J.M. et al. (2005). Bevezetés a vegyészmérnöki termodinamikába, hetedik kiadás. McGraw Hill. ISBN 0-07-310445-0.
- 4.0 4.1 4.2 4.3 4.4 4.5 4.6 Y.V.C. Rao (1997). Vegyészmérnöki termodinamika. Universities Press (India). ISBN 81-7371-048-1.
- 5.0 5.1 Gáztörvények (M.J. Mombourquette professzor előadása a kanadai Queens Egyetemen)
- Hong Wei Xiang (2005). A megfelelő állapotok elve és annak gyakorlata: Folyadékok termodinamikai, transzport és felületi tulajdonságai. Elsevier. ISBN 0-444-52062-7.
- IUPAC Goldbook
- Gouq-Jen Su (1946). “A megfelelő állapotok módosított törvénye”. Ipari & Mérnöki kémia 38 (8): 803-806. ISSN 0096-4484.
- 9.0 9.1 Állapotegyenletek (Lyes Kadem professzor, Concordia Egyetem, Kanada)
- 10.0 10.1 Állapotegyenletek (Sanford Klein professzor előadásának anyaga, Wisconsin-Madison Egyetem, USA)
- Richard W. Miller (1996). Áramlásmérési mérnöki kézikönyv, 3. kiadás. McGraw-Hill. ISBN 0-07-042366-0. (Lásd a G-1 ábrát a G.145. oldalon)
- Kai-Fui Vincent Wong (2000). Termodinamika mérnököknek, 1. kiadás. CRC Press. ISBN 0-8493-0232-3. (Lásd A-2. ábra, 278. oldal}
- Nelson-Obert általánosított összenyomhatósági diagramok (Az interneten elérhető diagramok, a San Diego State University, U.S. honlapjáról)
- W.B.Kay (1936). “Gázok és gőzök magas hőmérsékleten és nyomáson – A szénhidrogén sűrűsége”. Industrial Engineering & Chemistry 28:1014. ISSN 0096-4484.
- Yunus A. Çengal és Michael A. Bowes (2005). Termodinamika: An Engineering Approach, 5. kiadás. McGraw-Hill. ISBN 0-07-2884959.
- Valódi gázok (R.M. Price professzor előadásának anyaga a Christian Brothers University-n, U.S.A.)
- A természetes gázok tulajdonságai (Jon Steiner Gudmandsson professzor, Norvég Tudományos és Technológiai Egyetem)
- Robert C. Weast (szerkesztő) (1975). A kémia és fizika kézikönyve, 56. kiadás. CRC Press. ISBN 0-87819-455-X.
- 19.0 19.1 19.2 Chapter 3: Equations of State (pages 6-8 of 65 pdf pages) (Part of PhD dissertation by Ji Lin Wang, 2002, Swinbourne University of Technology, Australia)
- 20.0 20.1 20.2 Jean Vidal (2003). Termodinamika: Alkalmazások a vegyiparban és a kőolajiparban. Editions Technip. ISBN 2-7108-0800-5.
- Zakia Nasri és Housam Binous (2007). “A Soave-Redlich-Kwong állapotegyenlet alkalmazásai a Mathematica segítségével”. Journal of Chemical Engineering of Japan 40 (6): 534-538. Letölthető innen.
- K.S. Pitzer et al (1955). “A folyadékok térfogati és termodinamikai tulajdonságai”. Journal of the American Chemical Society 77: 3427-3440.
- Francis S. Manning és Richard E. Thompson (1991). A kőolaj olajmezei feldolgozása. Pennwell Books. ISBN 0-87814-343-2.
- Acentric Factor Definition (Physical Property Sources Index, PPSI, of the Swiss Federal Institute of Technology Zurich)
- Max F. Thiesen (1885). “Vizsgálatok az állapotegyenletről”. Annalen der Physik und Chemie (24): 467-492.
- Heike Kamerlingh-Onnes (1901). “A gázok és folyadékok állapotegyenletének kifejezése sorozatok segítségével”. Commun. Phys. Lab. Leiden (71).
- S. L. Ornstein (1908) Toepassing der statistische mechanica van Gibbs op molekulair-theoretische vraagstukken (Gibbs statisztikai mechanikájának alkalmazása molekulaelméleti problémákra), Leiden
- H. D. Ursell (1927). “A Gibbs-féle fázisintegrál kiértékelése tökéletlen gázok esetében” (23): 685.
- J. D. Dymond és R. C. Wilhoit (szerzők), K. N. Marsch és M. Fenkel (szerkesztők) (2003). Tiszta gázok és keverékek viriális együtthatói, 1. kiadás. Springer. ISBN 3-540-44340-1.
- NIST Standard Reference Database 23
- J.A. Beattie és O.C. Bridgeman (1929). “A New Equation of State for Fluids” (Egy új állapotegyenlet a folyadékokra). Proc. Amer. Acad. Arts Sci. (63): 229-305.
- M. Benedict, G.B. Webb és L.C. Rubin (1940). “An Empirical Equation for Thermodynamic Properties of Light Hydrocarbons and Their Mixtures”. J. Chem. Phys. 8: 334-335.
| |
Az oldal egyes tartalmai korábban már megjelentek a Citizendiumon. |
Kategória: Fizika