Abstract
A tanulmány célja, hogy kis számú esetre összpontosítva foglalkozzunk az emlő angiosarcomájával, amely az összes lágyrész emlődaganat kevesebb mint 1%-át teszi ki, és végül megosszuk tapasztalatainkat. A manapság standard kezelésnek számító emlő-konzerváló terápia (BCT) következményeként az angiosarcoma egy új típusa került előtérbe: Sugárzás által kiváltott angioszarkóma (RIAS).
Az alábbiakban a RIAS betegek jellemző tulajdonságainak retrospektív elemzését, valamint a 2013 és 2018 között intézményünkben kezelt hat RIAS eset integrált kezeléséről és kimeneteléről szóló beszámolót közöljük.
A mell angioszarkómáját műtét és sugárterápia következményeként ritkán regisztrálták, de az emlőrák sugárkezelésének dokumentált szövődménye, magas kiújulási aránnyal és rossz kimenetellel.
Klinikai, radiológiai és szövettani szempontból továbbra is kihívást jelent, ezért az arra fogékony betegeknél magas gyanúindexre van szükség. Az egyszerű masztektómia az elsődleges kezelési lehetőség, azonban egyre több tanulmány foglalkozik a sugár- és kemoterápia alkalmazásával, mindkettő változó sikerrel. A helyi kontroll fokozása érdekében az ismételt besugárzás is számításba jöhet, míg a kemoterápia az előrehaladottabb stádiumban lévő esetekben jöhet szóba.
Abbreviation
RIAS: Radiation-Induced Angiosarcoma; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: Mágneses rezonancia képalkotás; IMRT:
Keywords
Breast angiosarcoma (AS), Radiation-induced angiosarcoma (RIAS), Radical mastectomy (RM), Radiation-induced tumors, Adjuvant radiotherapy, Intenzitásmodulált sugárterápia (IMRT)
Bevezetés
Ez a munka az emlőrákos betegek kis számában előforduló RIAS diagnózisát, kezelését és kimenetelét tárgyalja.
Az emlő angioszarkómája (AS) nagyon ritka érdaganatként felosztható primer, ha ismert prekurzor nélkül keletkezik, vagy szekunder, ha a korábban besugárzott bőr helyén keletkezik, ebben az esetben az emlő sugárzás által kiváltott angioszarkómájának (RIAS) nevezik . Az angioszarkómák ideális kezelésére vonatkozóan azonban még mindig nem léteznek bizonyítékokon alapuló irányelvek.
Az adjuváns sugárkezeléssel járó emlőkonzerváló műtéten átesett betegeknél a RIAS becsült előfordulása 0,05 és 0,3% között változik, ami az emlődaganatok kevesebb mint 1%-át és az összes lágyrészszarkóma körülbelül 3%-át teszi ki.
A RIAS előfordulása növekedni látszik, ami talán azt tükrözi, hogy az emlőrák adjuváns sugárterápiájának széles körű elterjedését követően e daganatok kialakulásának hosszú látenciaideje van.
A mell RIAS diagnózisa gyakran késik, mivel jóindulatúnak tűnik, és nehéz megkülönböztetni a korábbi sugárzás vagy más betegség által kiváltott nem specifikus bőrelváltozásoktól . A radiológiai leletek szintén gyakran nem specifikusak. Bár a RIAS jellemzően 10 évvel az emlőrák sugárkezelése után alakul ki, a lappangási idő 6 hónaptól 20 évig terjedhet , ami egyes szerzők szerint valószínűleg aluljelentett, és ezért a valódi előfordulási arányok magasabbak. Mivel az emlőrák előfordulási gyakorisága növekszik, a radikális masztektómiát mint standard kezelést felváltotta a mellkímélő műtét és az azt követő sugárterápia alkalmazása. A RIAS kapcsolódó incidenciája is növekszik, a becsült kumulatív incidencia 1000 emlőrákos esetre vetítve 0,9-3,2 . Egy nagy populáción alapuló kohorszvizsgálatban az emlőrák kezelésére alkalmazott korábbi sugárterápia 26-szoros kockázatnövekedéssel járt az angioszarkóma kialakulásának kockázatában a nem besugárzott kontrollcsoportokhoz képest . A RIAS-ban szenvedő betegek prognózisa továbbra is rossz, az 5 éves teljes túlélési arány 27 és 48% között mozog. Annak ellenére, hogy a RIAS-t először az 1920-as évek elején írták le, molekuláris biológiája még mindig ellentmondásos, és ezért nem áll rendelkezésre célzott terápia.
Jelenleg általában az agresszív sebészi reszekciót javasolják a választott kezelésként. Hiányoznak az adjuváns kemoterápia hatékonyságát bizonyító adatok .
A sebészeti beavatkozás, széles kimetszés vagy masztektómia formájában, a lokalizált betegség kezelésének fő pillére. Egyes tanulmányok összefüggésről számoltak be az R0 margók és a jobb túlélési arány között, bár nem bizonyított, hogy ez független más biológiai tényezőktől, például a tumor méretétől . Van némi bizonyíték arra, hogy a neoadjuváns kemoterápia javíthatja az eredményeket az angioszarkóma kezelésében, amelynek ritkasága miatt ismereteinket esetjelentésekre vagy kis retrospektív esetsorozatokra korlátozzák .
A kórházunkban 5 éven keresztül kezelt, RIAS-ban szenvedő betegek populációjának jellemzésére retrospektív vizsgálatot végeztünk, amelyben elemeztük a mammográfia, az ultrahang és a mágneses rezonanciás képalkotás (MRI) hasznosságát a diagnózisban .
Munkánkat a SCARE kritériumoknak megfelelően jelentettük .
Anyagok és módszerek
Az esetsorozatunk a 2013 és 2018 között emlőrák sugárkezelését követően kialakult, szövettanilag igazolt emlő angioszarkómában szenvedő betegekre vonatkozik, és multidiszciplináris megközelítéssel elemzi a kezelési stratégiákat.
Az érintett betegek, hat nőbeteg, akiknek sugárkezeléssel kiváltott emlő angioszarkómája volt, a fent említett időszakban intézményünk, a cataniai egyetemi kórház rákregiszterében végzett átfogó keresés révén kerültek azonosításra. Az átlagéletkor 70 év volt, tartomány: 59-79 év. A betegek a korábbi diagnosztikus és terápiás kezelést különböző intézményekben végezték, így nem minden információ áll rendelkezésre. A betegek jellemzőinek és a RIAS diagnózist követően elvégzett kezelési eljárások leírását az 1. táblázat tartalmazza. A diagnózis felállításakor valamennyi beteg emlő-konzerváló kezelésen esett át, az adjuváns sugárterápiát hagyományos 3 dimenziós konformális sugárterápiával adták 50 Gy összdózisban, napi 2 Gy frakcionálással, 10 Gy tumorágy-növeléssel vagy anélkül. A daganat 3 betegnél jobb oldali, a másik 3 betegnél bal oldali volt. Az adjuváns kezelés során a hat betegből öt antraciklin alapú szisztémás kemoterápiában részesült az intézményi irányelveknek megfelelően, míg valamennyi beteg adjuváns tamoxifen/aromatázgátló hormonterápiában részesült. A diagnózis felállításakor egyetlen betegnek sem volt HER2-pozitív rákja.
A követés során, 7,6 év medián (tartomány: 5-11 év) után, az ipsilaterális emlő angioszarkóma diagnózisára került sor: a betegek által a megjelenéskor leggyakrabban mutatott jelek a besugárzási mezők környezetében elhelyezkedő, vörös-ibolya színű bőrcsomók voltak, amelyek növekedési üteme mérsékelten változó volt, néhány héttől 4-6 hónapig. Minden betegnél szövettanilag igazolták a másodlagos angioszarkóma fennállását, és minden esetben radikális masztektómiát végeztek. A RIAS diagnosztizálásához a Cahan és Arlen kritériumokat követték: a korábban besugárzott területen belül kialakuló szarkóma; a sugárkezelés és a szarkóma kialakulása között legalább 3 év látenciaidő; és a másodlagos szarkóma és az elsődleges daganat szövettani elkülönítése. Mind a hat betegnél teljes radiológiai vizsgálatot végeztek mammográfiával, ultrahanggal és MR-rel (4/6 betegnél), hogy megpróbálják megerősíteni a RIAS klinikai gyanúját, de nem azonosítottak patognomikus jellemzőket. A tudományos irodalom növekvő érdeklődése a “sugárzási szignatúra” sajátos jellemzőinek azonosítása iránt még nem hozott konszolidált adatokat. Az esetsorozatunkban kiemelt hat beteg közül három esetében immunhisztokémiai vizsgálatot végeztek a MYC-expresszió értékelésére, amely az ilyen betegeknél magas expressziót mutatott. Az 1. táblázat a tumor szövettani jellemzőit is közli. A RIAS diagnózis időpontjaként a szövettani diagnózis felállításának napját határoztuk meg. A latenciaidőszakot az első sugárkezeléstől a RIAS diagnózis felállításának időpontjáig eltelt időnek tekintettük. A RIAS diagnózisakor csak egy betegnél mutattak ki szinkron metasztázisokat (a tüdőben), míg a többi öt betegnél csak emlőbetegség volt.
1. táblázat: A betegek jellemzői és a kezelési eljárások. 1. táblázat megtekintése
Kórházunkban műtétre kerülő betegek mindegyikét szarkóma multidiszciplináris értekezleten beszéltük meg a műtét előtti fázisban. A betegeket reszekábilis betegségnek minősítettük, ha a műtét előtti értékelés azt jelezte, hogy 2 cm-es vagy annál nagyobb negatív margó érhető el műtéttel, plasztikai sebészeti rekonstrukcióval vagy anélkül, egyetlen pedikális vagy szabad myocutan lebeny formájában. Ha a kívánt negatív margó kiterjedtebb rekonstrukciót igényelt, például nagyméretű bőrátültetéssel történő kiterjedt újrafelszínre hozással, akkor a beteget irreceszibilis betegségnek minősítették.
A gyorsan progrediáló betegséget, amikor a betegség volumene 2-3 hét alatt növekedett az önmagában vagy pedikuláris lebennyel kombinált masztektómiára alkalmas állapotból a kiterjedtebb rekonstrukciót igénylő állapotba, onkológiai szempontból szintén irreceszibilisnek ítélték.
Az AS jelenlétének megerősítésére és más betegségek kizárására preoperatív biopsziát végeztek.
A makroszkóposan teljes reszekciót az operáló sebész tekintette teljesnek. Histológiailag a reszekciót R0-nak (mikroszkóposan negatív) minősítették, ha a negatív margó körkörösen több mint 1 cm volt, vagy R1-nek (mikroszkóposan pozitív), ha a tumor a reszekciós peremig vagy 1 cm-nél kisebb területen belülre terjedt.
Négy beteget azonnali újrasugárzásra vettek fel, míg egy beteget 13 hónap után kezeltek, amikor parietális relapszus lépett fel (ő elutasította az azonnali újrasugárzást), az utolsó beteget kizárták az újrasugárzásból, mivel az előző kezelés során elérte a szívre vonatkozó dózishatárt. Az adjuváns kemoterápia alkalmazásáról eseti alapon döntöttek, a korábbi kezelésekkel és a betegek teljesítményállapotával kapcsolatban rendelkezésre álló adatok alapján. Egy beteg négy ciklus epirubicin-ifoszfamid kemoterápiát kapott, egy beteg hat cikluson keresztül csak epirubicint, három beteget orvosi okokból (életkor, társbetegségek vagy az antraciklinek már korábban elért tolerancia-dózisa) kizártak. Egy beteg 12 cikluson keresztül hetente paclitaxelt kapott szinkron tüdőáttétek miatt.
A sugárterápiát a korábbi besugárzás és az antraciklinek korábbi adagolása során az egészséges szövetekből kapott dózisok figyelembevételével adták. Ezen okok miatt úgy döntöttünk, hogy az ismételt besugárzást intenzitásmodulált sugárterápiával (IMRT, lásd 1. ábra) végezzük, step-and-shoot technikával, intézményi eljárásainknak megfelelően . Az alkalmazott sugárdózis és frakcionálási séma eltérő volt: két beteg 50 Gy hagyományos frakcionálásban részesült, két beteg 40 Gy-t kapott (mivel az előző besugárzás óta eltelt idő rövid volt, és a daganat a bal emlőn helyezkedett el), egy beteg 35 Gy-t kapott heti egyszeri 5 Gy frakcióban (a csökkent klinikai compliance miatt).
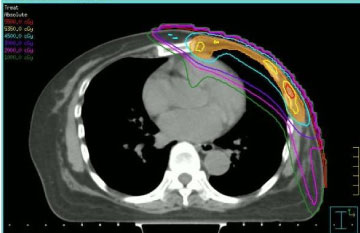 1. ábra: Transzverzális CT-kép a step-and-shot intenzitásmodulált dóziseloszlással. Az 1. ábra megtekintése
1. ábra: Transzverzális CT-kép a step-and-shot intenzitásmodulált dóziseloszlással. Az 1. ábra megtekintése
Eredmények
Nem jelentettek pozitív margókat azoknál a betegeknél, akik ugyanazon sebészcsoport által végzett radikális masztektómiában részesültek.
A radikális masztektómiát követően a betegek a tervezett módon, megszakítás nélkül részesültek kezelésben, mind a kemoterápia, mind a sugárterápia tekintetében. A 22 éves (tartomány: 1,5-4 év) medián követési idő alatt három beteg él, visszaesés vagy progresszív betegségre utaló jelek nélkül. Egy beteg, akinek a diagnózis felállításakor szinkron tüdőmetasztázisai voltak, még mindig aktív onkológiai kezelésben részesül. Egy betegnél tüdő- és csontmetasztázisok alakultak ki, de a munka benyújtásakor még életben van. Az utolsó két betegnél tüdőáttétek alakultak ki, amelyek közül az egyik helyi kiújulással társult, és 8-10 hónap után meghaltak (a betegek jellemzőinek megoszlását a betegség megjelenésével és a kapott kezeléssel kapcsolatban az 1. táblázat tartalmazza). Összességében a RIAS diagnózisakor szisztémás betegséggel nem rendelkező öt beteg esetében a betegségmentes túlélés 14 hónap volt, míg a szinkron áttétes beteg esetében a progressziómentes túlélés 12 hónap volt.
Amint az várható volt, az irodalomban közölt rosszabb túlélési eredményeket a műtéti kezelésre alkalmatlan, lokálisan előrehaladott betegséggel jelentkező betegeknél észlelték a mi sorozatunkban szereplő esetekhez képest. Ezek a tényezők rávilágítanak a korai diagnózis fontosságára a RIAS-betegek esetében. Az angioszarkómák gyakran alattomosan, lila vagy vörös bőrelváltozásokkal jelentkeznek, és könnyen összetéveszthetők véraláfutásokkal vagy jóindulatú bőrelváltozásokkal, ami késedelmes kivizsgáláshoz és diagnózishoz vezet. A korai felismerés és az azonnali beutalás potenciálisan csökkentheti az irrezekábilis betegséget mutató betegek számát, és javíthatja mind a helyi, mind a távoli betegség kontrollját.
Diszkusszió
A sugárzás által kiváltott tumorok jellemzően a besugárzási mező kontextusában vagy szélén keletkeznek, ahol a dózis nem egyenletes, és a sejtpusztulás kiváltásához szükségesnél alacsonyabb dózist eredményezhet, vagy olyan mutációkat okozhat, amelyek a karcinogenezis folyamatához vezethetnek. Az ionizáló sugárzás hatásaként az élő szervezetekben indukált kémiai és biokémiai módosulások a sejtek biológiai károsodást okozó funkcionális és morfológiai elváltozásait eredményezik. Minden szaporodásra képes sejt potenciálisan rákossá válhat; ha a kromoszóma-módosulásokat mutató sejtek kikerülnek a normális sejtkontroll alól, karcinogenezis léphet fel.
A daganatok kialakulásának valószínűsége az emlőrák kezelésére alkalmazott sugárterápiában részesülő betegeknél nagyon alacsony, és nem korlátozhatja a sugárterápia alkalmazását, ha az javallt. Az 50 Gy feletti sugárdózisok sejthalált idéznek elő, az alacsonyabb dózisok pedig (
Néhány tanulmány utal arra, hogy összefüggés van a lágyrészszarkómák kialakulása és az emlődaganatok kezelésére végzett sugárkezelések között. A sugárkezelés növeli a lágyrészszarkómák és különösen az angioszarkóma kialakulásának kockázatát . A RIAS megközelítőleg az emlődaganatok kevesebb mint 1%-át teszi ki . A radioindukált angioszarkómának számos klinikai megnyilvánulása van: a betegek gyakran tünetmentes bőrelváltozásokat mutatnak, amelyeket alig lehet megkülönböztetni a gyakori aktinikus elváltozásoktól, amelyek az emlő sugárterápiás kezelését követően találhatók. A betegek gyakran tapintható duzzanatot, vérömlenyhez hasonló lilás-vöröses területet mutatnak. Az angioszarkómák összetéveszthetők az olyan jóindulatú megnyilvánulásokkal, mint az angiomák vagy az atípusos telangiektázia. Lila papulák vagy erythemás csomók is előfordulhatnak.
Minden terápiás erőfeszítés ellenére az ötéves túlélési arány 27% és 62,8% között változik (2-3). Bár a RIAS jellemzően 10 évvel az emlőrák sugárkezelése után alakul ki, a lappangási idő 6 hónaptól 20 évig terjedhet. A radioindukált angioszarkóma megkülönböztethetetlen a spontán angioszarkómától, de néhány különbség megállapítható: Lae és munkatársai összehasonlították a 8q24.21 kromoszómán lévő c-myc amplifikációt 32 RASB-mintában és 15 sporadikus angiosarcoma-mintában .
Sorozatunkban a betegeknél a betegség nem specifikus jeleit tapasztalták, de a diagnózist az esetek többségében azonnal felállították. A lappangási idő összhangban volt az irodalomban közöltekkel, a medián idő 76 év volt.
ARIAS-ról ismert, hogy magas a kiújulási aránya. A helyi kiújulás, akár a tumorágyban, akár a műtéti heg mentén, a jelentések szerint a RIAS-esetek többségében (96%) kimutatható. Ez valószínűleg a RIAS multifokális növekedésének vagy a rosszindulatú szövetek műtét utáni maradványainak köszönhető, még negatív műtéti határ esetén is. A metasztatikus betegség, leggyakrabban a tüdőbe és a májba, egyidejűleg vagy röviddel a helyi kiújulások után jelen lehet . Abbott és munkatársai visszamenőlegesen áttekintették a 2017-ig közzétett összes RIAS esetet, és összefoglalták az adatokat . A szerzők megállapították, hogy a helyi kiújulási arány 59% volt, és a kiújulásig eltelt idő mediánja 6 hónap (tartomány: 1-78 hónap). Azt is megállapították, hogy az áttétes megbetegedést általában legalább egy helyi kiújulás előzte meg, és hogy a leggyakoribb lokalizáció a tüdő, a kontralaterális emlő és a csontváz volt. Továbbá 42 eset szövettani áttekintése arra utalt, hogy a rosszul differenciált RIAS magas áttétképződési kockázattal járt, míg a jól differenciált tumoroknál inkább a helyi kiújulás, mint a távoli áttétek kockázata volt nagyobb.
A sugárzás indukálta szarkóma ritka, de rendkívül agresszív daganat. Kezelése vita tárgyát képezi, mivel nem állnak rendelkezésre kezelési irányelvek, a prognózis rossz és az 5 éves túlélési arány széles skálán mozog, amint arról korábban beszámoltunk . Ennek ellenére általában az agresszív sebészi reszekciót javasolják a választott kezelésként.
A lokalizált betegséget mutató betegeknél a sebészi beavatkozás – mastectomia formájában, plasztikai rekonstrukcióval vagy anélkül – a választott kezelés. A kezelés alatt álló betegsorozatokban több mint 80%-ban mikroszkóposan teljes (R0) reszekciós margót lehet elérni. A RIAS jellemzően multifokális elváltozásként jelentkezik. E patológiának a mikroszatellita lerakódásokra való hajlama hozzájárulhat a helyi kontroll elérésének nehézségéhez.
A teljes patológiai reszekció elvégzésének fontosságát hangsúlyozza a szakirodalom, bár az ajánlott tisztítási távolságra vonatkozóan nem jelentek meg egységes irányelvek. A jelenlegi sorozatban azoknál, akiknél helyi kiújulás alakult ki, szorosabb margókat találtak, mint azoknál, akiknél nem alakult ki. A margóstátusz azonban ebben a sorozatban nem bizonyult az onkológiai kimenetel független prognosztikus tényezőjének. Ez arra utal, hogy a nagyobb margók elérésének képessége más, a kimenetelt szintén meghatározó biológiai tumortényezőktől, például a mérettől függ. Valószínű, hogy a tumor biológiája felelős elsősorban a kimenetelért a RIAS-ban, bár a kezdeti műtétnek a makroszkópos tisztaságra kell törekednie, figyelmeztetni kell arra, hogy a nagyobb negatív marginalitás elérése nem feltétlenül egyenlő a betegek jobb kimenetelével.
A kemoterápiára és a sugárkezelésre összpontosító, akár neoadjuváns, akár adjuváns vizsgálatok növekvő száma ellenére ezek szerepe továbbra sem egyértelmű. Az adjuváns kemoterápia hatékonyságát bizonyító adatok hiányoznak, a legújabb adatok azt sugallják, hogy a sugárterápia hasznos lehet a kiújulások megelőzésében . A műtétet követő adjuváns sugárterápia Johnstone és munkatársai szerint jobb helyi kontrollt tesz lehetővé . Az IMRT szerepe a mellkasfal kezelésében jelenleg értékelés alatt áll, mivel a veszélyeztetett szervek (OAR) besugárzásának csökkentésével csökkentheti a sugárfertőzés előfordulási arányát. Egy dozimetriai összehasonlító vizsgálatban a szerzők arról számolnak be, hogy a mellkasfalra és a célpontra vonatkozó IMRT-terv a hagyományos kezelésekhez képest lehetővé teszi a maximális dózis csökkentését, a minimális dózis növelését, így a céltérfogat jobb megfelelőségét és egyenletességét eredményezi .
A kemoterápia szerepe és hatékonysága nem bizonyított, mivel a rendelkezésre álló adatok kis méretű mintacsoportokból származnak, amelyekből nem lehet határozott következtetéseket levonni, de valószínűleg a magasabb malignitási fokú, G3-as és kiújult betegek profitálhatnak leginkább a neo- vagy adjuváns kemoterápiából .
A neo/adjuváns kemoterápia alkalmazása szintén jobb helyi betegségkontrollal járt együtt egy nagy retrospektív sorozatban, amely sugárkezeléssel indukált szarkómás betegeket tartalmazott, bár nem járt együtt a szisztémás relapszus vagy a túlélés javuló arányával . Az adjuváns kemoterápia nem bizonyult előnyösnek a helyi kontroll vagy az általános túlélés szempontjából a műtéttel és sugárkezeléssel kezelt nagy kockázatú lágyrész-szarkómák vizsgálatában . Így korlátozott bizonyíték van arra, hogy a neo/adjuváns kemoterápia túlélési előnyt jelent a RIAS-ban, bár a műtétet megelőző indukciós terápiaként mindenképpen hasznos lehet azoknál, akiknél a betegség lokálisan előrehaladott, és emellett a betegek számára hatékony betegség-palliációt biztosíthat. A célzott terápiák alternatív kezelést nyújthatnak a progresszív betegségben szenvedő betegeknél.
Sorozatunkban a daganat helyi kiújulására való nagyfokú hajlam miatt úgy döntöttünk, hogy egy beteg kivételével a fent említett dozimetriai problémák miatt minden betegnek második besugárzást javasolunk. Egy beteg visszautasította az azonnali ismételt besugárzást, és a kezelést a visszaeséskor végeztük el. A korábban alkalmazott besugárzási dózisok tekintetében a minta heterogenitása, az egyik esetben a rossz klinikai megfelelés, és mindenekelőtt az irodalom és az irányelvek egyértelmű útmutatásainak hiánya miatt nem lehetett minden beteg számára homogén sugárkezelést programozni. Mindenesetre úgy döntöttünk, hogy a kezelést intenzitásmodulált technikával végezzük, hogy lehetővé tegyük a megfelelő dóziseloszlást, a környező egészséges szövetek, különösen a tüdőparenchima és a szív dózisterhelésének csökkentését.
Következtetések
A mellrák kezelésében alkalmazott sugárterápia a későbbi szarkóma kialakulásának fokozott kockázatával jár, de a kockázat aránya nagyon alacsony.
Az MRAS ritka, agresszív lágyrész-elváltozás, korlátozott kezelési lehetőségekkel és a helyi és szisztémás relapszus magas arányával.
Az adjuváns sugárterápiát követően gondos megfigyelésre van szükség. A standard kezelés egyszerű masztektómiával és adjuváns sugárterápiával járó műtét. A kemoterápiának szerepe lehet a lokálisan előrehaladott betegség visszaszorításában, bár nincs bizonyított hatása a túlélésre.
Az angiosarcoma jelentősen gyakoribb a sugárterápiával kezelt esetekben, különösen a sugárzási mezőben vagy annak szomszédságában fordul elő. A sugárterápiában részesülő emlőrákos betegek esetében a későbbi szarkóma kockázatában mutatkozó csekély különbség nem írja felül a sugárterápia előnyeit.
A sorozatunk azonban túl kicsi ahhoz, hogy végleges következtetéseket vonjunk le, és ez a vizsgálat egyik korlátja. További értékelésre van szükség, nagyobb számú esettanulmányon keresztül is, a patológia jobb osztályozása és a pontosabb multidiszciplináris kezelés lehetővé tétele érdekében.
Érdekütközések
A szerzők egyikének sincs semmilyen összeférhetetlensége, amelyet nyilvánosságra kellene hozni.
Finanszírozási források
Nincs.
Etikai jóváhagyás
A Cataniai Egyetem etikai bizottsága adta meg az engedélyt.
Tájékoztatott beleegyezés
A beteg írásos beleegyezését a jelen esetismertetés és a kísérő képek közzétételéhez beszereztük. Az írásbeli beleegyezés egy példánya kérésre a folyóirat főszerkesztője rendelkezésére áll.
A szerzők hozzájárulása
Trovato Agata: A cikk átnézése és szerkesztése.
Kutatási tanulmányok regisztrálása
Nincs.
Tájékoztatás
A szerzőknek nincs mit nyilvánosságra hozniuk.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Primary and secondary angiosarcoma of the breast. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Long-term outcomes in patients with radiation-associated angiosarcomas of the breast following surgery and radiotherapy for breast cancer. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma: a large-scale single-institution review. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Cutaneous radiation-associated angiosarcoma of the breast: poor prognosis in a rare secondary malignancy. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Clinical management of secondary angiosarcoma after breast conservation therapy. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Radiation-induced sarcoma of the breast: a systematic review. Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) A lágyrészszarkóma fokozott kockázata sugárkezelés után emlőrákos nőknél. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Radiation-associated angiosarcoma after breast cancer: high recurrence rate and poor survival despite surgical treatment with R0 resection. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Surgical management of radiation-induced angiosarcoma after breast conservation therapy. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Lokalizált angioszarkómák: prognosztikai tényezők azonosítása és a kezelés hatásának elemzése. A French Sarcoma Group (GSF/GETO) retrospektív elemzése Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Thalidomide combined with neoadjuvant chemotherapy in angiosarcoma of the breast with complete pathologic response: case report and review of literature. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Neoadjuváns kemoterápia primer cutan/soft tissue angiosarcoma esetén: a tumor viselkedésének meghatározása a sebészi reszekció előtt. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Contralateralis nyirokcsomó-metasztázis egy új primer emlőrákos nőnél: Szisztémás desease vagy lokoregionális diffúzió? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement: Konszenzuson alapuló sebészeti esetjelentési irányelvek. Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Secondary sarcomas after radiotherapy for breast cancer: sustained risk and poor survival. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) Can c-myc amplification reliably discriminate postradiation from primary angiosarcoma of the breast? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiosarcoma of the breast following surgery and radiotherapy for breast cancer. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angioszarkóma emlőmegőrző terápia után. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Dosimetric evaluation of integrated IMRT treatment of the chest wall and supraclavicular region for breast cancer after modified radical mastectomy. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstim for resected soft-tissue sarcoma (EORTC 62931): a multicentre randomized controlled trial. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Breast tuberculosis cases rising in Sicily. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Role, timing and technique of radiotherapy in pediatric pleuropulmonary synovial sarcoma. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Intensity-modulated radiotherapy for relapsed malignant pleural mesothelioma. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Single-institution experience of intensity-modulated radiotherapy for malignant pleural mesothelioma at University of Catania. Future Oncol 14: 17-21.
Citation
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) A Single Institution Study Experience of Secondary Breast Angiosarcoma after Breast Conserving Treatment: Multidiszciplináris kezelés. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114
.