Apoptosis

Apoptosis, of geprogrammeerde celdood, is een zeer gereguleerde manier voor een organisme om selectief cellen te elimineren. Dit proces speelt een belangrijke rol bij de embryogenese, het handhaven van de grootte van een organisme en het elimineren van beschadigde of afwijkende cellen. Het belang van apoptose voor de menselijke gezondheid wordt onderstreept door de vele ziekten die het gevolg zijn van afwijkende apoptose. Ontregeling van apoptose is in verband gebracht met verschillende vormen van kanker, neurologische en cardiovasculaire aandoeningen, en auto-immuunziekten.
Wij maken gewoonlijk onderscheid tussen twee verschillende soorten apoptose: de intrinsieke route, gemedieerd door mitochondriën in reactie op interne stimuli zoals DNA-beschadiging, en de extrinsieke route, gemedieerd door extracellulaire doodsreceptoren (bijvoorbeeld binding van FasL aan de FasLG-receptor) (figuur 1). Beide wegen berusten op proteasen, initiator-caspasen genaamd, die een cascade van effector-caspasen activeren, hetgeen tot apoptose leidt. De wisselwerking tussen de intrinsieke en extrinsieke routes verloopt via de op het BH-3-interactiedomein doodsagonist (Bid).
De intrinsieke route (figuur 1) wordt geïnitieerd door Bcl-2 homologie-eiwitten. In de klassieke apoptoseweg worden de Bcl-2-eiwitten Bax en Bak geactiveerd als reactie op interne stimuli zoals DNA-schade of oxidatieve stress. Deze twee eiwitten interageren vervolgens met Bid en worden opgenomen in de buitenste mitochondriale membraan. Dit resulteert in wat wordt beschouwd als het “point of no return” in apoptose – mitochondriale permeabilisatie van de buitenmembraan (MOMP). MOMP leidt tot het vrijkomen van pro-apoptotische factoren zoals cytochroom c in het cytoplasma. Cytochroom c in het cytoplasma bindt APAF-1 en dATP om pro-caspase- 9 te rekruteren, waardoor het apoptosoom wordt gevormd. Apoptosoomvorming leidt tot splitsing van pro-caspase-9 in zijn actieve proteasevorm, caspase-9. Caspase-9 is een initiator-caspase die vervolgens downstream-effector-caspases, zoals caspase-3 en -7, activeert door proteolyse, waardoor de caspascade in gang wordt gezet die tot apoptose leidt.
Fig. 1. Apoptosewegen.
De extrinsieke weg wordt in gang gezet door de binding van liganden aan doodsreceptoren. Na binding van liganden oligomeriseren de doodsreceptoren en rekruteren adaptoreiwitten zoals FADD. Dit maakt rekrutering mogelijk van pro-caspase-8, de inactieve vorm van initiator-caspase-8, en de vorming van het dood-inducerende-signaleringscomplex (DISC). Pro-caspase-8 oligomeert en wordt gesplitst in zijn actieve vorm, caspase-8, die op zijn beurt effector-caspase-3 splitst en activeert. Caspase-3 activeert op zijn beurt proteolytisch diverse andere caspasen, hetgeen tot apoptose leidt. In sommige gevallen kan activering van de extrinsieke route ook leiden tot activering van de intrinsieke route, gemedieerd door Bid.
Apoptose is te onderscheiden van ongeprogrammeerde celdood/necrose. Necrose is een ongereguleerd proces dat wordt geïnitieerd door schade van buitenaf en verschilt op verschillende belangrijke punten van apoptose (tabel 1). Naarmate wij echter meer over apoptose en necrose te weten zijn gekomen en nieuwe mechanismen van celdood, zoals necroptose, hebben ontdekt, zijn de grenzen tussen apoptose en necrose vager geworden. De in tabel 1 geschetste onderscheidende kenmerken zijn echter nog steeds nuttige richtlijnen.
Tabel 1. Kenmerken van apoptose en necrose.
| Apoptose | Necrose |
| Cellen krimpen | Cellen zwellen |
| Phagocyten/macrofagen slokken cellen op | Cel puin komt vrij |
| Proces is niet-inflammatoir | Proces is inflammatoir |
Het is nuttig om dit proces in stadia te verdelen bij het analyseren van apoptose:
- Apoptose wordt geïnitieerd en signaalcascades worden geactiveerd
- Cellen krimpen en ronden af, gemedieerd door caspases
- Organellen veranderen van vorm en membranen beginnen te blebben
- Nucleaire condensatie begint
- DNA fragmentatie kan worden waargenomen
- Apoptotische lichamen worden gevormd
- Apoptotische lichamen worden gefagocytoseerd
Deze apoptotische stadia, samen met de bekende mediatoren van apoptose, kunnen worden gebruikt als identificatiemiddelen voor apoptose. Bij het kiezen van een apoptose assay, na te denken over welke vraag je zou willen stellen – caspase activiteit assays zijn uitstekende indicatoren van apoptose initiatie, terwijl DNA-fragmentatie assays kunnen worden gebruikt om cellen te identificeren in de late stadia van apoptose, wanneer ze onomkeerbaar zijn gepleegd aan geprogrammeerde celdood.
Bij het uitvoeren van apoptosetests is het altijd verstandig levensvatbaarheidskleurstoffen zoals propidiumjodide (PI) toe te voegen om apoptotische cellen van necrotische cellen te onderscheiden en cellen of weefsels onder de microscoop visueel te inspecteren op de belangrijkste morfologische indicatoren van apoptose.
Assessing Apoptosis
1. Morfologische veranderingen
Live cell time lapse imaging kan worden gebruikt om apoptose in real time te volgen en is bijzonder nuttig voor het identificeren van membraan blebbing. Voor weefsels kan transmissie-elektronenmicroscopie worden gebruikt om veel van de structurele veranderingen die gepaard gaan met de stadia van apoptose te identificeren. Weefsels kunnen ook worden gekleurd met hematoxyline en eosine om macrofagen te visualiseren die apoptotische cellen hebben opgeslokt. Acridine oranje (AO) is een andere kleurstof die vaak wordt gebruikt om apoptotische cellen te visualiseren. Deze populaire levensvatbaarheids- en proliferatiekleurstof kan worden gebruikt om apoptose te beoordelen omdat zijn emissiespectrum naar oranje verschuift wanneer het in het zure lysosoommilieu is; dit maakt de kleurstof nuttig voor het identificeren van opgeslokte apoptotische cellen. DNA-bindende kleurstoffen zoals DAPI, Hoechst, propidiumjodide (PI) en 7-AAD kunnen worden gebruikt om nucleaire blebbing te visualiseren, terwijl celkrimp kan worden gedetecteerd in een flowcytometer als een vermindering van de voorwaartse verstrooiing (FSC) of visueel met behulp van lichtmicroscopie.
2. Veranderingen in de mitochondriale membraanpotentiaal
Veranderingen in de membraanpotentiaal geven aan dat een cel het “point of no return” heeft gepasseerd en zich nu op apoptose heeft vastgelegd. Een ineenstorting van het mitochondriaal membraanpotentiaal kan worden gedetecteerd met flowcytometrie of immunofluorescentie met gebruikmaking van potentiometrische kleurstoffen.
Tetramethylrhodamine ethylester (TMRE), Tetramethylrhodamine methylester (TMRM), en JC-1 zijn veelgebruikte potentiometrische kleurstoffen. TMRE en TMRM aggregeren in de mitochondriën van niet-apoptotische cellen en fluoresceren helder oranje of rood. In apoptotische cellen met een verlaagd mitochondriaal membraanpotentiaal worden deze kleurstoffen in hun monomere vorm in het cytoplasma aangetroffen en vertonen zij een gereduceerde rode fluorescentie. De kleurstoffen kunnen worden gebruikt in combinatie met fluorofoorgelabelde inhibitor van caspase-assays (FLICA) (zie volgende sectie) om apoptotische cellen te identificeren op basis van twee kenmerken: afbraak van mitochondriaal membraanpotentiaal en caspase-activering (figuur 2).
Fig. 2. Detectie van mitochondriale membraanpotentiaal reductie en caspase activering door flowcytometrie. Gelijktijdig verlies van oranje fluorescentie van TMRM en toename van groene fluorescentie, die caspase-activering toont zoals gemeten door de FAM-FLICA Polycaspase Kit, toont apoptotische cellen (kwadrant rechtsonder).
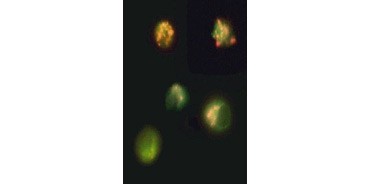
Fig. 3. Afbraak van mitochondriaal membraanpotentiaal gevisualiseerd met JC-1. Jurkat cellen werden gekleurd met MitoPT JC-1. Niet-apoptotische cellen (boven) vertonen rood-gekleurde mitochondriën, terwijl cellen in verschillende stadia van apoptose vertonen groene cytoplasmatische fluorescentie.
JC-1 aggregeert ook in mitochondriën van niet-apoptotische cellen en wordt diffuus door de cel in apoptotische cellen. In tegenstelling tot TMRE en TMRM , die een verminderde fluorescentie vertonen, verandert JC-1 van kleur, van rood naar groen. Hierdoor kan gemakkelijk onderscheid worden gemaakt tussen niet-apoptotische rood fluorescerende cellen en apoptotische groen fluorescerende cellen (figuur 3). Deze assays kunnen worden afgelezen met behulp van fluorescentiemicroscopie, een flowcytometer, of een geschikt uitgeruste microplate reader.
3. Caspase activering
Fig. 4. Actieve caspase-9 wordt gedetecteerd door western blot. Western blot analyse van onbehandelde (laan 1) en met etoposide behandelde (laan 2) cellen, gesondeerd met konijn anti-caspase-9 (actief) antilichaam. Actieve, gekloofde caspase-9 wordt alleen gedetecteerd bij inductie van apoptose met etoposide.
Caspase-activering is een bepalend kenmerk van apoptose. De belangrijkste apoptotische caspasen die vaak worden getest zijn de initiator-caspasen 3, 6 en 7 en de effector-caspasen 2, 8, 9 en 10. Activering van de caspasen kan worden geïdentificeerd aan de hand van de geringere omvang van de pro-caspasen wanneer deze worden gesplitst of door gebruik te maken van antilichamen die alleen met de gesplitste, geactiveerde vorm interageren (figuur 4). Beide benaderingen kunnen worden afgelezen met behulp van western blotting, terwijl de laatste benadering ook kan worden aangepast voor fluorescente en immunohistochemische assays door antilichamen te kiezen die zijn geconjugeerd met fluoroforen of biotine. Deze assays zijn compatibel met zowel gefixeerde als niet-gefixeerde cellen.
Een ding dat in gedachten moet worden gehouden is dat initiator-caspasen ver stroomopwaarts in de apoptose-signaleringsroute liggen en dat hun activering niet altijd in apoptose resulteert. Het is dus verstandig assays voor initiator-caspasen te combineren met assays voor effector-caspasen of, beter nog, met probes voor gebeurtenissen stroomafwaarts van het point of no return, zoals MOMP.
Een andere klasse van caspase-activeringstests zijn fluorofoorgelabelde caspasesubstraten, zoals FLICA Assays. FLICA Assays binden zich covalent en onomkeerbaar aan geactiveerde caspases; ongebonden remmers diffunderen uit de cellen en/of kunnen met wasbeurten worden verwijderd. Deze remmers zijn beschikbaar in combinatie met rode of groene kleurstoffen. De intensiteit van de fluorescentie kan worden gebruikt als een kwantitatieve meting van de caspaseactiviteit – apoptotische cellen met een hoge caspaseactiviteit zullen meer fluorescentie vertonen dan cellen met een lage caspaseactiviteit. FLICA Assays zijn compatibel met levende cellen, weefselcoupes en dunne bevroren coupes, maar niet met gefixeerde cellen of in paraffine ingebedde weefsels en kunnen worden afgelezen door kwantificering van de fluorescentie-intensiteit met behulp van fluorescentiemicroscopie, flowcytometrie (figuur 2) of een microplaatlezer.
Om goede conclusies te trekken uit caspase-activiteit assays is het altijd verstandig om meer dan één doelwit te kiezen.
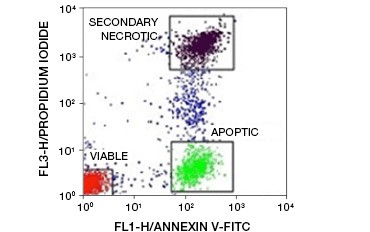
Fig. 5. Annexine-V-conjugaten kunnen worden gebruikt om apoptotische van necrotische en levensvatbare cellen te onderscheiden. Dot-plot met Ramos-cellen gekleurd met annexine V:FITC versus propidiumjodide. Drie verschillende populaties kunnen worden waargenomen.
4. Fosfatidylserine externalisatie
Een belangrijk kenmerk van apoptose dat zelfs in een vroeg stadium aantoonbaar is, is de externalisatie van fosfatidylserine (PS), een fosfolipide dat uitsluitend in het binnenmembraan van gezonde cellen voorkomt. Annexine-V bindt fosfatidylserine en annexine-V-conjugaten kunnen dus worden gebruikt om apoptose te beoordelen. Deze tests worden meestal uitgevoerd met flowcytometrie waarbij gebruik wordt gemaakt van met fluoroforen gelabelde annexine-V. Door deze kleurstof te combineren met een levensvatbaarheidskleurstof, zoals PI, kunnen apoptotische cellen worden onderscheiden van necrotische cellen. In deze tweekleurige flowcytometrie-experimenten zijn drie populaties gemakkelijk te onderscheiden: annexine-V/PI dubbel-negatieve levensvatbare cellen, annexine-V positieve/PI negatieve apoptotische cellen, en annexine-V/PI dubbel-positieve secundaire necrotische cellen
(figuur 5).
Phosphatidylserine externalisatie is een dynamisch, omkeerbaar proces totdat een cel na MOMP is gecommitteerd aan apoptose. Met behulp van annexine-V-conjugaten is het onmogelijk de vroege, omkeerbare stadia van apoptose te onderscheiden van de latere stadia van apoptose wanneer een cel zich tot de dood heeft verbonden. Polariteitsgevoelige indicator van levensvatbaarheid en apoptose (pSIVA)-probes zijn biosensoren die reversibel PS binden en dus in- en uitschakelen naarmate PS van het buitenmembraan naar het binnenmembraan omslaat (figuur 6). Een ander voordeel van het pSIVA-assay is dat, in tegenstelling tot annexine-V-conjugaten, pSIVA-probes rechtstreeks aan uw cellen kunnen worden toegevoegd zonder wasstappen. Deze assay kan worden afgelezen met immunocytochemie en immunofluorescentiemicroscopie, met inbegrip van beeldvorming van levende cellen, waardoor verschillen in apoptosesnelheid als reactie op verschillende experimentele behandelingen gemakkelijk in real time kunnen worden vergeleken. Aangezien apoptose in real time wordt gevolgd, is deze assay niet compatibel met gefixeerde cellen.
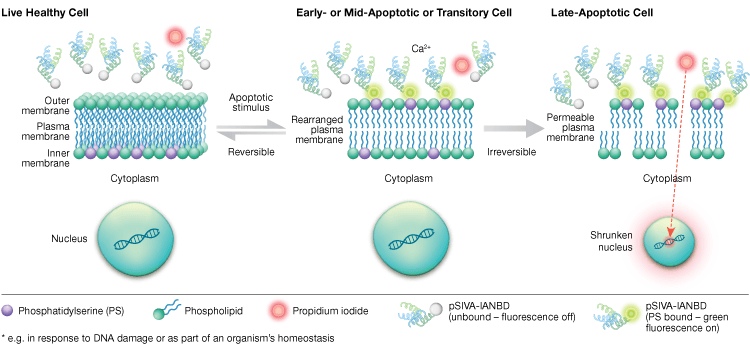
Fig. 6. Met de pSIVA-test kan onderscheid worden gemaakt tussen levende, vroeg-apoptotische en laat-apoptotische cellen door de externalisatie en internalisatie van fosfatidylserine in real time te volgen.
5. DNA fragmentatie
DNA fragmentatie is een van de latere stadia van apoptose en wordt meestal geanalyseerd door detectie van DNA laddering met behulp van agarose-gebaseerde elektroforese of de terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) methode.
Een onderscheidend kenmerk van apoptose is fragmentatie van DNA in ~ 180 bp fragmenten door caspase-geactiveerde endonucleasen. Geëxtraheerd genomisch DNA op een agarosegel zal dus karakteristieke DNA-laddering vertonen die niet wordt gezien bij cellen die door andere mechanismen, zoals necrose, sterven.
De TUNEL-methode is een andere manier om de vorming van oligonucleosomen door caspase-geactiveerde endonuclease te detecteren. Bij DNA-splitsing ontstaan 3′-hydroxylgroepen (3′-OH-groepen). De TUNEL-test gebruikt het enzym terminal deoxynucleotidyl transferase (TdT) om BrdU aan deze 3′-OH-groepen toe te voegen. Opgenomen BrdU kan vervolgens worden gedetecteerd met anti-BrdU-antilichamen die met biotine of een fluorofoor zijn gelabeld. Deze bepaling is compatibel met flowcytometrie, immunohistochemie en immunofluorescentie, en kan worden omgezet in een radiolabel uitlezing door gebruik te maken van -TdR in plaats van BrdU. De cellen moeten na BrdU-integratie worden gefixeerd alvorens te worden gekleurd.
DNA-fragmentatie kan ook worden gemeten door middel van flowcytometrie met behulp van de sub-G1-test. De kleine, ~180 bp, DNA-fragmenten die tijdens apoptose worden gegenereerd, lekken uit de cellen, waardoor het totale DNA-gehalte van apoptotische cellen daalt. Door DNA met PI te kleuren kunnen hypodiploïde apoptotische cellen in de sub-G1-piek van het PI-histogram worden geteld.
6. Multiplex-panels voor apoptosemarkers
Ten slotte verkopen veel verkopers panels voor multiplex immunoassay-analyse van celpopulaties. Deze panels kunnen meerdere apoptosemarkers tegelijk testen.
Ongeacht de methode die wordt gebruikt om apoptose te detecteren, moeten geschikte controles worden opgenomen, aangezien experimentele omstandigheden en celtype de prestaties van sommige assays kunnen veranderen. Neem altijd positieve en negatieve controles op. Voeg met medium behandelde controles toe om rekening te houden met de effecten van de oplosmiddelen, toepassingsspecifieke controles om te controleren voor factoren zoals autofluorescentie bij immunofluorescentie-experimenten, en laadcontroles voor western blotting.
Tabel 2. Overzicht van assays voor het opsporen van kenmerken van apoptose.
| Apoptosefase | Reagenten voor detectie | Toepassing |
| PS flipping | annexine-V-conjugaten, pSIVA probes | Flowcytometrie, microscopie |
| Signaleringscascades geïnitieerd | FLICA, caspase-antilichamen | Stroomcytometrie, microscopie, western blot |
| MOMP | TMRM, TMRE, JC-1 | Stroomcytometrie, microscopie, microplaatlezer |
| Cellenslijtage | Stroomcytometrie, microscopie | |
| Membrane blebbing | hematoxylin + eosin | Microscopie |
| Nucleaire condensatie | DAPI, Hoechst, PI, 7-AAD | Microscopie |
| DNA fragmentatie | TUNEL, Sub-G1-assay, DNA-laddering | Agarosegel, flowcytometrie, microscopie |
| Phagocytose van apoptotische lichaampjes | Acridine oranje, hematoxyline + eosine | Flowcytometrie, licht- en elektronenmicroscopie |