Introduction
De actieve sites van een enzym bestaan meestal uit aminozuurresiduen; afhankelijk van welke aminozuurresiduen aanwezig zijn, kan de specificiteit van het substraat sterk variëren. Afhankelijk van de pH-waarde kunnen de fysische eigenschappen (voornamelijk de elektrische lading) van een enzym veranderen. Een verandering in de elektrische lading kan de interactie tussen de actieve aminozuurresiduen en het binnenkomende substraat veranderen. Het substraat kan zich dan aan de actieve plaats binden via waterstofbruggen of van der Waals krachten. Zodra het substraat aan de actieve site bindt, vormt het een enzym-substraat complex dat vervolgens betrokken is bij verdere chemische reacties.
Om ervoor te zorgen dat een enzym actief is en energetisch gunstig is om een chemische reactie te laten verlopen, moet een substraat zich binden aan de “actieve plaats” van een enzym. Een actieve plaats kan worden beschouwd als een slot en het substraat als een sleutel; dit staat bekend als het slot-sleutel-model. Een sleutel (substraat) moet worden ingebracht en omgedraaid (chemische reactie), waarna het slot (enzym) opengaat (productie van producten). Merk op dat een enzym meer dan één actieve plaats kan hebben. Een andere theorie over de relatie tussen actieve site en substraat is de “induced fit” theorie, die het tegenovergestelde is van de “slot en sleutel” theorie (waarbij de actieve site schijnbaar niet flexibel is). In de induced fit-theorie is de actieve site van het enzym zeer flexibel, en verandert hij alleen van conformatie wanneer het substraat eraan bindt.
Enzymen werken als een katalysator door de Gibbs-vrije energie van activering van het enzym-substraat complex te verlagen. Hieronder staan twee figuren die een enzymatische basisreactie met en zonder katalysator laten zien:
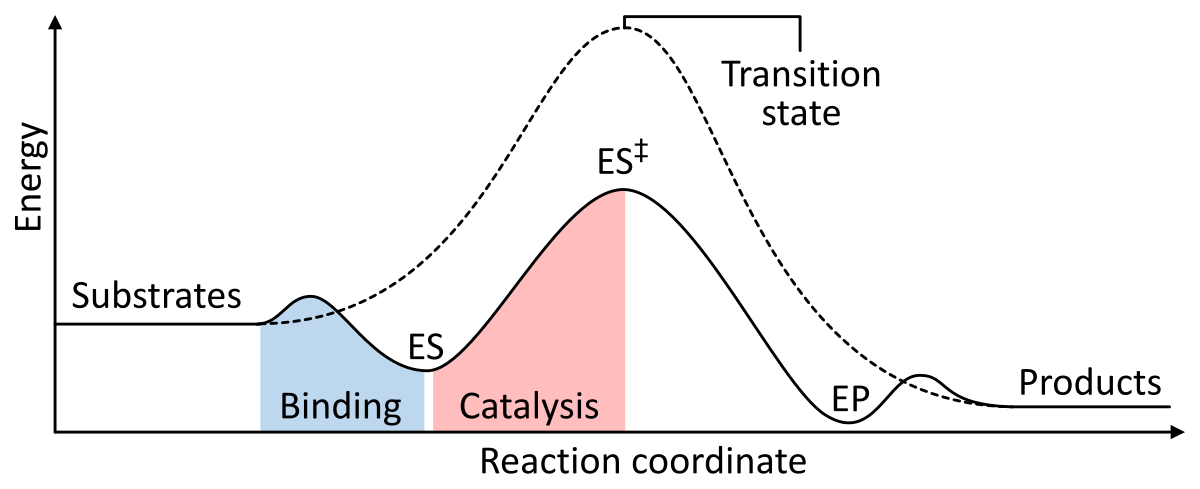
Figuur 1: De energieën van de fasen van een chemische reactie. Bij ongekatalyseerde reactie (stippellijn) hebben substraten veel activeringsenergie nodig om een overgangstoestand te bereiken, die vervolgens vervalt in producten met lagere energie. Bij enzymkatalyse (ononderbroken lijn) bindt het enzym de substraten (ES), stabiliseert vervolgens de overgangstoestand (ES‡) om de activeringsenergie te verminderen die nodig is om producten (EP) te produceren die uiteindelijk vrijkomen. uit Wikipedia.
De efficiëntie van het enzym kan als volgt worden bepaald: beschouw een eenvoudige enzymatische reactie:
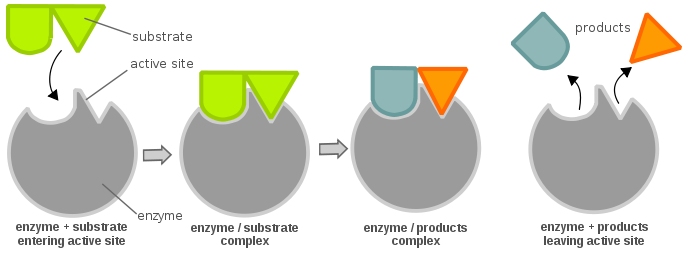
De Duitse biochemicus Leonor Michaelis en de Canadese biochemicus Maud Menten leidden een vergelijking af die dit systeem beschrijft, later bekend als de “Michaelis-Menten-vergelijking”, hieronder weergegeven:
}{K_M + }
Deze vergelijking geeft de snelheid van de reactie bij een gegeven substraatconcentratie, uitgaande van een bekende Vmax, de maximale snelheid waarmee de reactie kan verlopen, en KM, de Michaelis-constante. In een praktische toepassing van de Michaelis-Menten-vergelijking wordt V0 echter vaak gemeten, en Vmax wordt waargenomen als een verzadiging of een plateau in een dataplot. Omdat de substraatconcentratie bekend is, is KM meestal de berekende waarde van belang.
Voor \(K_M), neem aan \(V_0= \dfrac{V_{max}}{2}\):
}{K_M + }
\frac{V_{max}}{2} = V_{max} \tag{3}}
\tag{4} \De Michaelis-constante kan worden beschouwd als de snelheid waarmee het substraat ongebonden raakt aan het enzym, wat ofwel kan gebeuren als het substraat-enzym-complex het product wordt, ofwel als het substraat ongebonden raakt aan het enzym. KM kan worden weergegeven als een vergelijking.
Waarbij k-1 de snelheidsconstante is waarbij het substraat ongebonden raakt aan het enzym, wat resulteert in de dissociatie van het enzym-substraatcomplex, k2 de snelheidsconstante is waarbij het substraat-enzymcomplex verdwijnt en in product verandert, en K1 de snelheidsconstante is voor de vorming van het substraat-enzymcomplex. Daarom kan KM worden gezien als de snelheid waarmee het substraat-enzymcomplex verdwijnt, gedeeld door de snelheid waarmee het substraat-enzymcomplex wordt gevormd, dat is het niveau waarop de helft van het substraat aan het enzym is gebonden. KM is een nuttige indicator voor de aanwezigheid van een remmer, omdat we kunnen kijken naar veranderingen in KM en deze kunnen vergelijken met onze controle (biologische systemen waarvan we weten dat er geen remmer aanwezig is). KM is een afhankelijke variabele, en de waarde ervan kan door vele oorzaken veranderen, zoals de pH-waarde van het systeem, de temperatuur, of elke andere omstandigheid die een chemische reactie kan beïnvloeden. Een kleine KM geeft aan dat het substraat een hoge affiniteit voor het enzym heeft.
De Michaelis-Menten-vergelijking is het nuttigst om de efficiëntie van het enzym te meten als v0 als volgt tegen , wordt uitgezet:
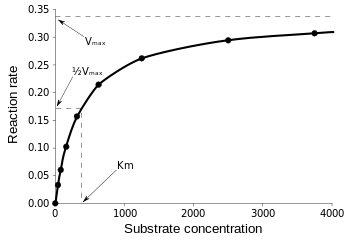
Figuur 3: Diagram van reactiesnelheid en Michaelis-Menten-constante. uit Wikipedia.
Vmax is de maximale snelheid waarmee de reactie kan verlopen, ongeacht , wat betekent dat zelfs als je meer substraat toevoegt, de reactie niet sneller kan gaan. Dat komt omdat bij Vmax alle actieve plaatsen op het enzym bezet zijn. Na alle uitleg over de verschillende vormen van kinetische vergelijkingen van enzymen, komen we tot onze conclusie van katalytische efficiëntie. Terugverwijzend naar fig. 3, hebben we:
_o}{\dfrac{k_{-1} + k_2}{k_1}
Merk op dat k_2 een onomkeerbare reactie beschrijft in plaats van een evenwichtsreactie, vergeleken met k-1 en k1. k2 wordt hier ook wel kcat genoemd, de katalytische efficiëntie van het enzym. Uit de vorige bespreking blijkt dat v0 de gemeten reactiesnelheid is, d.w.z. de productvorming in de tijd, zodat kan worden geconcludeerd dat een vergelijking er als volgt uit zou zien:
}{dt} = k_2_0 \tag{9}]
Waarbij 0 de totale enzymconcentratie is.
Het is ook bekend dat VMax wordt waargenomen wanneer al het enzym-substraatcomplex verdwijnt en in producten verandert, zodat we de volgende aanname kunnen doen:
0 \tag{10}
en na herschikking hebben we deze vergelijking:
}
Dit is de vergelijking voor het berekenen van de katalytische efficiëntie, die moet worden gebruikt nadat we gegevens uit experimenten hebben verkregen en nadat we de Michaelis-Menten vergelijking hebben gebruikt. Bij een grotere kcat is het enzym efficiënt, omdat er minder enzym nodig is.