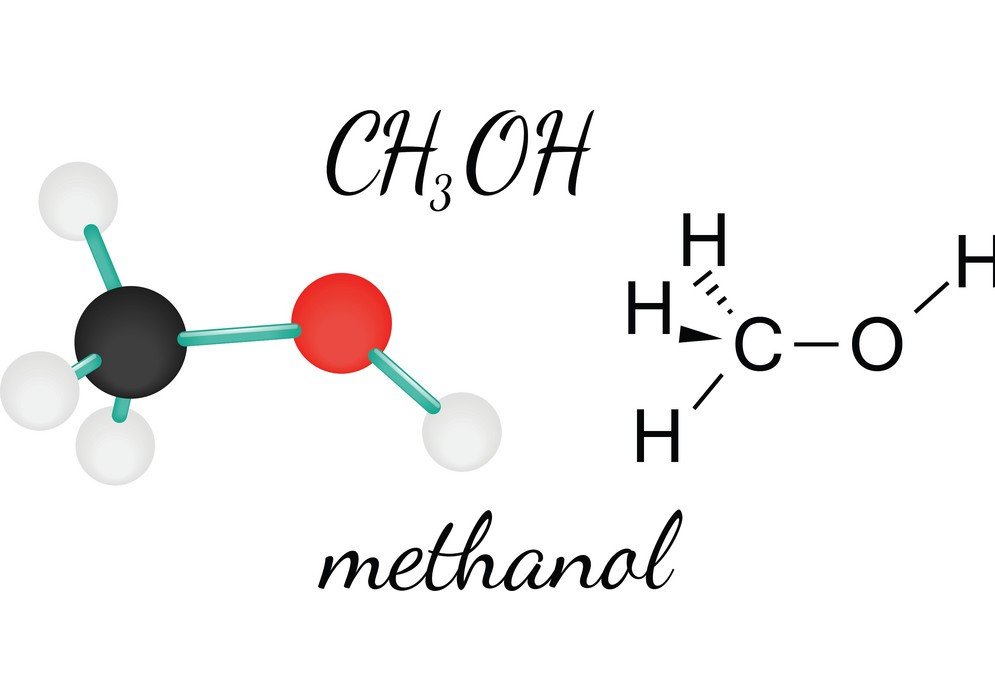
CH3OH of Methanol is een brandbare, kleurloze, en vluchtige vloeistof die een kenmerkende alcoholische geur heeft. Door de Methanol te bestuderen, kan men de molecuulvorm, de bindingshoek en de polariteit van het molecuul leren kennen. De polariteit van CH3OH is een van de essentiële kenmerken, omdat het helpt bij het kennen van de andere eigenschappen van de verbinding, zoals de oplosbaarheid, elektrische ladingen, en nog veel meer. Om de polariteit van Methanol te begrijpen, moeten we eerst kijken naar de bindingshoeken en de rangschikking van de atomen in het CH3OH-molecuul.

CH3OH Bindingshoeken
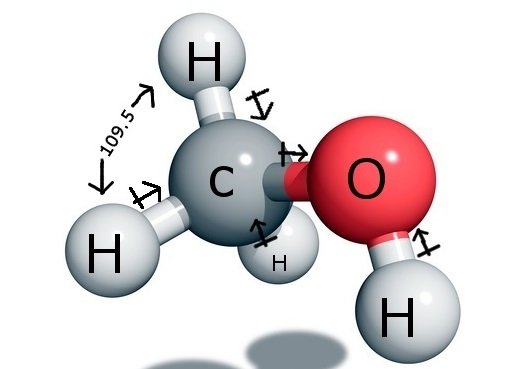
Het centrale koolstofatoom vormt vier bindingen in de verbinding, drie met het waterstofatoom en één met de hydroxylgroep (OH). En omdat dit koolstofatoom een sp3 hybridisatie heeft en een tetraëdervorm vormt, heeft het bindingshoeken van 109,5 graden met zijn bindingsatomen.
Zuurstof daarentegen vormt één sigma binding, maar heeft twee eenparen, dus is er een kromming in zijn bindingshoek als gevolg van de afstotingskrachten tussen het bindingspaar en het eenpaar. Hierdoor neemt de bindingshoek af tot 104,5 graden.
Koolstof heeft dus een bindingshoek van 109,5 graden met alle drie de waterstofatomen en een bindingshoek van 104,5 graden met de hydroxylgroep.
Is CH3OH polair?
De polariteit van een verbinding hangt af van het netto dipoolmoment van de verbinding. Dit netto dipoolmoment kan worden gekend door de elektrische ladingen op de atomen in het molecuul op te merken. Hier zijn zowel Koolstof als Zuurstof atomen (die worden beschouwd als geometrische centra voor deze verbinding) in Methanol elektronegatieve atomen. Maar zuurstof is elektronegatiever dan koolstof of waterstof in de verbinding.
CH3OH kan niet apolair zijn omdat er een verschil is in elektrische ladingen tussen de atomen in het methanolmolecuul. Zuurstof heeft meer elektronendichtheid door zijn twee eenzame elektronenparen. Dit veroorzaakt een netto dipool die naar het zuurstofatoom wijst, waardoor CH3OH polair wordt.
Afgezien van de elektrische ladingen is het molecuul van CH3OH asymmetrisch, waardoor de mogelijkheid van niet-polariteit teniet wordt gedaan. Een niet-polair molecuul heeft een symmetrische structuur, omdat het dipool-dipoolmoment wordt opgeheven. Maar omdat er een kromming is in de vorm van Methanol, leidt dit tot de vorming van een asymmetrische structuur, waardoor het netto elektrisch dipoolmoment negatief eindigt in de richting van het zuurstofatoom. CH3OH is dus een polair molecuul.
Nu we de polariteit van het CH3OH-molecuul kennen, laten we enkele van zijn fysische eigenschappen doornemen:
- Het kookpunt van Methanol ( CH3OH) is 64,7 °C.
- Het smeltpunt van Methanol is -97,6 °C.
- Het molecuulgewicht van Methanol is 32,04 g/mol.
- Het is een polair oplosmiddel en wordt ook wel houtalcohol genoemd omdat het vroeger werd geproduceerd door de destillatie van hout.
- De geur van deze verbinding is aan de zoetere kant in vergelijking met ethanol.
Toepassingen van CH3OH
- Methanol wordt ook gebruikt voor de productie van koolwaterstoffen en voor de synthese van andere chemische stoffen zoals formaldehyde.
- Het wordt gebruikt als antivriesmiddel in leidingen.
- CH3OH wordt in verschillende landen ook gebruikt als additief voor benzine vanwege zijn lage smeltpunt.
- De verbinding wordt ook gebruikt als brandstof in verbrandingsmotoren.
- Vele farmaceutische bedrijven gebruiken zuivere Methanol voor de synthese van andere verbindingen.
Ik hoop dat dit artikel u helpt om de polariteit van het molecuul en zijn fysische eigenschappen en toepassingen te begrijpen. CH3OH is een polair molecuul omdat het dipool-dipoolmoment door zijn asymmetrische vorm niet wordt opgeheven.