Hieronder staan de stappen die ik volg bij het tekenen van een Lewisstructuur.
1. Beslis welk atoom het centrale atoom in de structuur is. Dat zal normaal gesproken het minst elektronegatieve atoom zijn (#”C “#).
2. Teken een skeletstructuur waarin de andere atomen enkelvoudig aan het centrale atoom zijn gebonden:
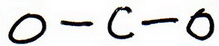
3. Teken een proefstructuur door elektronenparen rond elk atoom te plaatsen tot elk atoom een octet krijgt.
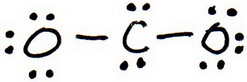
4. Tel de valentie-elektronen in je proefstructuur (20).
5. Tel nu de valentie-elektronen die je daadwerkelijk beschikbaar hebt. #1 “C” + 2 “O” = 1×4 + 2×6 = 16#.
De proefstructuur heeft vier elektronen te veel.
We moeten ofwel een drievoudige binding ofwel twee dubbele bindingen invoegen.
6. Teken nieuwe proefstructuren, deze keer met de extra bindingen.
Er zijn drie mogelijkheden:
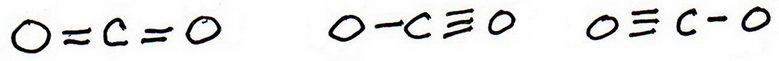
7. Voeg net als voorheen valentie-elektronen toe om elk atoom een octet te geven:
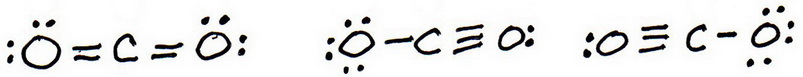
8. Bereken de formele lading van elk atoom.
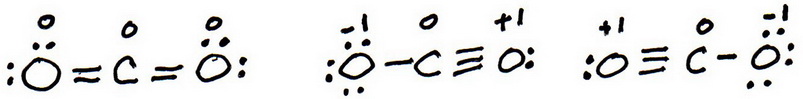
9. De “beste” Lewisstructuur is er een met de minste formele ladingen.
De eerste structuur heeft geen formele ladingen, dus de beste Lewisstructuur voor #”CO”_2# is
