Koolstoftetrachloride kan worden uitgedrukt als CCl4, en het bestaat uit één koolstofmolecuul en vier chloormoleculen. Tetrachloorkoolstof is niet polair. Waarom is tetrachloorkoolstof niet polair? Het is apolair omdat de dipoolmomenten van het molecuul gelijkmatig verdeeld zijn rond het centrale koolstofatoom. Dit betekent dat hun individuele effecten worden geannuleerd, en het molecuul is neutraal.
De vier chlooratomen zijn symmetrisch gepositioneerd op de vier hoeken van een tetraëder, en een enkele binding verbindt elk van hen met het koolstofatoom in het centrum van het molecuul. Als gevolg daarvan heeft CCl4 geen netto positief of negatief dipoolmoment. Als een ander atoom dan chloor op een willekeurige andere plaats in het molecuul zou zijn geplaatst, zou het molecuul een dipoolmoment hebben en zou CCl4 als gevolg daarvan polair zijn.
“Wij definiëren organische chemie als de chemie van koolstofverbindingen.” – August Kekule
Dat is het snelle antwoord met betrekking tot de polariteit van tetrachloorkoolstof. Het zou echter nuttig zijn om over de polariteit van moleculen in het algemeen te spreken en tetrachloorkoolstof en zijn eigenschappen te onderzoeken om te begrijpen waarom het in de natuur niet polair is.
Wat betekent het dat een molecuul polair is?
Als je de term polair hoort, denk je waarschijnlijk aan de noord- en zuidpool van de aarde. Deze noord- en zuidpolen bevinden zich aan de uiteinden van de aarde, net zoals een batterij een positieve en een negatieve pool kan hebben. Moleculen en de bindingen tussen atomen kunnen ook polariteit hebben. Een molecuul wordt als polair gedefinieerd wanneer de atomen waaruit het molecuul is opgebouwd, zo zijn gerangschikt dat het ene uiteinde van het molecuul een positieve lading heeft en het andere uiteinde van het molecuul een negatieve lading.
Een polair molecuul ontstaat wanneer een atoom met een hoge elektronegativiteit zich verbindt met een atoom met een zwakkere elektronegativiteit. Het resulterende molecuul heeft een gebied met hoge elektronegativiteit en een gebied met lagere elektronegativiteit of elektrische polen. Een van de beroemdste voorbeelden van een polair molecuul is water, en het is dankzij de polaire aard van water dat het dient als de basis voor het leven op aarde.
In tegenstelling tot niet-polaire moleculen ontbreken elektrische polen, en de elektronen binnen hen zijn verdeeld in een meer gelijke manier. Niet-polaire moleculen hebben geen opvallende lading aan beide uiteinden van het molecuul. De meeste koolwaterstofvloeistoffen zijn apolair van aard.
In het kort, een molecuul dat dipolen heeft die elkaar niet opheffen is polair, terwijl apolaire moleculen die moleculen zijn waar de ladingen van atomen elkaar opheffen en er geen lading is aan het ene of het andere uiteinde van het molecuul.
Voorbeelden van polaire moleculen
Zoals eerder vermeld, is water een polair molecuul. De bindingen die tussen de zuurstofatomen en de waterstofatomen bestaan, zijn zo verdeeld dat beide kanten van het atoom, de zuurstof-waterstof en de bindingen, op gelijke afstand van elkaar liggen. Het resultaat is dat de zuurstofzijde, of de bovenkant van het molecuul, een licht negatieve lading heeft terwijl de waterstofatomen, of de onderkant van het molecuul, een licht positieve lading heeft.
Ethanol is een polair molecuul omdat de zuurstofatomen die zich in het molecuul bevinden meer elektronegativiteit hebben dan de andere atomen. De zuurstofatomen trekken meer elektronen aan door hun hogere elektronegativiteitspotentiaal, en de -OH bindingsgroepen in het molecuul hebben over het geheel negatieve ladingen, ook al is de negatieve lading maar heel gering.
“Leven bestaat in het universum alleen omdat het koolstofatoom bepaalde uitzonderlijke eigenschappen bezit.” – James Jeans
ADVERTENTIE
Andere voorbeelden van polaire moleculen zijn zwaveldioxide (SO2), waterstofsulfide (H2S) en ammoniak (NH3).
Wees gewaarschuwd dat een molecuul uit polaire bindingen kan bestaan en toch niet polair kan zijn. Een voorbeeld is koolstofdioxide, dat vier bindingen heeft, maar de dipoolmomenten van het molecuul neutraliseren elkaar, zodat het molecuul toch apolair is.
Voorbeelden van apolaire moleculen

Voorbeelden van niet-polaire moleculen zijn stikstof, methaan, ozon en zuurstof. Dit zijn homonucleaire moleculen of moleculen die uit atomen van slechts één element bestaan. Niet-polaire moleculen die niet homonucleair zijn, zijn onder andere kooldioxide, hierboven genoemd, en methaan. Tolueen en benzine zijn ook voorbeelden van niet-polaire stoffen. Als algemene regel geldt dat koolstofverbindingen apolair zijn, hoewel er enkele uitzonderingen zijn, zoals koolmonoxide. Koolstofmonoxide is lineair van aard, wat een molecuul gewoonlijk apolair zou maken, maar het verschil in elektronegativiteit tussen het zuurstof- en koolstofmolecuul is groot genoeg dat het molecuul polair is. Alkynen lossen niet op in water, en worden beschouwd als apolaire moleculen. De inerte of edelgassen worden ook geclassificeerd als apolaire moleculen, omdat de gassen slechts uit enkele atomen van hun respectieve elementen bestaan, zoals neon, helium, argon en krypton.
De polariteit van een molecuul voorspellen
Aan de hand van de elektronegativiteitswaarden van de atomen in een molecuul kunt u bepalen of het molecuul waarschijnlijk polair of apolair zal zijn of niet. Aanzienlijke verschillen tussen de elektronegativiteitswaarden impliceren dat de elektronen gelijk verdeeld zijn over de atomen in het molecuul. Aangezien de elektronen dichter bij het ene atoom zullen zijn dan bij het andere, zal dat deel van het molecuul polair zijn, hoewel om de polariteit van het hele molecuul te bepalen met alle bindingen rekening moet worden gehouden.
De beslissende factor voor de polariteit of niet-polariteit van een molecuul is de geometrie. Als het ene uiteinde van het molecuul een negatieve lading heeft, terwijl het andere uiteinde van het molecuul een positieve lading heeft, zal het molecuul polair zijn. Maar als de ladingen gelijkmatig verdeeld zijn en om een centraal atoom draaien, is het molecuul waarschijnlijk niet polair. Je kunt dit gebruiken om te voorspellen of een molecuul polair of niet-polair zal zijn. Niet elk molecuul heeft een dipoolmoment, en dit kan het voorspellen van de polariteit van een molecuul iets moeilijker maken. Moleculen die kunnen worden omgedraaid en gespiegeld over een geometrisch vlak, hebben bijvoorbeeld geen dipoolmoment, omdat dipoolmomenten niet meer dan één punt kunnen omvatten.
feiten over tetrachloorkoolstof
Tetrachloorkoolstof werd voor het eerst ontdekt door de Franse scheikundige Henri Victor Regnault in het midden van de jaren 1800. De chemische stof werd ontdekt door een combinatie van chloor en chloroform. Desondanks wordt tetrachloorkoolstof tegenwoordig voornamelijk uit methaan gewonnen. Voor de productie van tetrachloorkoolstof wordt vaak gebruik gemaakt van de bijproducten van chloreringsreacties om de verbinding af te leiden. Hiertoe behoren de bijproducten van het ontstaan van chloroform en dichloormethaan. Tetrachloorkoolstof is tamelijk vluchtig van aard en verspreidt een geur die lijkt op die van chemisch reinigingsmiddelen. Tetrachloorkoolstof is ook een oplosmiddel en is daarom nuttig bij het oplossen van niet-polaire stoffen zoals oliën en vetten.
Tetrachloorkoolstof heeft veel verschillende toepassingen en is gebruikt als schoonmaakmiddel, als koelmiddel, en in brandblusapparaten. Koolstoftetrachloride wordt vaak gebruikt bij het maken van lavalampen, waardoor de was zwaarder wordt.
“… Is de koolstofmolecule bekleed met gedachten?” – Saul Bellow
Omwille van de milieu-impact van tetrachloorkoolstof is de productie ervan sinds de jaren 1980 sterk gedaald. Het Protocol van Montreal beperkte de productie van chloorfluorkoolstoffen, en aangezien tetrachloorkoolstof een sleutelingrediënt is bij de productie van CFK’s, is de productie van tetrachloorkoolstof als gevolg daarvan sterk gedaald. De nadelige gevolgen van tetrachloorkoolstof voor de gezondheid hebben ook geleid tot een daling van de productie ervan, en hoewel het ooit op grote schaal werd gebruikt als oplosmiddel, wordt het tegenwoordig nog maar zelden voor dergelijke doeleinden gebruikt.
Koolstoftetrachloride is uiterst giftig voor de lever, en andere leverbeschadigende stoffen worden vaak vergeleken met de giftigheid van koolstoftetrachloride. Hoge concentraties van tetrachloorkoolstof kunnen niet alleen de lever beschadigen, maar ook de nieren. Langdurige blootstelling aan tetrachloorkoolstof kan een coma of de dood tot gevolg hebben. Blootstelling aan de chemische stof kan ook iemands kans op het ontwikkelen van kanker verhogen.
Waarom is koolstoftetrachloride polair?
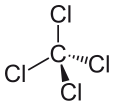
Nadat we hebben gezien wat een molecuul polair maakt, en enkele voorbeelden van polaire moleculen hebben bekeken, kunnen we nu beter begrijpen waarom tetrachloorkoolstof een niet-polair molecuul is. Het eerste wat je moet doen om te bepalen of een molecuul polair of apolair is, is de elektronegativiteit berekenen van de atomen in het molecuul. De polariteit van de binding tussen twee atomen moet worden vastgesteld, en alle bindingen moeten in aanmerking worden genomen bij het bepalen van de polariteit van het molecuul. Maar het verschil in elektronegativiteit tussen chloride en koolstof, in het geval van tetrachloorkoolstof, is niet de enige factor waarmee rekening moet worden gehouden. Ook de vorm van het molecuul moet in aanmerking worden genomen. Hoewel er dipolen aanwezig zijn in het molecuul, betekent de lineaire vorm van tetrachloorkoolstof dat de effecten van de verschillende dipoolmomenten in het molecuul elkaar opheffen, met als gevolg dat het molecuul neutraal of niet-polair is.