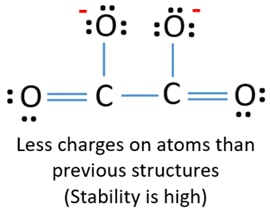
Lewisstructuur van oxalaation wordt in deze handleiding stap voor stap getekend. Het totale valentie elektronen concept wordt gebruikt om de lewis structuur van C2O42- te tekenen. Na het voltooien van de lewis structuur van C2O42-, moet er een -2 lading en een stabiliteit zijn. Over deze dingen leer je meer in deze tutorial.
Oxalaat ion | C2O42-
Carbonaat ion heeft een -2 lading. Er zijn twee koolstofatomen in het oxalaation.
C2O42- Lewisstructuur
Twee koolstofatomen zijn verbonden aan één koolstofatoom. Zo zijn ook de andere twee zuurstofatomen verbonden met andere koolstofatomen. In de lewis structuur van C2O42- ion, ion is symmetrisch rond de C-C binding.
Stappen van het tekenen van lewis structuur van C2O42-
De volgende stappen zijn nodig om de C2O42- lewis structuur te tekenen en ze worden in detail uitgelegd in deze tutorial.
- Vind het totale aantal elektronen van de valantie schillen van koolstof-en zuurstofatomen. Dit wordt gebruikt om het aantal bindingen, lone pairs rond atomen te bepalen.
- Totaal aantal elektronen paren rond atomen
- Center atoom selectie volgens de maximale valentie
- Plaats lone pairs op atomen
- Controleer de stabiliteit en minimaliseer de ladingen op atomen om de meest stabiele structuur te bouwen door lone pairs om te zetten in bindingen.
Net als deze stappen, zijn de volgende feiten belangrijk om de lewis structuur te tekenen.
Zuurstof moet in de lewis-structuur een negatieve lading hebben, omdat zuurstof graag elektronen vasthoudt dan een koolstofatoom.
De elektronegativiteit van zuurstof is hoger dan die van koolstof.
Het tekenen van de juiste lewisstructuur is belangrijk om de resonantiestructuren van CO32- correct te tekenen.
Totaal aantal elektronen van de valantieschillen van C2O42-
Koolstof bevindt zich in groep 4 van het periodiek systeem. Dus, koolstof heeft vier elektronen in zijn valentieschil. Zuurstof bevindt zich in groep 6. Het heeft zes elektronen in de valentieschil.
- Totale valentie-elektronen gegeven door koolstofatoom = 4 * 2 = 8
Er zijn vier zuurstofatomen in C2O42-ion, Daarom
- Totale valentie-elektronen gegeven door zuurstofatomen = 6 *4 = 24
Er zijn -2 ladingen op C2O42-ion. Daarom zijn er nog twee elektronen die bijdragen aan de valentie-elektronen.
- Totaal valentie-elektronen = 8 + 24 + 2 = 34
Totaal valentie-elektronenparen
Totaal valantie-elektronenparen = σ-bindingen + π-bindingen + eenzame paren in valentieschillen
Totaal aantal elektronenparen wordt bepaald door het aantal totaal valentie-elektronen door twee te delen. Voor het ion C2O42- bedraagt het totaal aantal elektronenparen 17.
Centrumatoom van het ion C2O42-
Om het centrumatoom te zijn, is het vermogen om een hogere valantie te hebben belangrijk. Koolstof heeft meer kans om het centrumatoom te zijn (zie de figuur) omdat koolstof een valentie van 4 kan hebben. De hoogste valentie van zuurstof is 2. Nu kunnen we dus een schets maken van het C2O42-ion.
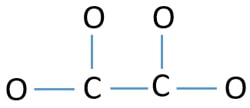
Eenparen op atomen
- Er zijn vier C-O bindingen en één C-C binding in de bovenstaande schets waardoor er vijf bindingen zijn. Er blijven dus maar twaalf (17-5 = 12) valentie-elektronenparen over.
- Markeer eerst die twaalf valentie-elektronenparen als lone pairs in buitenatomen (op zuurstofatomen). Eén zuurstofatoom zal drie eenzame paren nemen volgens de octale regel (zuurstofatoom kan niet meer dan acht elektronen in zijn valentieschil houden).
- Voor vier zuurstofatomen zijn er twaalf elektronenparen opgebruikt. Na het markeren van de eenzame paren op de zuurstofatomen (buiten de atomen) is er geen markering meer voor de koolstofatomen.
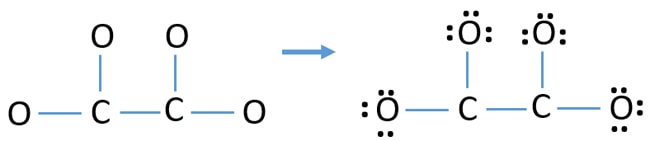
Ladingen op atomen
Na het markeren van de elektronenparen op de atomen (in dit geval alleen op de zuurstofatomen), moeten we de ladingen van elk atoom markeren als er een lading is. Het markeren van ladingen is belangrijk omdat het wordt gebruikt om de beste lewisstructuur van het ion te bepalen. Na het markeren van de ladingen zal je zien dat elk zuurstofatoom een -1 lading krijgt en beide koolstofatomen een +1 lading.
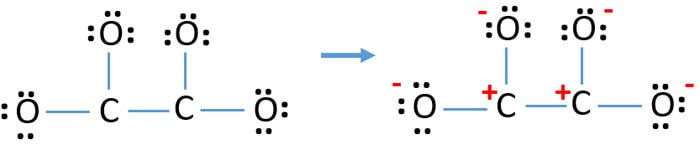
Deze structuur is zeer onstabiel omdat er overal in het ion ladingen zijn.
Controleer de stabiliteit en minimaliseer de ladingen op atomen door eenzame paren om te zetten in bindingen
- Zuurstofatomen moeten negatieve ladingen vasthouden omdat de elektronegativiteit van het zuurstofatoom hoger is dan die van het koolstofatoom. Anders kunnen we zeggen dat het vermogen om negatieve ladingen vast te houden groter is bij zuurstofatomen dan bij koolstofatomen.
- De getekende structuur is niet stabiel omdat alle atomen een lading hebben (de Lewis-structuur zou stabiel moeten zijn met minder ladingen).
- Nu moeten we proberen om de ladingen te minimaliseren door een of meer eenzame paren om te zetten in bindingen. Dus één lone pair van één zuurstofatoom omzetten in een C-O binding.
- Nu is er een dubbele binding tussen één koolstofatoom en één zuurstofatoom (één C=O binding). Nu zijn er drie enkele bindingen tussen het koolstofatoom en de andere drie zuurstofatomen (twee C-O bindingen).
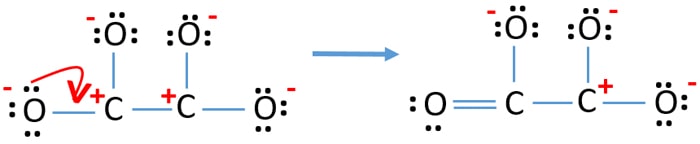
In de nieuwe structuur zijn de ladingen van atomen verlaagd ten opzichte van de vorige structuur. Nu zijn er geen ladingen meer op één zuurstofatoom en één koolstofatoom. Maar er zijn nog wel ladingen op drie zuurstofatomen (hebben -1 negatieve lading) en het andere koolstofatoom. Nu begrijp je dat deze structuur van C2O42- stabieler is dan de vorige structuur. Maar we proberen de ladingen zoveel mogelijk te verminderen.
De ladingen verder verminderen
Je kunt het lone paar van een ander zuurstofatoom omzetten in een C-O binding zoals hieronder.
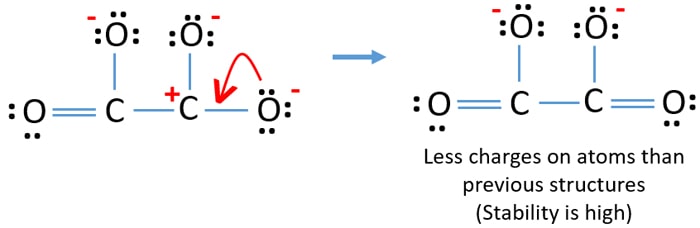
Lewis structuur van C2O42- (carbonaat) ion
Vragen
Stel je scheikundevragen en vind de antwoorden
Gerelateerde tutorials