08 Aug 2019
Noem ApoE en Alzheimer, en het gesprek gaat over het E4-allel, het sterkste vatbaarheidsgen voor de ziekte. Maar ApoE heeft nog een andere kant, in ApoE2. Hoewel deze isovorm beschermt tegen AD, hebben wetenschappers hem nauwelijks bestudeerd. Nu ApoE2 in de belangstelling staat, vragen wetenschappers zich af hoe het komt dat sommige mensen hun mentale scherpte tot op hoge leeftijd behouden. Tijdens de internationale conferentie van de Alzheimer’s Association, die van 14 tot 18 juli in Los Angeles werd gehouden, bleek uit een studie van ApoE-genotypes in 5000 door autopsie bevestigde gevallen van AD dat mensen met twee exemplaren van E2 hun risico op dementie met een verbluffende 90% zien dalen in vergelijking met mensen met het gewone E3/E3-genotype. Ander onderzoek suggereerde dat dit zou kunnen komen doordat ApoE2 de amyloïd- en tau-pathologie vermindert, en het grijze-stofvolume in kritieke hersengebieden vergroot. De voordelen van E2 lijken specifiek te zijn voor de ziekte van Alzheimer, niet algemeen voor neurodegeneratie.
ApoE is het belangrijkste cholesteroldragende eiwit in de hersenen. Het is bestudeerd sinds de ontdekking als een AD-risicogen in de vroege jaren negentig, maar is nieuw opgedoken als een hub voor gliale reacties op amyloïde en tau-aggregaatafzetting (Aug 2018 nieuws; Sept 2017 nieuws). Het gen bestaat als drie polymorfe allelen-E2, E3, en E4-met een wereldwijde frequentie van respectievelijk 8 procent, 78 procent, en 14 procent. Er zijn ook verschillende gemuteerde vormen bekend, bijvoorbeeld de zogenaamde Heidelberg-, Pittsburgh- en Christchurch-mutaties (Feussner et al., 1992; Kamboh et al., 1999; Wardell et al., 1987).
ApoE4 krijgt verreweg de meeste aandacht van AD-onderzoekers, omdat het het risico op AD tot 15-voudig verhoogt, afhankelijk van de onderzoekspopulatie, en voorkomt bij 40 procent van de mensen met AD. E2, het beschermende allel, heeft nauwelijks aandacht gekregen, omdat het het minst voorkomt van de drie en grotendeels afwezig is in AD-monsters. Mensen met één kopie van E2 hebben de helft minder kans om AD te ontwikkelen dan mensen met het meer voorkomende E3/E3-genotype. Maar heeft de extra E2 ook nog een ander effect? “We hebben niet geweten of de dosis E2 een differentieel risico heeft, d.w.z. of het risico van E2/2 significant lager is dan dat van E2/3,” zei Eric Reiman bij de presentatie van de studie.
Om daar achter te komen, besloten Reiman en collega’s van het Banner Alzheimer’s Institute, Phoenix, Gyungah Jun van de Boston University, Joseph Arboleda van Massachusetts Eye and Ear, Yakeel Quiroz van Massachusetts General Hospital, en collega’s van het AD Genetics Consortium te kijken naar gegevens van een heleboel hersenen. Zij analyseerden de bijdrage van alle drie ApoE-allelen aan het risico op dementie en de pathologie in 5.007 hersenen van het ADGC. Deze steekproef omvatte 4.018 door autopsie bevestigde gevallen van Alzheimer dementie, plus 989 pathologisch en cognitief onaangetaste donoren. Naast het leveren van voldoende aantallen om E2/E2 homozygoten te bestuderen, vermijdt dit cohort het verwarrende probleem van verkeerde diagnoses door het elimineren van dementie die niet te wijten is aan AD, evenals mensen die AD pathologie hadden op het moment van overlijden, maar geen dementie.
Zoals verwacht, waren ApoE2 homozygoten zeldzaam – slechts 24 van de meer dan 5.000 mensen, of 0,5 procent. Vergeleken met andere genotypen hadden zij veel minder kans op AD. E2 homozygoten maakten 0,1 procent van de gevallen uit, maar 1,9 procent van de gezonde controles. ApoE4/4 homozygoten maakten daarentegen 15,6 procent van de gevallen uit en slechts 1 procent van de controles. Met andere woorden, 19 van de 24 ApoE2/2s waren cognitief gezond, maar slechts 10 van de 633 ApoE4/4s waren dat.
E2 homozygoten hadden een risicoreductie van 66 procent, zelfs vergeleken met E2/3 dragers, een risicoreductie van 87 procent vergeleken met het meest voorkomende genotype, E3/3, en een maar liefst 99,6 procent risicoreductie vergeleken met mensen die E4/4 waren. In feite krijgen de meeste mensen met E4/4 Alzheimer dementie, terwijl slechts weinigen met ApoE 2/2 dat doen.
Het hebben van twee E2-allelen correleerde met minder amyloïde plaque en tau neurofibrillaire kluwens pathologie. Het beschermende effect van ApoE2 op tau-pathologie was nog steeds duidelijk, zelfs wanneer gecorrigeerd werd voor de hoeveelheid amyloïde plaque. Dat weerspiegelt recente diergegevens die suggereren dat ApoE4 de tau-pathologie verslechtert onafhankelijk van amyloïde (Shi et al., 2017).
De belangrijkste bevinding van de nieuwe studie weerklinkt die van een eerdere studie van Pieter-Jelle Visser, Universiteit Maastricht, Nederland, en collega’s. Zij hadden 16 ApoE2/2-dragers gevonden in een steekproef van 7.583 mensen, van wie er 10 cognitief normaal en amyloïd-negatief waren, terwijl 301 van de 386 ApoE4/4-dragers in de steekproef Alzheimerdementie hadden. Deze steekproef was echter niet pathologie-bevestigd (Jansen et al., 2015).
Hoe belangrijk is neuropathologiebevestiging? Reiman et al. vergeleken de risicoschattingen afgeleid van het cohort met autopsiebevestiging met die berekend op basis van een cohort van 23.857 levende mensen bij wie klinisch was vastgesteld dat ze waarschijnlijk AD-dementie hadden of cognitief normaal waren, en van wie de amyloïdstatus onbekend was. In die analyse werden zowel het beschermende effect van 2/2 als het verhoogde risico als gevolg van 4/4 onderschat. De wetenschappers stelden bijvoorbeeld vast dat de odds ratio geassocieerd met E4/E4 boven E3/E3 in de klinische steekproef 10,7 bedroeg, tegenover 31,22 in de pathologisch bevestigde gevallen. De dosiseffecten voor zowel E2 als E4 werden ook onderschat in de levende steekproef. De autopsie-analyse levert dus bijgewerkte, en waarschijnlijk nauwkeurigere, risicoschattingen op voor alle ApoE-genotypes, menen Reiman en collega’s, althans voor deze niet-Hispanic blanke onderzoeksdeelnemers.
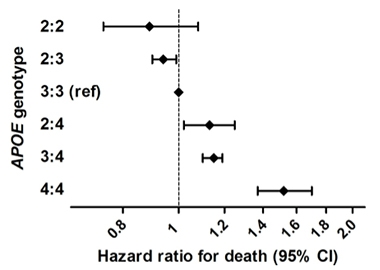
Levensverlengend. In een groot epidemiologisch onderzoek waarbij zes cohorten van mensen met Europese voorouders werden gecombineerd, liepen ApoE2-homozygoten een lager risico om te overlijden dan andere genotypen. ApoE4 homozygoten liepen het grootste risico.
Het is bekend dat de invloed van ApoE op de ziekte van Alzheimer verschilt per etnische groep. Dit soort onderzoek is nodig met meer verschillende proefpersonen, meer E2/2 homozygoten, en rekening houdend met mogelijke effecten van de ApoE-allelen op de overleving, die de resultaten zouden kunnen vertekenen. Desalniettemin, zei Reiman, “Onze resultaten suggereren dat ApoE2 homozygotie geassocieerd is met een uitzonderlijk laag risico op AD, dat de impact van APOE en zijn varianten op het AD-risico aanzienlijk groter is dan eerder werd gewaardeerd, en dat er een dwingende reden is om behandelingen te ontdekken die dit beschermende effect bevorderen.”
Dat komt overeen met recente resultaten van Sudha Seshadri, University of Texas Health, San Antonio, Frank Wolters, Erasmus Medisch Centrum, Rotterdam, Nederland, en collega’s. Zij vonden een overlevingsvoordeel voor ApoE/2 homozygoten. Zij vonden een overlevingsvoordeel voor ApoE2-dragers in een studie van 38.537 mensen uit zes cohorten op bevolkingsniveau (Wolters et al., 2019). Zij identificeerden 239 E2 homozygoten, die de langste levens leidden. Het effect van E2 werd slechts gedeeltelijk verklaard door de effecten op bloedlipiden of vasculaire aandoeningen. E4 homozygoten hadden het hoogste risico op overlijden, en dit werd grotendeels verklaard door de associatie met dementie. Seshadri vertelde Alzforum dat de onderzoekers zullen kijken naar AD en cognitieve verandering, en ook naar amyloïde en tau PET-metingen in deze steekproef.
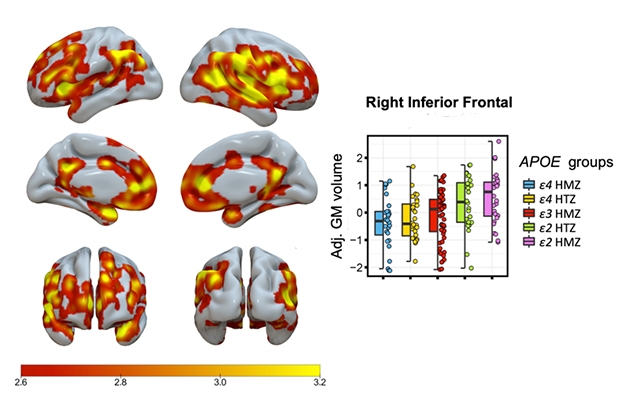
Bit voor bit. De arcering geeft de gebieden aan met een significante stapsgewijze, aan het ApoE-genotype gerelateerde toename van het volume van de grijze stof, waarbij E4/4-homozygoten het laagste en E2/2-genotypes het hoogste volume hebben. De grafiek toont gegevens voor één hersengebied.
Hoe zou ApoE2 veerkracht kunnen geven? Om dit uit te zoeken presenteerde Gemma Salvadó, Barcelonaβeta Brain Research Center, Spanje, een studie waarin zij en co-auteurs beeldvormingsgegevens van verschillende monsters van zoveel mogelijk oudere ApoE2 homozygoten verzamelden. Hun doel was om de hersenstructuur van E2/2s te vergelijken met die van andere ApoE-genotypes.
Vroeger was E2 in verband gebracht met subtiele veranderingen in de hersenmorfologie bij gezonde mensen, waaronder langzamere hippocampale atrofie op oudere leeftijd, en grotere hippocampi op middelbare leeftijd (Chiang et al., 2010; Fennema-Notestine et al., 2011). Er is gerapporteerd dat E2-dragers op de kinderleeftijd dikkere entorhinale cortex hebben dan E3-homo-zygoten of E4-dragers (Shaw et al., 2007). Maar deze studies richtten zich allemaal op mensen met één kopie van E2.
Om uit te zoeken wat die extra E2 zou doen, verzamelde en analyseerde Salvadó MRI-gegevens van cognitief niet-gestoorde mensen in de ALFA-studie in Barcelona (Molinuevo et al. 2016), het cohort van het Amsterdam Universitair Medisch Centrum, OASIS open-access beeldvormingsstudies, en ADNI. Ze vond 28 E2/E2 homozygoten. Ze matchte elk van hen met vijf andere proefpersonen uit hetzelfde centrum op leeftijd, geslacht en opleidingsniveau, en één van elk ander ApoE-genotype. Dat leverde een totaal van 168 proefpersonen op, met een gemiddelde leeftijd van 62.
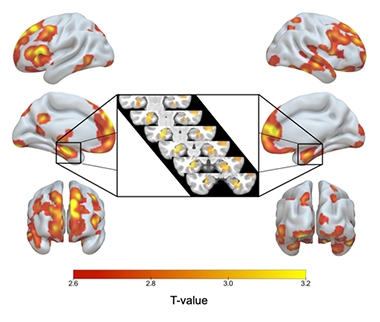
ApoE2/2 Over 3/3. Rood-geel gearceerd geeft hersengebieden aan waar ApoE2 homozygoten meer grijze stof hadden dan E3 homozygoten, inclusief beide hippocampi (inzet).
Vergeleken met hun E3/3-tegenhangers hadden de E2/2-homo-zygoten meer grijze stof in hun hippocampus en in andere voor AD kenmerkende gebieden, waaronder de mediale temporale cortex, de inferieure temporale cortex, de temporale pool, de precuneus en de superieure pariëtale gebieden. E2 homozygoten hadden ook meer grijze stof in gebieden die verband houden met cognitieve veerkracht bij veroudering, namelijk in de anterieure cingulate en mediale prefrontale gebieden (Arenaza-Urquijo et al., 2019; Harrison et al., 2018). In vergelijking met E2/3 heterozygoten vertoonden de E2 homozygoten weinig significante verschillen in grijze stof, maar ze hadden wel nog grotere hippocampi dan de 2/3s.
Salvadó rapporteerde een stapsgewijze, genotype-gerelateerde toename van het grijze-stofvolume, waarbij E4/4-homozygoten het laagste, E3/3-homozygoten het gemiddelde, E2/3-homozygoten het hoogste en E2/2-homozygoten het hoogste volume hadden (zie onderstaande afbeelding).

ApoE2/2 boven 2/3. Vergeleken met het volgende beschermende genotype, ApoE2/3, hebben E2-homozygoten slechts in enkele kleine gebieden meer grijze stof.
Zij denkt dat de grotere grijze massa in strategische hersengebieden E2 homozygoten kan helpen het hoofd te bieden aan AD-pathologie, als en wanneer die zich voordoet. Omdat ApoE2 de entorhinale cortex al in de kindertijd voller maakt, kan veerkracht voortkomen uit ontwikkelingsprocessen, zei ze.
“Dit zijn zeer belangrijke bevindingen,” merkte Reiman op. “Ze suggereren dat als atrofie is als het uithollen van het loopvlak in banden, E2 homozygoten kunnen beginnen met meer loopvlak,” zei hij. Salvadó probeert de studie uit te breiden om te kijken naar meer homozygoten uit aanvullende cohorten, en andere beeldvormingsmethoden.
Terry Goldberg, Columbia University, New York, bestudeert al jaren potentiële mechanismen van ApoE2-gemedieerde neuroprotectie (Conejero-Goldberg et al., 2014). Op AAIC presenteerde Goldberg resultaten over de relatie van ApoE-allelen met neuropathologie in AD, en breidde hij de analyse uit tot andere ziekten.
Hij gebruikte gegevens over 1.557 hersenen uit de National Alzheimer’s Coordinating Center-database die zowel klinische als neuropathologische beoordelingen hadden. Omdat hij zo weinig E2 homozygoten had, groepeerde Goldberg E2/E2 en E2/E3 genotypes samen, voor een steekproef van 130. In die gecombineerde groep had één op de vier hersenen neuropathische AD-veranderingen, vergeleken met 40 procent van de E3/3’s, 65 procent van de E3/4’s, en 85 procent van de E4/4’s. In overeenstemming met eerder onderzoek hadden E2-dragers de mildste amyloïdpathologie, de minste neuritische plaques en de mildste tau-pathologie. Een statistische bemiddelingsanalyse suggereerde dat de associatie van ApoE2 met minder tangles deels via zijn effect op amyloïd verliep, en deels onafhankelijk was van amyloïd. Dat sluit aan bij de resultaten van Reiman.
Ook in deze dataset bood ApoE2 sterke bescherming, zelfs als Goldberg de homozygoten niet ontleedde: E2 verminderde het risico op amyloïde en tau pathologie met de helft in vergelijking met E3, en met 90 procent in vergelijking met E4.
Wat is krachtiger, E2 of E4? Bij vergelijking van E2/E4 en E3/E4 genotypen, vond Goldberg vergelijkbare niveaus van pathologie. Als er iets was, was het E2/E4-paar slechter. Dit suggereert dat E4 de beschermende effecten van E2 overstemt. “Je zou kunnen zeggen dat E4 giftig is,” concludeerde Goldberg. Dat suggereert dat therapieën die gebruik maken van virale constructen om E2 te introduceren in E4-expercerend hersenweefsel misschien niet nuttig zijn, zei hij.
Hoe zit het met andere neurodegeneratieve ziekten?
De literatuur biedt gemengde resultaten over E2 en E4 bij frontotemporale dementie. Sommige studies suggereren dat E2 het risico bevordert (Mar 2016 nieuws), terwijl anderen het crediteren met bescherming en het risico wijten aan E4 (Mishra et al., 2017). Op AAIC meldde Goldberg dat E2 geassocieerd was met meer ernstige TDP-43 pathologie onder 103 gevallen van frontotemporale dementie, en met meer tau pathologie in 28 gevallen van de ziekte van Pick en 51 gevallen van progressieve supranuclear palsy. Hij waarschuwde dat deze aantallen zo klein zijn, dat de resultaten bedrieglijk kunnen zijn. Goldberg weet niet of deze patiënten C9ORF72 of progranulin mutaties hadden, en TDP-43 accumulatie kan leeftijdsgebonden zijn. In gevallen van α-synucleïne pathologie vond Goldberg dat ApoE4 de verspreiding van Lewy body pathologie buiten de oorsprong in de middenhersenen bevordert, en E2 vermindert, naar limbische en neocorticale gebieden
Samen benadrukken deze studies een hernieuwde waardering van de enorme impact die ApoE uitoefent op de pathogenese van AD (zie bijvoorbeeld Wu en Zhao, 2016). De diepgaande bescherming die E2 biedt, zal waarschijnlijk opnieuw de interesse wekken van medicijnontwikkelaars, die het eerder hebben geprobeerd en gefaald, maar het nu misschien nodig achten om dit doelwit opnieuw te bekijken.-pat McCaffrey
Nieuws Citations
- ApoE: Gemeenschappelijke Microgliale Culprit in veroudering, Alzheimer en Tauopathie? 11 aug 2018
- ApoE4 maakt alles wat met Tau te maken heeft nog erger, van begin tot eind 20 sep 2017
- Et Tu, ApoE2? Paper Claims Allele Boosts Risk for Dementia-in ALS 1 mrt 2016
Paper Citations
- Feussner G, Funke H, Weng W, Assmann G, Lackner KJ, Ziegler R.Severe type III hyperlipoproteinemia associated with unusual apolipoprotein E1 phenotype and epsilon 1/’null’ genotype. Eur J Clin Invest. 1992 Sep;22(9):599-608. PubMed.
- Kamboh MI, Aston CE, Perez-Tur J, Kokmen E, Ferrell RE, Hardy J, DeKosky ST.A novel mutation in the apolipoprotein E gene (APOE*4 Pittsburgh) is associated with the risk of late-onset Alzheimer’s disease. Neurosci Lett. 1999 Mar 26;263(2-3):129-32. PubMed.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW.Apolipoprotein E2-Christchurch (136 Arg—-Ser). Nieuwe variant van menselijke apolipoproteïne E bij een patiënt met type III hyperlipoproteïnemie. J Clin Invest. 1987 Aug;80(2):483-90. PubMed.
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C, Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM.ApoE4 verergert duidelijk tau-gemedieerde neurodegeneratie in een muismodel van tauopathie. Nature. 2017 Sep 28;549(7673):523-527. Epub 2017 Sep 20 PubMed.
- Jansen WJ, Ossenkoppele R, Knol DL, Tijms BM, Scheltens P, Verhey FR, Visser PJ, Amyloid Biomarker Study Group, Aalten P, Aarsland D, Alcolea D, Alexander M, Almdahl IS, Arnold SE, Baldeiras I, Barthel H, van Berckel BN, Bibeau K, Blennow K, Brooks DJ, van Buchem MA, Camus V, Cavedo E, Chen K, Chetelat G, Cohen AD, Drzezga A, Engelborghs S, Fagan AM, Fladby T, Fleisher AS, van der Flier WM, Ford L, Förster S, Fortea J, Foskett N, Frederiksen KS, Freund-Levi Y, Frisoni GB, Froelich L, Gabryelewicz T, Gill KD, Gkatzima O, Gómez-Tortosa E, Gordon MF, Grimmer T, Hampel H, Hausner L, Hellwig S, Herukka SK, Hildebrandt H, Ishihara L, Ivanoiu A, Jagust WJ, Johannsen P, Kandimalla R, Kapaki E, Klimkowicz-Mrowiec A, Klunk WE, Köhler S, Koglin N, Kornhuber J, Kramberger MG, Van Laere K, Landau SM, Lee DY, de Leon M, Lisetti V, Lleó A, Madsen K, Maier W, Marcusson J, Mattsson N, de Mendonça A, Meulenbroek O, Meyer PT, Mintun MA, Mok V, Molinuevo JL, Møllergård HM, Morris JC, Mroczko B, Van der Mussele S, Na DL, Newberg A, Nordberg A, Nordlund A, Novak GP, Paraskevas GP, Parnetti L, Perera G, Peters O, Popp J, Prabhakar S, Rabinovici GD, Ramakers IH, Rami L, Resende de Oliveira C, Groove JO, Rodrigue KM, Rodríguez-Rodríguez E, Roe CM, Rot U, Rowe CC, Rüther E, Sabri O, Sanchez-Juan P, Santana I, Sarazin M, Schröder J, Schütte C, Seo SW, Soetewey F, Soininen H, Spiru L, Struyfs H, Teunissen CE, Tsolaki M, Vandenberghe R, Verbeek MM, Villemagne VL, Vos SJ, van Waalwijk van Doorn LJ, Waldemar G, Wallin A, Wallin ÅK, Wiltfang J, Wolk DA, Zboch M, Zetterberg H.Prevalentie van cerebrale amyloïd pathologie bij personen zonder dementie: een meta-analyse. JAMA. 2015 May 19;313(19):1924-38. PubMed.
- Wolters FJ, Yang Q, Biggs ML, Jakobsdottir J, Li S, Evans DS, Bis JC, Harris TB, Vasan RS, Zilhao NR, Ghanbari M, Ikram MA, Launer L, Psaty BM, Tranah GJ, Kulminski AM, Gudnason V, Seshadri S, E2-CHARGE investigators.De invloed van APOE-genotype op overleving: Resultaten van 38.537 deelnemers uit zes populatiegebaseerde cohorten (E2-CHARGE). PLoS One. 2019;14(7):e0219668. Epub 2019 Jul 29 PubMed.
- Chiang GC, Insel PS, Tosun D, Schuff N, Truran-Sacrey D, Raptentsetsang ST, Jack CR, Aisen PS, Petersen RC, Weiner MW, .Hippocampal atrophy rates and CSF biomarkers in elderly APOE2 normal subjects. Neurology. 2010 Nov 30;75(22):1976-81. PubMed.
- Fennema-Notestine C, Panizzon MS, Thompson WR, Chen CH, Eyler LT, Fischl B, Franz CE, Grant MD, Jak AJ, Jernigan TL, Lyons MJ, Neale MC, Seidman LJ, Tsuang MT, Xian H, Dale AM, Kremen WS.Aanwezigheid van ApoE ε4 allel geassocieerd met dunnere frontale cortex op middelbare leeftijd. J Alzheimers Dis. 2011;26 Suppl 3:49-60. PubMed.
- Shaw P, Lerch JP, Pruessner JC, Taylor KN, Rose AB, Greenstein D, Clasen L, Evans A, Rapoport JL, Giedd JN.Cortical morphology in children and adolescents with different apolipoprotein E gene polymorphisms: an observational study. Lancet Neurol. 2007 Jun;6(6):494-500. PubMed.
- Molinuevo JL, Gramunt N, Gispert JD, Fauria K, Esteller M, Minguillon C, Sánchez-Benavides G, Huesa G, Morán S, Dal-Ré R, Camí J.The ALFA project: Een onderzoeksplatform om vroege pathofysiologische kenmerken van de ziekte van Alzheimer te identificeren. Alzheimers Dement (N Y). 2016 Jun;2(2):82-92. Epub 2016 Mar 3 PubMed.
- Arenaza-Urquijo EM, Przybelski SA, Lesnick TL, Graff-Radford J, Machulda MM, Knopman DS, Schwarz CG, Lowe VJ, Mielke MM, Petersen RC, Jack CR, Vemuri P.The metabolic brain signature of cognitive resilience in the 80+: beyond Alzheimer pathologies. Brain. 2019 Apr 1;142(4):1134-1147. PubMed.
- Harrison TM, Maass A, Baker SL, Jagust WJ.Brain morphology, cognition, and β-amyloid in older adults with superior memory performance. Neurobiol Aging. 2018 Jul;67:162-170. Epub 2018 Mar 27 PubMed.
- Conejero-Goldberg C, Gomar JJ, Bobes-Bascaran T, Hyde TM, Kleinman JE, Herman MM, Chen S, Davies P, Goldberg TE.APOE2 verbetert neuroprotectie tegen de ziekte van Alzheimer via meerdere moleculaire mechanismen. Mol Psychiatry. 2014 Feb 4; PubMed.
- Mishra A, Ferrari R, Heutink P, Hardy J, Pijnenburg Y, Posthuma D, International FTD-Genomics Consortium.Gene-based association studies report genetic links for clinical subtypes of frontotemporal dementia. Brain. 2017 Apr 5; PubMed.
- Wu L, Zhao L.ApoE2 and Alzheimer’s disease: time to take a closer look. Neural Regen Res. 2016 Mar;11(3):412-3. PubMed.
Verder lezen
Geen verder lezen