Abstract
Het doel van deze studie, die zich concentreert op een klein aantal gevallen, is het behandelen van het angiosarcoom van de borst, dat minder dan 1% van alle weke delen borsttumoren vertegenwoordigt, en tenslotte onze ervaring te delen. Als gevolg van de borstsparende therapie (BCT) die tegenwoordig de standaardbehandeling is, is een nieuw type angiosarcoom op de voorgrond getreden: Radiation-Induced Angiosarcoma (RIAS).
Hier wordt een retrospectieve analyse gerapporteerd van de karakteristieke kenmerken van RIAS-patiënten, samen met een verslag van de geïntegreerde behandeling en de uitkomst van zes gevallen van RIAS die van 2013 tot 2018 in onze instelling werden behandeld.
Borstangiosarcoom als gevolg van chirurgie en radioterapie is zelden geregistreerd, maar het is een gedocumenteerde complicatie van bestralingsbehandeling voor borstkanker, met een hoog recidiefpercentage en slechte uitkomsten.
Het blijft klinisch, radiologisch en histologisch een uitdaging, en dus is een hoge verdenkingsindex vereist bij vatbare patiënten. Eenvoudige mastectomie is de primaire behandelingsoptie, maar er wordt steeds meer onderzoek gedaan naar het gebruik van radiotherapie en chemotherapie, elk met een variabele mate van succes. Herbestraling kan worden overwogen om de lokale controle te vergroten, terwijl chemotherapie kan worden overwogen voor gevallen in een verder gevorderd stadium.
Afkorting
RIAS: Radiation-Induced Angiosarcoma; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: Magnetic Resonance Imaging; IMRT: Intensiteit Gemoduleerde Radiotherapie
Keywords
Borst angiosarcoom (AS), Stralingsgeïnduceerd angiosarcoom (RIAS), Radicale mastectomie (RM), Stralingsgeïnduceerde tumoren, Adjuvante radiotherapie, Intensiteit Gemoduleerde Radiotherapie (IMRT)
Inleiding
In dit werk worden diagnose, behandeling, en resultaat van RIAS bij een klein aantal patiënten met borstkanker besproken.
Als een zeer zeldzame vasculaire tumor, kan borst angiosarcoom (AS) worden onderverdeeld in primair, als het ontstaat zonder een bekende precursor, of secundair, als het ontstaat op de plaats van eerder bestraalde huid, in welk geval het bekend staat als een Radiation-Induced Angiosarcoma (RIAS) van de borst . Maar er bestaan nog steeds geen op bewijs gebaseerde richtlijnen voor de ideale behandeling van angiosarcomen.
Bij patiënten die borstbesparende chirurgie met adjuvante radiotherapie ondergaan, varieert de geschatte incidentie van RIAS tussen 0,05 en 0,3%, wat overeenkomt met minder dan 1% van de borsttumoren en met ongeveer 3% van alle weke delen sarcomen.
De incidentie van RIAS lijkt toe te nemen, misschien als gevolg van de lange latentietijd voor de ontwikkeling van deze tumoren na de wijdverbreide toepassing van adjuvante radiotherapie voor borstkanker.
De diagnose van RIAS van de borst wordt vaak uitgesteld vanwege het goedaardige uiterlijk en de moeilijkheid om het te onderscheiden van de niet-specifieke huidveranderingen veroorzaakt door voorafgaande bestraling of door een andere ziekte. Ook de radiologische bevindingen zijn vaak niet-specifiek. Hoewel RIAS zich gewoonlijk 10 jaar na de bestraling voor borstkanker ontwikkelt, kan de latentietijd variëren van 6 maanden tot 20 jaar, waardoor sommige auteurs menen dat het waarschijnlijk te weinig wordt gerapporteerd en dat de werkelijke incidentiecijfers dus hoger liggen. Aangezien de incidentie van borstkanker toeneemt, heeft het gebruik van borstsparende chirurgie gevolgd door radiotherapie de radicale mastectomie als standaardbehandeling vervangen. De daarmee gepaard gaande incidentie van RIAS neemt eveneens toe, met een geschatte cumulatieve incidentie van 0,9-3,2 per 1000 gevallen van borstkanker . In een grote cohortstudie op bevolkingsniveau werd een voorgeschiedenis van voorafgaande radiotherapie als behandeling voor borstkanker geassocieerd met een 26-voudige toename van het risico op het ontwikkelen van angiosarcoom in vergelijking met niet-bestraalde controlegroepen. De prognose voor patiënten met RIAS blijft slecht, met 5-jaars overlevingspercentages variërend van 27 tot 48%. Ondanks het feit dat RIAS voor het eerst werd beschreven in het begin van de jaren 1920, is de moleculaire biologie ervan nog steeds controversieel en is er bijgevolg geen gerichte therapie beschikbaar.
Momenteel wordt agressieve chirurgische resectie algemeen aanbevolen als de behandeling van keuze. Er is een gebrek aan gegevens die de werkzaamheid van adjuvante chemotherapie aantonen.
Chirurgie, in de vorm van brede excisie of mastectomie, is de belangrijkste pijler van de behandeling bij gelokaliseerde ziekte. Sommige studies hebben een verband gerapporteerd tussen R0 marges en verbeterde overlevingskans, hoewel niet is aangetoond dat dit onafhankelijk is van andere biologische factoren, zoals tumorgrootte. Er zijn aanwijzingen dat neoadjuvante chemotherapie de resultaten bij de behandeling van het angiosarcoom kan verbeteren, maar de zeldzaamheid daarvan beperkt onze kennis tot case reports of kleine retrospectieve case series .
Om een populatie van patiënten met RIAS te karakteriseren, behandeld in ons ziekenhuis gedurende een periode van 5 jaar, hebben wij een retrospectieve studie uitgevoerd waarin het nut van mammografie, echografie, en magnetische resonantie beeldvorming (MRI) voor onze diagnose werd geanalyseerd .
Onze werkzaamheden zijn gerapporteerd in overeenstemming met de SCARE-criteria .
Materialen en methoden
Onze case-serie betreft patiënten met histologisch bewezen angiosarcoom van de borst, ontwikkeld na radiotherapie voor borstkanker, tussen 2013 en 2018, en analyseert behandelingsstrategieën met een multidisciplinaire aanpak.
De getroffen patiënten, zes vrouwen met door bestraling geïnduceerd angiosarcoom van de borst, werden geïdentificeerd door middel van een uitgebreide zoekopdracht in de bovengenoemde periode van het kankerregister van onze instelling, in het Universitair Ziekenhuis van Catania. De gemiddelde leeftijd was 70 jaar, range: 59-79 jaar oud. De patiënten hadden de voorgaande diagnostische en therapeutische behandeling in verschillende instellingen ondergaan, zodat de informatie niet allemaal beschikbaar is. De kenmerken van de patiënten en de behandelingsprocedures die na de diagnose van RIAS werden uitgevoerd, staan beschreven in tabel 1. Alle patiënten hadden een borstsparende behandeling ondergaan op het moment van de diagnose, met adjuvante radiotherapie toegediend door conventionele 3-dimensionale conforme radiotherapie tot een totale dosis van 50 Gy, met dagelijkse fractionering van 2 Gy, met of zonder een tumorbed boost van 10 Gy. De tumoren waren rechtszijdig bij 3 patiënten, en linkszijdig bij de andere 3. Tijdens de adjuvante behandeling kregen vijf van de zes patiënten systemische chemotherapie op basis van anthracycline, volgens de richtlijnen van de instelling, terwijl alle patiënten adjuvante hormonale therapie met tamoxifen/aromataseremmers kregen. Geen enkele patiënt had HER2-positieve kanker op het moment van de diagnose.
Tijdens de follow-up, na een mediane periode van 7,6 jaar (range: 5-11 jaar), werd de diagnose van ipsilateraal borstangiosarcoom gesteld: de meest frequent door de patiënten vertoonde tekenen bij aanvang waren rood-violet gekleurde huidknobbeltjes, gelokaliseerd in de context van bestralingsvelden, met een matig variabele groeisnelheid van enkele weken tot 4-6 maanden. Bij alle patiënten werd een histologische bevestiging van secundair angiosarcoom verkregen en in alle gevallen werd een radicale mastectomie uitgevoerd. Om RIAS te diagnosticeren werden de criteria van Cahan en Arlen gevolgd: een sarcoom dat ontstaat binnen het eerder bestraalde gebied; een latentietijd van ten minste 3 jaar tussen de radiotherapie en de ontwikkeling van het sarcoom; en een histologisch onderscheid tussen het secundaire sarcoom en het primaire neoplasma. Alle zes patiënten ondergingen een volledig radiologisch onderzoek met mammografie, echografie en MR (in 4/6 patiënten) in een poging om de klinische verdenking van RIAS te bevestigen, maar er werden geen pathognomonische kenmerken geïdentificeerd. De groeiende belangstelling van de wetenschappelijke literatuur voor het identificeren van specifieke kenmerken van “stralingshandtekening” heeft nog geen geconsolideerde gegevens opgeleverd. Drie van de zes patiënten uit onze case-serie waren het onderwerp van een immunohistochemische studie voor de evaluatie van MYC-expressie, die bij dergelijke patiënten een hoge expressie had aangetoond. Tabel 1 vermeldt ook de tumorhistologische kenmerken. De datum van de RIAS-diagnose werd gedefinieerd als de dag waarop de histologische diagnose werd gesteld. De latentietijd werd gedefinieerd als de tijd tussen de eerste bestralingssessie en de datum van de RIAS-diagnose. Slechts één patiënt vertoonde synchrone metastasen (in de long) bij het stellen van de diagnose RIAS, terwijl de andere vijf patiënten alleen borstziekten vertoonden.
Tabel 1: Kenmerken van de patiënten en behandelingsprocedures. Bekijk tabel 1
Alle patiënten die in ons ziekenhuis werden geopereerd, werden in een preoperatieve fase besproken tijdens een multidisciplinaire sarcoomvergadering. Patiënten werden geclassificeerd als patiënten met een resectabele ziekte indien de preoperatieve beoordeling aangaf dat een negatieve marge van 2 cm of meer kon worden bereikt door chirurgie met of zonder plastisch-chirurgische reconstructie in de vorm van een enkele pediclede of vrije myocutane flap. Indien de gewenste negatieve marges een uitgebreidere reconstructie vereisen, zoals met uitgebreide resurfacing door grote huidtransplantatie, zou de patiënt worden geclassificeerd als een patiënt met irresectabele ziekte.
Snel progressieve ziekte, waarbij het ziektevolume in een tijdsbestek van 2-3 weken toenam van geschikt voor mastectomie alleen of in combinatie met een pedicled flap tot het vereisen van uitgebreidere reconstructie, werd ook in oncologische termen als irresectabel beoordeeld.
Preoperatieve biopten werden uitgevoerd om de aanwezigheid van AS te bevestigen en andere ziekten uit te sluiten.
Macroscopisch werd complete resectie overwogen door de opererend chirurg. Histologisch werd de resectie geclassificeerd als R0 (microscopisch negatief) als de negatieve marges meer dan 1 cm omtreksgewijs waren of R1 (microscopisch positief) als de tumor zich uitstrekte tot of binnen minder dan 1 cm van de resectie marge.
Vier patiënten werden gerekruteerd voor onmiddellijke herbestraling, terwijl één patiënte na 13 maanden werd behandeld toen een pariëtaal recidief optrad (zij had onmiddellijke herbestraling geweigerd), de laatste patiënt werd uitgesloten van herbestraling, omdat hij bij de vorige behandeling de dosislimieten voor het hart had bereikt. De beslissing over de toediening van adjuvante chemotherapie werd geval per geval genomen, op basis van de beschikbare gegevens met betrekking tot de eerder ontvangen behandelingen en de prestatiestatus van de patiënten. Eén patiënte kreeg vier cycli epirubicine-ifosfamide chemotherapie, één epirubicine alleen gedurende zes cycli, drie werden om medische redenen uitgesloten (leeftijd, comorbiditeiten of tolerantiedosis van de anthracyclines die al eerder was bereikt). Eén patiënte kreeg wekelijks paclitaxel gedurende 12 cycli voor synchrone longmetastasen.
Radiotherapie werd toegediend rekening houdend met de doses ontvangen van gezonde weefsels bij de voorafgaande bestraling en de voorafgaande toediening van anthracyclines. Om deze redenen hebben wij ervoor gekozen de herbestraling uit te voeren door middel van intensiteitgemoduleerde radiotherapie (IMRT, zie figuur 1), met een step-and-shoot techniek, volgens de procedures van onze instelling. De stralingsdosis en het fractioneringsschema die werden gebruikt varieerden: twee patiënten kregen conventionele fractionering tot 50 Gy, twee patiënten kregen 40 Gy (omdat de tijd die was verstreken sinds de vorige bestraling kort was en het neoplasma zich op de linkerborst bevond), één patiënt 35 Gy in 5 Gy fractionering eenmaal per week (wegens verminderde klinische therapietrouw).
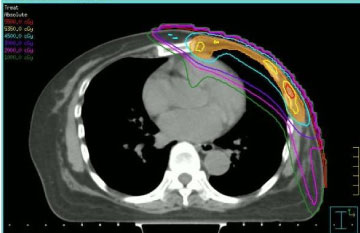 Figuur 1: Transversaal CT-beeld met stapsgewijze intensiteitgemoduleerde dosisverdeling. Bekijk afbeelding 1
Figuur 1: Transversaal CT-beeld met stapsgewijze intensiteitgemoduleerde dosisverdeling. Bekijk afbeelding 1
Resultaten
Er werden geen positieve marges gerapporteerd bij de patiënten die een radicale mastectomie hadden ondergaan, uitgevoerd door hetzelfde chirurgische team.
Na de radicale mastectomie ondergingen de patiënten de behandeling zoals gepland, zonder onderbrekingen, zowel voor chemotherapie als voor bestralingstherapie. Bij een mediane follow-up tijd van 22 jaar (range: 1,5-4 jaar), zijn drie patiënten in leven, zonder aanwijzingen van recidief of progressieve ziekte. Eén patiënt met synchrone pulmonale metastasen bij diagnose ondergaat nog steeds actieve oncologische behandeling. Eén patiënte ontwikkelde long- en botmetastasen, maar is ten tijde van de indiening van het verslag nog in leven. De laatste twee patiënten ontwikkelden longmetastasen, waarvan één geassocieerd met lokaal recidief, en overleden na 8-10 maanden (verdeling van patiëntkenmerken in relatie tot ziektepresentatie en ontvangen behandeling wordt beschreven in Tabel 1). Over het geheel genomen was de ziektevrije overleving 14 maanden voor vijf patiënten zonder systemische ziekte bij diagnose van RIAS, terwijl de progressievrije overleving voor synchrone metastatische patiënt bij diagnose 12 maanden was.
Zoals we mogen verwachten, werden slechtere overlevingsresultaten, gerapporteerd in de literatuur, opgemerkt bij patiënten die zich presenteerden met een lokaal gevorderde ziekte die ongeschikt was voor chirurgische behandeling in vergelijking met de gevallen in onze serie. Deze factoren onderstrepen het belang van een vroege diagnose bij RIAS-patiënten. Angiosarcomen presenteren zich vaak sluipend met paarse of rode huidveranderingen en kunnen gemakkelijk worden aangezien voor blauwe plekken of goedaardige huidveranderingen, wat leidt tot vertraagd onderzoek en diagnose. Vroege opsporing en snelle doorverwijzing kunnen het aantal patiënten met irresectabele ziekte mogelijk verminderen en zowel de lokale als de distante ziektecontrole verbeteren.
Discussie
Tumoren veroorzaakt door bestraling ontstaan meestal in de context of aan de rand van het bestralingsveld waar de dosis niet uniform is en lager kan uitvallen dan nodig is om celvernietiging te induceren, of mutaties te veroorzaken die tot het carcinogeneseproces kunnen leiden. Als gevolg van ioniserende straling brengen in levende organismen geïnduceerde chemische en biochemische modificaties functionele en morfologische veranderingen in de cellen teweeg die biologische schade veroorzaken. Elke cel die zich kan repliceren, kan potentieel kankerverwekkend worden; indien de cellen die chromosomale wijzigingen vertonen aan de normale cellulaire controle ontsnappen, kan carcinogenese optreden.
De waarschijnlijkheid dat zich tumoren ontwikkelen bij patiënten die bestralingstherapie ondergaan voor de behandeling van borstkanker is zeer gering en kan het gebruik van radiotherapie, wanneer geïndiceerd, niet beperken. Stralingsdoses van meer dan 50 Gy induceren celdood en lagere doses (
Er zijn talrijke studies die de correlatie hebben gesuggereerd tussen het ontstaan van sarcomen van weke delen en de bestralingsbehandelingen die zijn uitgevoerd om borsttumoren te behandelen. Radiotherapie verhoogt het risico op het ontstaan van sarcomen van de weke delen en in het bijzonder op het ontstaan van angiosarcomen. RIAS vertegenwoordigt ongeveer minder dan 1% van de borsttumoren. Radio-geinduceerd angiosarcoom heeft vele klinische verschijningsvormen: patiënten vertonen vaak asymptomatische huidveranderingen die nauwelijks te onderscheiden zijn van de gewone actinische veranderingen die kunnen worden aangetroffen na de radiotherapiebehandeling op de borst. Patiënten vertonen vaak een palpabele zwelling, een paarsrode zone die lijkt op een hematoom. Angiosarcomen kunnen verward worden met goedaardige manifestaties zoals angiomen of atypische telangiectasieën. Paarse papels of erythemateuze knobbels kunnen ook voorkomen.
Ondanks alle therapeutische inspanningen varieert het vijfjaarsoverlevingspercentage van 27% tot 62,8% (2-3). Hoewel RIAS zich typisch 10 jaar na bestralingsbehandelingen voor borstkanker ontwikkelt, kan de latentietijd variëren van 6 maanden tot 20 jaar. Radiogeïnduceerd angiosarcoom is niet te onderscheiden van spontaan angiosarcoom, maar er kunnen wel enkele verschillen worden vastgesteld: Lae, et al. vergeleken de c-myc amplificatie op chromosoom 8q24.21 in 32 RASB specimens en 15 sporadische angiosarcoom specimens .
In onze serie vertoonden de patiënten niet-specifieke ziekteverschijnselen, maar de diagnose werd in de meerderheid van de gevallen snel gesteld. De latentieperiode was in overeenstemming met die welke in de literatuur werd gerapporteerd, met een mediane tijd van 76 jaar.
RIAS staat erom bekend een hoog recidiefpercentage te hebben. Lokaal recidief, hetzij in het tumorbed of langs het chirurgische litteken, wordt naar verluidt in een meerderheid (96%) van de gevallen van RIAS vastgesteld. Dat is waarschijnlijk te wijten aan multifocale groei van het RIAS of resten van kwaadaardig weefsel na de operatie, zelfs met negatieve chirurgische marges. Metastatische ziekte, meestal naar de longen en de lever, kan tegelijkertijd of kort na lokale recidieven aanwezig zijn. Abbott, et al. beoordeelden retrospectief alle gevallen van RIAS gepubliceerd vanaf 2017 en vatten de gegevens samen . De auteurs vonden dat het lokale recidiefpercentage 59% was en dat de mediane tijd tot het recidief 6 maanden was (range, 1-78 maanden). Zij vonden ook dat metastatische ziekte meestal werd voorafgegaan door ten minste één lokaal recidief en dat de meest voorkomende locaties de longen, de contralaterale borst, en het skelet waren. Bovendien suggereerde hun histologisch overzicht van 42 gevallen dat slecht gedifferentieerde RIAS geassocieerd was met een hoog risico op metastasering, terwijl goed gedifferentieerde tumoren een hoger risico op lokaal recidief vertoonden en niet op verre metastasen.
Radiation-induced sarcoma is een zeldzame maar zeer agressieve neoplasma. De behandeling ervan is een punt van discussie, omdat er geen behandelingsrichtlijnen beschikbaar zijn, de prognose slecht is en de 5-jaars overlevingskans sterk varieert, zoals eerder gemeld. Niettemin wordt agressieve chirurgische resectie algemeen aanbevolen als de behandeling van keuze.
Chirurgie, in de vorm van mastectomie met of zonder plastische reconstructie, is de behandeling van keuze bij patiënten die een gelokaliseerde ziekte vertonen. In de serie patiënten die onder behandeling zijn, is het mogelijk om microscopisch volledige (R0) resectiemarges te bereiken bij meer dan 80%. RIAS presenteren zich typisch als multifocale laesies. De neiging van deze pathologie om microsatellietafzettingen te creëren kan bijdragen tot de moeilijkheid om lokale controle te verkrijgen.
Het belang van het uitvoeren van een volledige pathologische resectie is in de literatuur benadrukt, hoewel er geen standaardrichtlijnen betreffende de aanbevolen afstand van ruiming zijn gepubliceerd. In de huidige serie bleken degenen die een lokaal recidief ontwikkelden, nauwere marges te hebben dan degenen die dat niet deden. De marginale status bleek in deze serie echter niet onafhankelijk prognostisch te zijn voor de oncologische resultaten. Dit zou suggereren dat het vermogen om grotere marges te bereiken afhangt van andere biologische tumorfactoren die ook de uitkomst bepalen, zoals de grootte. Het is waarschijnlijk dat de tumorbiologie hoofdzakelijk verantwoordelijk is voor het resultaat in RIAS, en hoewel de initiële chirurgie gericht moet zijn op macroscopische klaring, moet ervoor worden gewaarschuwd dat het bereiken van grotere negatieve marges niet noodzakelijkerwijs gelijkstaat met betere resultaten voor de patiënt.
Ondanks het toenemende aantal studies die zich richten op chemotherapie en radiotherapie, zowel neoadjuvant als adjuvant, blijft hun rol onduidelijk. Er zijn geen gegevens die de werkzaamheid van adjuvante chemotherapie aantonen, maar recente gegevens suggereren dat radiotherapie nuttig kan zijn om recidieven te voorkomen. Adjuvante radiotherapie na chirurgie maakt volgens Johnstone et al. een betere lokale controle mogelijk. De rol van IMRT bij de behandeling van de borstwand wordt momenteel geëvalueerd, omdat het de incidentie van stralingstoxiciteit kan verminderen door de bestraling van organen die risico lopen (OAR’s) te verminderen. In een vergelijkende studie van de dosimetrie melden de auteurs dat het IMRT-plan voor de borstwand en het doel, in vergelijking met conventionele behandelingen, het mogelijk maakt de maximumdosis te verlagen en de minimumdosis te verhogen, wat resulteert in een betere conformiteit en uniformiteit van het doelvolume .
De rol en de doeltreffendheid van chemotherapie zijn niet vastgesteld omdat de beschikbare gegevens afkomstig zijn van kleine groepen, waaruit geen definitieve conclusies kunnen worden getrokken, maar waarschijnlijk kunnen patiënten met een hogere graad van maligniteit, G3 en met recidief, het meest profiteren van neo- of adjuvante chemotherapie .
Het gebruik van neo/adjuvante chemotherapie bleek ook geassocieerd te zijn met verbeterde lokale ziektecontrole in een grote retrospectieve serie van patiënten met door bestraling geïnduceerde sarcomen van alle plaatsen, hoewel niet geassocieerd met verbeterde percentages van systemisch recidief of overleving. Adjuvante chemotherapie bleek geen voordeel op te leveren in termen van lokale controle of algehele overleving in een studie van hoog-risico sarcomen van weke delen die werden behandeld met chirurgie en bestraling. Er is dus weinig bewijs dat neoadjuvante chemotherapie een overlevingsvoordeel oplevert bij RIAS, hoewel het zeker nuttig kan zijn als inductietherapie voorafgaand aan een operatie bij patiënten met een lokaal gevorderde ziekte en daarnaast patiënten effectieve verzachting van de ziekte kan bieden. Gerichte therapieën kunnen een alternatieve behandeling bieden bij patiënten met progressieve ziekte.
In onze serie hebben wij, als gevolg van de hoge neiging tot lokaal recidief van deze neoplasma, besloten alle patiënten een tweede bestraling voor te stellen, met uitzondering van één van hen vanwege de hierboven genoemde dosimetrische problemen. Eén patiënt weigerde onmiddellijke herbestraling en de behandeling werd uitgevoerd bij een recidief. Het was niet mogelijk om voor alle patiënten een homogene bestralingsbehandeling te programmeren, wegens de heterogeniteit van de steekproef voor eerder gebruikte bestralingsdoses, slechte klinische therapietrouw in één geval en, vooral, gebrek aan duidelijke aanwijzingen in de literatuur en de richtlijnen. In elk geval hebben wij besloten de behandeling toe te dienen door middel van een intensiteitgemoduleerde techniek, om een adequate dosisverdeling mogelijk te maken, een vermindering van de dosisblootstelling van de omliggende gezonde weefsels, vooral voor het onderliggende pulmonale parenchym en het hart.
Conclusies
Radiotherapie bij de behandeling van borstkanker is geassocieerd met een verhoogd risico op later sarcoom, maar het risicopercentage is zeer laag.
RIAS is een zeldzame, agressieve weke-delenlaesie met beperkte behandelingsmogelijkheden en hoge percentages van zowel lokaal als systemisch recidief.
Zorgvuldige observatie na adjuvante radiotherapie is vereist. De standaardbehandeling bestaat uit chirurgie met eenvoudige mastectomie en adjuvante radiotherapie. De chemotherapie kan een rol spelen bij het verminderen van de lokaal gevorderde ziekte, maar heeft geen bewezen effect op de overleving.
Angiosarcoom komt beduidend vaker voor in gevallen die met radiotherapie zijn behandeld, en komt vooral voor in of grenzend aan het bestralingsveld. Het kleine verschil in risico op later sarcoom voor borstkankerpatiënten die radiotherapie kregen, weegt niet op tegen het voordeel van radiotherapie.
Onze serie is echter te klein om definitieve conclusies te trekken en dit is een beperking van de studie. Verdere evaluatie is noodzakelijk, ook door een groter aantal casestudies, om een betere classificatie van de pathologie te hebben en een nauwkeuriger multidisciplinair beheer mogelijk te maken.
Belangenconflicten
Geen van de auteurs heeft belangenconflicten bekend te maken.
Bronnen van financiering
Geen.
Ethische goedkeuring
Goedkeuring is verleend door de ethische commissie van de Universiteit van Catania.
Informed Consent
Voor publicatie van deze casusbeschrijving en bijbehorende afbeeldingen is schriftelijke geïnformeerde toestemming verkregen van de patiënt. Een kopie van de schriftelijke toestemming is beschikbaar voor beoordeling door de Editor-in-Chief van dit tijdschrift op aanvraag.
Author Contributions
Trovato Agata: Reviewing and editing the article.
Registration of Research Studies
None.
Disclosure
None of the authors have anything to dislose.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Primary and secondary angiosarcoma of the breast. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Long-term outcomes in patients with radiation-associated angiosarcomas of the breast following surgery and radiotherapy for breast cancer. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma: a large-scale single-institution review. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Cutaneous radiation-associated angiosarcoma of the breast: poor prognosis in a rare secondary malignancy. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Clinical management of secondary angiosarcoma after breast conservation therapy. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Radiation-induced sarcoma of the breast: a systematic review. Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Increased risk of soft tissue sarcoma after radiotherapy in women with breast carcinoma. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Radiation-associated angiosarcoma after breast cancer: high recurrence rate and poor survival despite surgical treatment with R0 resection. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Surgical management of radiation-induced angiosarcoma after breast conservation therapy. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Gelokaliseerde angiosarcomen: de identificatie van prognostische factoren en analyse van de impact van de behandeling. A retrospective analysis from the French Sarcoma Group (GSF/GETO) Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Thalidomide gecombineerd met neoadjuvante chemotherapie bij angiosarcoom van de borst met complete pathologische respons: case report and review of literature. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Neoadjuvante chemotherapie voor primair cutaan/zacht weefsel angiosarcoom: het bepalen van tumorgedrag voorafgaand aan chirurgische resectie. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Contralaterale lymfekliermetastasen bij een vrouw met nieuwe primaire borstkanker: Systemische desease of locoregionale diffusie? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement: Consensus-based chirurgische case report guidelines. Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Secondary sarcomas after radiotherapy for breast cancer: sustained risk and poor survival. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) Kan c-myc amplificatie een betrouwbaar onderscheid maken tussen postradiatie en primair angiosarcoom van de borst? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiosarcoma van de borst na chirurgie en radiotherapie voor borstkanker. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarcoma after breast-conserving therapy. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Dosimetrische evaluatie van geïntegreerde IMRT-behandeling van de borstwand en supraclaviculaire regio voor borstkanker na gemodificeerde radicale mastectomie. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Adjuvante chemotherapie met doxorubicine, ifosfamide, en lenograstim voor gerecteerd weke delen sarcoom (EORTC 62931): een multicentrische gerandomiseerde gecontroleerde trial. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Breast tuberculosis cases rising in Sicily. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Rol, timing en techniek van radiotherapie bij pediatrisch pleuropulmonaal synoviaal sarcoom. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Intensiteitgemoduleerde radiotherapie voor recidiverend maligne pleuraal mesothelioom. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Single-institution experience of intensity-modulated radiotherapy for malignant pleural mesothelioma at University of Catania. Future Oncol 14: 17-21.
Citation
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) A Single Institution Study Experience of Secondary Breast Angiosarcoma after Breast Conserving Treatment: Multidisciplinair Management. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114