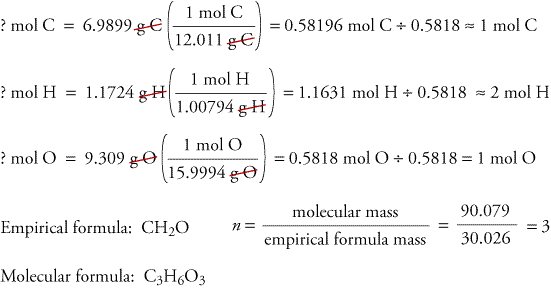Opstellen van empirische en moleculaire formules uit verbrandingsgegevens
Empirische en moleculaire formules voor verbindingen die alleen koolstof en waterstof (CaHb) of koolstof, waterstof en zuurstof (CaHbOc) bevatten, kunnen worden bepaald met een proces dat verbrandingsanalyse wordt genoemd. De stappen voor deze procedure zijn
Weeg een monster van de te analyseren verbinding en plaats het in het apparaat dat in de afbeelding hieronder is afgebeeld.
Verbrand de verbinding volledig. De enige producten van de verbranding van een verbinding die alleen koolstof en waterstof (CaHb) of koolstof, waterstof en zuurstof (CaHbOc) bevat, zijn kooldioxide en water.
De H2O en CO2 worden door twee buizen gezogen. De ene buis bevat een stof die water absorbeert, en de andere een stof die kooldioxide absorbeert. Weeg elk van deze buizen voor en na de verbranding. De massatoename in het eerste buisje is de massa H2O die bij de verbranding is gevormd, en de massatoename in het tweede buisje is de massa CO2 die is gevormd.
Aanname dat alle koolstof in de verbinding is omgezet in CO2 en in het tweede buisje is opgesloten. Bereken de massa koolstof in de verbinding uit de massa koolstof in de gemeten massa gevormde CO2.
Aannem dat alle waterstof in de verbinding is omgezet in H2O en in de eerste buis is opgesloten. Bereken de massa waterstof in de verbinding uit de massa waterstof in de gemeten massa water.
Als de verbinding behalve koolstof en waterstof ook zuurstof bevat, bereken dan de massa zuurstof door de massa koolstof en waterstof af te trekken van de totale massa van het oorspronkelijke monster van de verbinding.
Gebruik deze gegevens om de empirische en moleculaire formules op de gebruikelijke manier te bepalen.
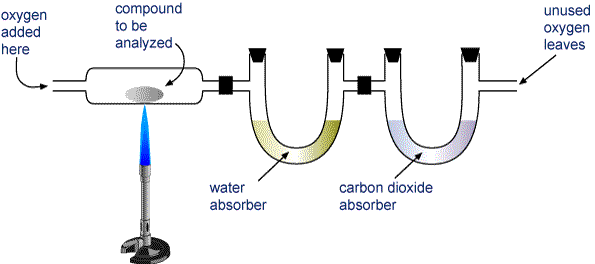
Apparaat voor verbrandingsanalyse Een verbinding die koolstof en waterstof (CaHb) of koolstof, waterstof en zuurstof (CaHbOc) bevat, wordt volledig verbrand tot H2O en CO2. De producten worden door twee buizen gezogen. De eerste buis absorbeert water, en de tweede buis absorbeert kooldioxide.
Om te illustreren hoe empirische en moleculaire formules kunnen worden bepaald uit gegevens die zijn afgeleid van verbrandingsanalyse, laten we eens kijken naar een stof die trioxaan wordt genoemd. Formaldehyde, CH2O, is onstabiel als zuiver gas en vormt gemakkelijk een mengsel van een stof die trioxaan wordt genoemd en een polymeer dat paraformaldehyde wordt genoemd. Daarom wordt formaldehyde opgelost in een oplosmiddel, zoals water, voordat het wordt verkocht en gebruikt. De molecuulformule van trioxaan, dat koolstof, waterstof en zuurstof bevat, kan worden bepaald aan de hand van de gegevens van twee verschillende experimenten. Bij het eerste experiment wordt 17,471 g trioxaan verbrand in het hierboven afgebeelde apparaat, waarbij 10,477 g H2O en 25,612 gCO2 ontstaan. Bij het tweede experiment wordt de molecuulmassa van trioxaan vastgesteld op 90,079.
U kunt de molecuulformule van een verbinding berekenen uit de empirische formule en de molecuulmassa. (Zie de tekst voor een herinnering van hoe dit wordt gedaan.) Om de empirische formule te krijgen, moeten we de massa in grammen bepalen van de koolstof, waterstof en zuurstof in 17,471 g trioxaan. We moeten dus de volgende algemene stappen uitvoeren.
Eerst, omrekenen van de gegeven gegevens naar grammen koolstof, waterstof en zuurstof.
Tweede, bepaal de empirische formule uit de grammen koolstof, waterstof en zuurstof.
Terde, bepaal de molecuulformule uit de empirische formule en de gegeven molecuulmassa.
Omdat we aannemen dat alle koolstof in trioxaan heeft gereageerd tot CO2, kunnen we de massa van koolstof in 17,471 g trioxaan vinden door de massa van koolstof in 25,612 g CO2 te berekenen.

Omdat we aannemen dat alle waterstof in trioxaan heeft gereageerd tot H2O, kunnen we de massa van waterstof in 17,471 g trioxaan vinden door de massa van waterstof in 10..477 g H2O.

Omdat trioxaan alleen koolstof, waterstof en zuurstof bevat, kunnen we de massa van zuurstof berekenen door de massa’s koolstof en waterstof af te trekken van de totale massa van trioxaan.
? g O = 17,471 g trioxaan – 6,9899 g C – 1,1724 g H = 9.309 g O
We berekenen nu de empirische formule, de empirische formule massa, en de moleculaire formule.
Studieblad: Berekening van moleculaire formules uit verbrandingsgegevens
Tip: U wilt de moleculaire formule berekenen van een verbinding die alleen koolstof en waterstof (CaHb) of koolstof, waterstof en zuurstof (CaHbOc) bevat, en u krijgt de moleculaire massa en de massa’s CO2 en H2O die ontstaan bij de verbranding van een gegeven massa van de verbinding.
Algemene procedure
Bereken het aantal gram koolstof in de verbinding door het aantal gram koolstof in de gegeven hoeveelheid CO2 te berekenen.

Bereken het aantal grammen waterstof in de verbinding door het aantal grammen waterstof in de gegeven hoeveelheid H2O te berekenen.

Als de verbinding zuurstof bevat, berekent u het aantal grammen zuurstof erin door de massa’s koolstof en waterstof af te trekken van de gegeven totale massa van de verbinding.
? g O = (gegeven) g totaal – (berekend) g C – (berekend) g H
Bereken de empirische formule van de verbinding uit de grammen koolstof, waterstof en zuurstof.
Bereken de formulemassa voor de empirische formule en deel de gegeven molecuulmassa door de massa van de empirische formule om n te krijgen.
Vermenigvuldig elk van de subscripts in de empirische formule met n om de molecuulformule te krijgen.
EXAMENVATTING – Het verkrijgen van een Molecuulformule uit Verbrandingsgegevens:
Dianabol is een van de anabole steroïden die door sommige atleten wordt gebruikt om de omvang en kracht van hun spieren te vergroten. Het is vergelijkbaar met het mannelijk hormoon testosteron. Sommige studies wijzen uit dat de gewenste effecten van het middel minimaal zijn, en de bijwerkingen, waaronder steriliteit en een verhoogd risico op leverkanker en hartziekten, weerhouden de meeste mensen ervan het te gebruiken. De moleculaire formule van Dianabol, die bestaat uit koolstof, waterstof en zuurstof, kan worden bepaald aan de hand van de gegevens van twee verschillende experimenten. In het eerste experiment wordt 14,765 g Dianabol verbrand, waarbij 43,257 g CO2 en 12,395 g H2O worden gevormd. In het tweede experiment wordt de moleculaire massa van Dianabol vastgesteld op 300,44. Wat is de molecuulformule van Dianabol?
Oplossing: