Gezien de overvloed aan functies die een bioreactor moet vervullen, vraag je je misschien af hoe hij dat allemaal kan doen. Welke onderdelen heeft hij nodig? Hoe weet je wat de huidige condities in de bioreactor zijn en hoe je die kunt corrigeren? En tenslotte, gewoon voor perspectief: hoe neem je de gegevens die zijn vastgelegd tijdens een batch bioproces, geef ze op een zinvolle manier weer, en sla ze vervolgens op en evalueer ze terwijl je ze georganiseerd houdt?
De belangrijkste procesparameters en de mechanismen om ze te reguleren worden hieronder behandeld:
- Kweek mengen
- Temperatuurregeling
- PH-regeling
- Voeding van voedingsstoffen
- Gassing
- Druk controle
- Voorkomen van schuimvorming
Kweek mengen
De kweek in een bioreactor moet steeds grondig gemengd worden. Als de voedingsstoffen in de bioreactor niet goed genoeg worden verspreid, zullen de omstandigheden in bepaalde delen van de bioreactor sterk afwijken van het ideale. De pH zou bijvoorbeeld te zuur kunnen zijn, of de toevoer van nutriënten zou onvoldoende kunnen zijn. Dergelijke afwijkingen verminderen niet alleen de efficiëntie van het geplande bioproces, maar kunnen ook genetische modificaties in de hand werken. De temperatuurverdeling is een extra punt van zorg. Zonder gelijkmatig roeren zullen de micro-organismen of celculturen aan de rand van het vat letterlijk worden gekookt, terwijl die in het midden koude voeten krijgen. Als u ooit soep in de magnetron hebt opgewarmd en die vervolgens vol verwachting hebt opgegeten zonder te roeren, weet u wat we bedoelen.
De typische roersnelheid varieert onder meer naar gelang van het gekweekte organisme:
| Organisme | Mengsnelheid | ||||
| Bacteriën, Gist, Fungi | 500 – 1500 min-1 | ||||
| Zoogdier, Insecten- of Plantencellen | 30 – 300 min-1 | ||||
Aanpassing van de roersnelheden voor het cultiveren van micro-organismen, plantencellen, dierlijke cellen of insectencellen is zeer belangrijk, aangezien deze verschillend reageren op afschuifspanning, d.w.z.e., de mechanische belasting die door roeren wordt veroorzaakt. Afhankelijk van de cellijn kunnen celculturen veel heftiger reageren op te krachtig roeren, d.w.z. dat zij gewoon afsterven, een tendens die wetenschappers nauwkeuriger (en diplomatieker) omschrijven als “gevoelig voor afschuifspanning”. De beschikbaarheid van zuurstof kan tijdens het bioproces worden gevarieerd door de roersnelheid te veranderen, waardoor een optimale celgroei wordt gegarandeerd.
Meten en regelen van de temperatuur
Micro-organismen en celculturen hebben enzymen die het best werken binnen bepaalde temperatuur- en pH-bereiken. Als de omstandigheden buiten deze bereiken vallen, zal het gewenste bioproces veel trager verlopen, omdat de groei en de metabolische prestaties sterk afhankelijk zijn van deze enzymen, d.w.z. katalytisch actieve eiwitten. In het ergste geval kunnen ongunstige milieuomstandigheden deze enzymen zelfs vernietigen. Zoogdiercelculturen voelen zich het prettigst binnen een zeer smal temperatuurbereik – een bereik dat vanuit hun perspectief alleen aanwezig is wanneer de temperatuur in het kweekvat 37 °C bedraagt.
Daarom wordt in de bioreactor een platina weerstandssensor, bekend als een Pt100-sensor, gebruikt om de temperatuur te bepalen. Deze heeft een weerstand van 100 Ω bij 0 °C, en dekt het verwachte biologisch relevante meetbereik vrij goed af wanneer hij op de juiste wijze is gekalibreerd.
Het typische temperatuurbereik varieert onder meer naar gelang van het gekweekte organisme:
| Organisme | Temperatuurbereik | ||||
| Bacteriën, Gist, Fungi | +20 °C tot +60 °C | ||||
| Mammalian, Insecten- of plantencellen | +25 °C tot +37 °C | ||||
Als u werkt bij temperaturen in de buurt van of onder kamertemperatuur, hebt u een actief koelsysteem nodig, zoals een recirculerende koelmachine. Voor de meeste bioprocessen moet de temperatuur tijdens de gehele kweek constant blijven. Voor sommige producten echter, zoals penicilline of recombinante proteïnen (d.w.z. met behulp van genetisch gemodificeerde organismen geproduceerde proteïnen), activeert een verandering van de temperatuur aan het einde van de groeifase belangrijke genen voor de productvorming en is derhalve gunstig. Bij productiemethoden met celculturen wordt de temperatuur soms ook verlaagd aan het einde van het bioproces (een techniek die in de biotechnologie bekend staat als “temperatuurverschuiving”), zodat het eindproduct stabiel blijft voor later gebruik.
Er zijn verschillende manieren om een verwarmings- en/of koelcircuit te gebruiken om de temperatuur te regelen:
-
-
- Een elektrisch verwarmingsblok met ingebouwde koelspiraal
- Een siliconen verwarmingskussen dat na sterilisatie om het kweekvat wordt gewikkeld
- Een dubbele mantel waarin water wordt rondgepompt. De temperatuur wordt geregeld via een elektrisch verwarmingselement of stoom en een magneetklep voor de koelwatertoevoer
-
Meting en regeling van de pH
Meting en regeling van de pH is een zeer belangrijk aspect van bioprocessen, aangezien veranderingen in de pH de groeiomstandigheden aanzienlijk kunnen wijzigen – meestal met grote gevolgen. Kweekmedia bevatten gewoonlijk buffers, d.w.z. stoffen die te plotselinge veranderingen in de pH-waarde, veroorzaakt door de toevoeging van een zuur of base, afzwakken. Omdat een zuur dat in het kweekmedium druppelt vele cellijnen kan beschadigen, verrijken wetenschappers het gasmengsel dat in de celkweek wordt gebruikt vaak zorgvuldig met CO2 in plaats van een vloeibaar zuur toe te voegen. Het gas lost dan op in het kweekmedium, waardoor de kooldioxide de pH kan beïnvloeden in combinatie met een buffer.
Typische pH-bereiken afhankelijk van het gekweekte organisme:
| Organisme | pH | ||||
| Bacteriën, Gist, Schimmels | 4.5 – 7.0 | ||||
| Zoogdiercellen | 6.7 – 7.4 | ||||
| Insectencellen | 6.2 – 6.9 | ||||
| Plantencellen | 5.5 | ||||
Voor het meten van de pH tijdens het bioproces is elke bioreactor uitgerust met een pH-sensor die bekend staat als een combinatie-elektrode voor pH. De bioreactor kan eventuele afwijkingen van de pH corrigeren; daartoe wordt een zure en/of een basische oplossing ter beschikking gesteld die via slangen en pompen met het kweekvat is verbonden. De concentratie van het zuur en van de base moet met vaardigheid worden gekozen om dit te laten werken – als de concentratie te hoog is, kunnen de druppels geconcentreerd zuur of geconcentreerde base de micro-organismen en de celculturen beschadigen voordat zij in de bioreactor worden verdeeld. Is de concentratie daarentegen te laag, dan zal de gebruiker meer zuur of base moeten toevoegen, waardoor het kweekmedium onnodig wordt verdund.
Nutriënten toevoegen
Tijdens een bioproces verbruiken micro-organismen gewoonlijk een breed scala van nutriënten. De basissamenstelling van een voedingsbodem bestaat gewoonlijk uit water, een bruikbare energiebron voor het organisme (b.v. glucose), alsmede de voedingsstoffen die het nodig heeft (koolstof, stikstof en fosfor), zouten en sporenelementen. Afhankelijk van het organisme zijn andere verbindingen nodig die niet door het organisme zelf kunnen worden gesynthetiseerd (vitamines, essentiële aminozuren, enz.).
Afhankelijk van de strategie van het bioproces worden deze voedingsstoffen ofwel allemaal aan het begin van het bioproces beschikbaar gesteld (batchbioproces), ofwel in de loop van de tijd toegevoegd, zoals in een fed-batch of in een continuproces.
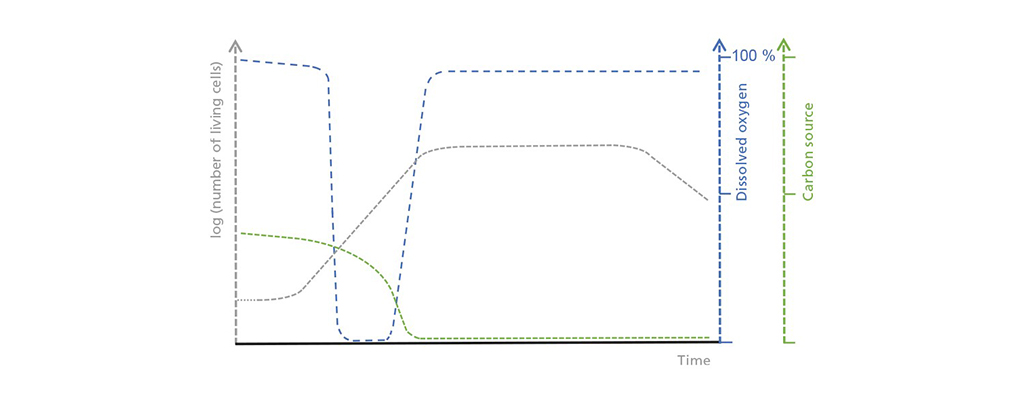
Schematische weergave van de correlaties tussen de concentratie levende cellen, opgeloste zuurstof en de beperkende koolstofbron bij batchprocédés. In de eerste lagefase neemt het aantal levende cellen slechts langzaam toe, wat leidt tot een matige maar gestage opname van de koolstofbron. Tijdens de exponentiële groeifase neemt het zuurstofverbruik toe tot het de mogelijke zuurstofinput overstijgt. Zodra de koolstofbron is uitgeput, begint de stationaire fase die wordt gevolgd door een dode fase, waarin het aantal levende cellen drastisch afneemt.
Als je meer wilt weten over de verschillende voedingsstrategieën, kijk dan eens naar onze blog-post: The Difference Between Batch, Fed-batch and Continuous Processes.
Gassing
Tijdens het bioproces wordt in de bioreactor een steriel gasmengsel, zoals lucht, in het kweekmedium gevoerd. Door constant te roeren worden niet alleen de voedingsstoffen verdeeld, maar wordt ook de grootte van de gasbellen die in het kweekvat ontstaan, verkleind, waardoor zuurstof efficiënt in de voedingsoplossing vrijkomt. Dit is belangrijk, omdat micro-organismen en celculturen alleen de zuurstof kunnen opnemen die in de voedingsoplossing is opgelost.
De behoefte aan zuurstof varieert: aërobe bacteriën hebben zuurstof nodig, terwijl andere de voorkeur geven aan gasmengsels zoals synthesegas (“syngas”). Anaërobe organismen daarentegen kunnen volledig zonder vergassing en voeden zich alleen met anorganische en organische stoffen uit het kweekmedium, zoals nitraat of fumaraat.
In tegenstelling tot micro-organismen worden celculturen met meer dan alleen lucht vergast – het zuurstofgehalte van het gasmengsel kan ook worden beïnvloed met behulp van zuivere stikstof en zuivere zuurstof. De exacte samenstelling is afhankelijk van de toepassing van de celcultuur. Om de gasatmosfeer constant te houden, heeft de bioreactor nauwkeurige regelsystemen nodig.
In het begin van het bioproces heeft een cultuur bijvoorbeeld vaak minder zuurstof nodig – en dus een kleinere gastoevoer – omdat de groei nog langzaam verloopt. Later is voor snellere groei echter veel meer zuurstof nodig. De bioreactor zorgt niet alleen voor een constante toevoer van het gewenste gas of gasmengsel, maar levert ook de juiste hoeveelheid gas op het juiste moment. Daartoe heeft de bioreactor gaspoorten die zijn aangesloten op perslucht uit het gebouw, een compressor of een gasfles.
De vergassingssnelheid wordt meestal gemeten in liters per minuut. Om een generieke parameter te hebben die op verschillende bioreactoren kan worden toegepast, wordt de snelheid ook vaak aangeduid als de specifieke vergassingssnelheid, die betrekking heeft op veelvouden van het werkvolume (vatvolumes per minuut, vvm) en wordt uitgedrukt als min-1. Een typische waarde voor microbiële bioprocessen is 1 tot 1,5 maal het werkvolume per minuut. Voor een bioreactor met een werkvolume van 4 L zou de maximale vergassingssnelheid dus 4 L * 2 L-1 min-1 = 8 L min-1 bedragen. In celculturen daarentegen bedraagt de maximumsnelheid vaak 10% tot 15% van het werkvolume per minuut om de gasbellen klein te houden en zo schuimvorming en schade aan cellen door barstende bellen te voorkomen.
Het wijzigen van de gassnelheid is echter niet de enige manier om de efficiëntie te regelen waarmee de bioreactor zuurstof en andere gassen aan het kweekmedium levert. Hoe groter de oppervlakte van het totale aantal gasbellen in de bioreactor – d.w.z. hoe fijner de gasbellen zelf verdeeld zijn – des te efficiënter zal de zuurstof van de gasfase naar de vloeistoffase worden overgebracht. Dit betekent bijvoorbeeld dat het verhogen van de roersnelheid de oxygenatie voor de micro-organismen kan verbeteren, aangezien de roerder de gasbellen nog kleiner maakt en zo het totale oppervlak van alle gasbellen in de bioreactor vergroot.
Nauwkeurige regeling van de pO2 – en dus nauwkeurige regeling van de vergassingssnelheid en de gassamenstelling – is zeer belangrijk, aangezien de pO2 normaliter niet de groeiremmende factor voor de kweek mag zijn. Bij onvoldoende controle wordt de pO2 echter wel de beperkende factor.
Omdat de gastoevoer naar de bioreactor meestal droog is, kan tijdens het vergassen vocht uit de bioreactor in de uitgangsstroom worden verzameld. Bij een hoge vergassingssnelheid zou niet alleen het vulniveau dalen, maar het vocht zou ook het uitlaatfilter blokkeren, waardoor een goede ontluchting niet kan plaatsvinden en de druk kan oplopen. Om dit effect te vermijden, zijn bioreactoren uitgerust met een efficiënte uitlaatkoeler waar het vocht in de uitlaat condenseert en kan terugdruppelen in de bioreactor voordat het het uitlaatfilter bereikt.
Meting en regeling van de druk
Hoe hoger de druk in het vat, hoe meer zuurstof er wordt opgelost. Kweekvaten van glas zijn vaak slechts goedgekeurd voor een druk van maximaal 0,5 bar, wat nog niet eens de helft is van de druk van een matig gevulde fietsband. Bij een hogere werkdruk kunnen licht beschadigde glazen kweekvaten barsten, wat een veiligheidsrisico inhoudt. Daarom moet u altijd zorgen voor een vrije, drukloze uitlaatleiding uit de bioreactor door het uitlaatfilter droog te houden en regelmatig te vervangen – daarbij zorgt u natuurlijk ook voor de integriteit van het kweekvat. In tegenstelling tot glazen kweekvaten zijn roestvrijstalen bioreactoren ontworpen voor hogere drukken en zijn ze, zelfs in hun standaardconfiguratie, geschikt voor drukken tot 2 bar (een goed gevulde fietsband). Bovendien zijn dergelijke systemen vaak uitgerust met een drukregelingsmechanisme op basis van een druksensor in de bioreactor en een proportionele klep in de uitlaatleiding. Deze kunnen niet alleen de druk in de bioreactor meten, maar ook actief regelen.

Voorkomen van schuimvorming
Behalve in badkuipen en bierglazen is schuim een nogal impopulair neveneffect, vooral in bioreactoren. Schuim vormt zich op het grensvlak tussen de vloeibare en de gasfase in het kweekvat en kan snel onder de bovenplaat terechtkomen. In het ergste geval blokkeert het dan het uitlaatfilter, dat op zijn beurt de gasstroom blokkeert. De meeste bioreactoren zijn daarom uitgerust met een systeem om schuimvorming tegen te gaan. Mechanische schuimbrekers in de kopruimte zijn voorbehouden aan vrij grote roestvrijstalen bioreactoren, terwijl antischuimbestrijdingssystemen op basis van chemische middelen (zoals PPG, Struktol of antischuimmiddelen op basis van silicium) te vinden zijn in kleinere bioreactoren.
Een typisch antischuimbestrijdingssysteem bestaat uit een sensor die op een specifieke hoogte in het kweekvat is aangebracht. Als de schuimhoogte de sensor bereikt, wordt een antischuimmiddel vanuit een reservoir in het kweekvat gepompt. Deze antischuimmiddelen zijn actief op het grensvlak tussen vloeistof en gas en vergroten de neiging van de schuimbellen om in elkaar te zakken. In bijzonder hardnekkige gevallen waarin het schuim niet onmiddellijk oplost, moet de procedure na een vooraf ingestelde tijd worden herhaald (een “shot & delay”-strategie). Voorzichtigheid is geboden bij het gebruik van een antischuimmiddel – als u zelfs maar iets meer doseert dan nodig is, kan het als een tweede huid op het oppervlak van de vloeistof gaan liggen, waardoor de gasuitwisseling wordt belemmerd. Antischuimmiddelen gaan ook een efficiënte zuurstofoverdracht tegen, omdat de verandering in oppervlaktespanning het samenklappen van gasbellen in de bioreactor bevordert, waardoor het voor gasuitwisseling beschikbare oppervlak kleiner wordt. De keuze van het juiste middel hangt ook af van het bioproces in kwestie, omdat bacteriën en cellen verschillend reageren op bepaalde chemicaliën.
Bonus: de voordelen van het gebruik van een SCADA-software
Nu moeten de resultaten die in een bioreactor worden gegenereerd zo centraal mogelijk worden verzameld en geëvalueerd, omdat dit de enige manier is om moderne, big data-algoritmen effectief toe te passen om meer informatie te genereren en beter te begrijpen hoe een proces werkt. Dat is de taak van de SCADA-software. In de eerste stap kunnen alle gegevens van de bioreactor worden uitgelezen – zonder noemenswaardige input van de gebruiker – en centraal worden opgeslagen om ze op zichzelf te evalueren of te vergelijken met andere batchgegevens. Dit brengt u snel op ideeën voor nieuwe experimenten en mogelijk zelfs complexe batchstrategieën. Met een professionele SCADA-software kunt u deze eenvoudig plannen en vervolgens de bioreactor aansturen, wat idealiter een volledig geautomatiseerd proces zal zijn. Bovendien integreert de SCADA-software ook verschillende componenten in de bioreactoromgeving. Daartoe behoren hulpmiddelen voor procesoptimalisatie met behulp van de “design-of-experiment” (DoE) techniek of krachtige softwaresensoren, die tegelijkertijd kunnen worden gebruikt om rechtstreeks uit de batchprocesparameters aanvullende informatie te berekenen en zelfs om die parameters te regelen. Zo kan bijvoorbeeld het ademhalingsquotiënt (RQ) worden gebruikt om een schatting van de metabolische activiteit te verkrijgen door middel van de verhouding tussen uitgescheiden kooldioxide en geabsorbeerde zuurstof.
Er zijn zoveel mogelijkheden – vooral wanneer de bioreactor en SCADA-software perfect op elkaar zijn afgestemd – dat we ze onmogelijk allemaal kunnen beschrijven. Als u meer wilt weten over wat een moderne SCADA-software allemaal te bieden heeft, kijk dan eens naar de eve® bioprocess platform software
