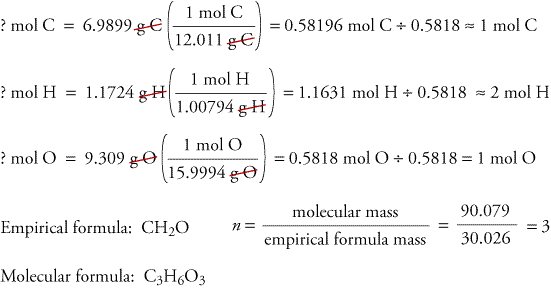Uzyskiwanie Wzorów Empirycznych i Molekularnych z Danych Spalania
Wzory empiryczne i molekularne dla związków, które zawierają tylko węgiel i wodór (CaHb) lub węgiel, wodór i tlen (CaHbOc) mogą być określone w procesie zwanym analizą spalania. Kroki dla tej procedury są
Zważ próbkę związku, który ma być analizowany i umieść ją w aparacie pokazanym na poniższym obrazku.
Spal całkowicie związek. Jedynymi produktami spalania związku, który zawiera tylko węgiel i wodór (CaHb) lub węgiel, wodór i tlen (CaHbOc), są dwutlenek węgla i woda.
H2O i CO2 są wciągane przez dwie rurki. Jedna rurka zawiera substancję, która pochłania wodę, a druga zawiera substancję, która pochłania dwutlenek węgla. Zważ każdą z tych probówek przed i po spaleniu. Przyrost masy w pierwszej probówce to masa H2O, która powstała podczas spalania, a przyrost masy dla drugiej probówki to masa powstałego CO2.
Załóż, że cały węgiel w związku został przekształcony w CO2 i uwięziony w drugiej probówce. Oblicz masę węgla w związku na podstawie masy węgla w zmierzonej masie powstałego CO2.
Załóżmy, że cały wodór w związku został przekształcony w H2O i uwięziony w pierwszej probówce. Oblicz masę wodoru w związku na podstawie masy wodoru w zmierzonej masie wody.
Jeśli związek zawiera tlen oraz węgiel i wodór, oblicz masę tlenu, odejmując masę węgla i wodoru od całkowitej masy oryginalnej próbki związku.
Użyj tych danych do wyznaczenia wzorów empirycznych i cząsteczkowych w zwykły sposób.
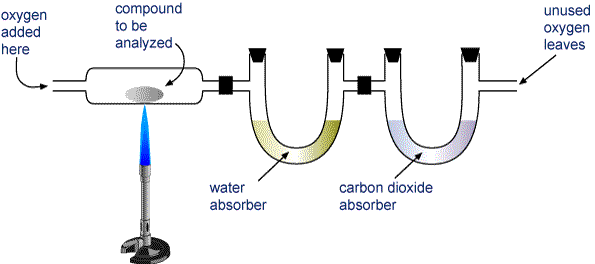
Aparatura do analizy spalania Związek zawierający węgiel i wodór (CaHb) lub węgiel, wodór i tlen (CaHbOc) spala się całkowicie tworząc H2O i CO2. Produkty są pobierane przez dwie rurki. Pierwsza rura pochłania wodę, a druga pochłania dwutlenek węgla.
Aby zilustrować, jak empiryczne i molekularne wzory mogą być ustalone z danych pochodzących z analizy spalania, rozważmy substancję zwaną trioksan. Formaldehyd, CH2O, jest niestabilny jako czysty gaz, łatwo tworząc mieszaninę substancji zwanej trioksanem i polimeru zwanego paraformaldehydem. Dlatego formaldehyd jest rozpuszczany w rozpuszczalniku, takim jak woda, zanim zostanie sprzedany i wykorzystany. Wzór molekularny trioksanu, który zawiera węgiel, wodór i tlen, może być określony przy użyciu danych z dwóch różnych eksperymentów. W pierwszym eksperymencie, 17,471 g trioksanu jest spalany w aparacie pokazanym powyżej, a 10,477 g H2O i 25,612 gCO2 są tworzone. W drugim doświadczeniu stwierdzono, że masa cząsteczkowa trioksanu wynosi 90,079.
Możemy otrzymać wzór cząsteczkowy związku z jego wzoru empirycznego i masy cząsteczkowej. (Zobacz tekst dla przypomnienia, jak to się robi.) Aby uzyskać wzór empiryczny, musimy określić masę w gramach węgla, wodoru i tlenu w 17,471 g trioksanu. Zatem musimy wykonać te ogólne kroki.
Po pierwsze, przekonwertować z podanych danych na gramy węgla, wodoru i tlenu.
Po drugie, wyznaczyć wzór empiryczny z gramów węgla, wodoru i tlenu.
Po trzecie, wyznaczyć wzór cząsteczkowy z wzoru empirycznego i podanej masy cząsteczkowej.
Ponieważ zakładamy, że cały węgiel w trioksanie przereagował do postaci w CO2, możemy znaleźć masę węgla w 17,471 g trioksanu przez obliczenie masy węgla w 25,612 g CO2.

Ponieważ zakładamy, że cały wodór w trioksanie przereagował tworząc H2O, możemy znaleźć masę wodoru w 17,471 g trioksanu, obliczając masę wodoru w 10.477 g H2O.

Ponieważ trioksan zawiera tylko węgiel, wodór i tlen, możemy obliczyć masę tlenu odejmując masy węgla i wodoru od całkowitej masy trioksanu.
? g O = 17,471 g trioksanu – 6,9899 g C – 1,1724 g H = 9.309 g O
Obliczymy teraz wzór empiryczny, masę wzoru empirycznego i wzór cząsteczkowy.
Przykładowy arkusz egzaminacyjny: Calculating Molecular Formulas from Combustion Data
Tip-off- Chcesz obliczyć wzór molekularny związku zawierającego tylko węgiel i wodór (CaHb) lub węgiel, wodór i tlen (CaHbOc), a masz jego masę cząsteczkową i masy CO2 i H2Oformed w spalaniu danej masy związku.
Procedura ogólna
Oblicz liczbę gramów węgla w związku, obliczając liczbę gramów węgla w danej ilości CO2.

Oblicz liczbę gramów wodoru w związku poprzez obliczenie liczby gramów wodoru w danej ilości H2O.

Jeśli związek zawiera tlen, oblicz liczbę gramów tlenu w nim zawartego, odejmując masy węgla i wodoru od podanej masy całkowitej związku.
? g O = (podana) g całkowita – (obliczona) g C – (obliczona) g H
Oblicz wzór empiryczny związku na podstawie gramów węgla, wodoru i tlenu.
Oblicz masę wzoru dla wzoru empirycznego i podziel podaną masę cząsteczkową przez masę wzoru empirycznego, aby otrzymać n.
Mnożymy każdy z indeksów we wzorze empirycznym przez n, aby otrzymać wzór cząsteczkowy.
PRZYKŁAD – Obtaining a Molecular Formula fromCombustion Data:
Dianabol jest jednym z sterydów anabolicznych, które zostały wykorzystane przez niektóreathletes do zwiększenia wielkości i siły ich mięśni. Jest on podobny do tothe męskiego hormonu testosteronu. Niektóre badania wskazują, że pożądane efekty ofthe leku są minimalne, a skutki uboczne, które obejmują bezpłodność iincreased ryzyko raka wątroby i choroby serca, zachować większość ludzi od usingit. Wzór molekularny Dianabol, który składa się z węgla, wodoru i tlenu, może być ustalona przy użyciu danych z dwóch różnych eksperymentów. In thefirst eksperymentu, 14,765 g Dianabol jest spalany, a 43,257 g CO2 i 12,395 g H2O są formed.In the second experiment, the molecular mass of Dianabol is found to be 300,44. Jaki jest wzór cząsteczkowy Dianabolu?
Rozwiązanie:

.