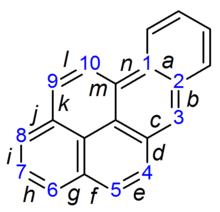
Układ nerwowyEdit
Wiadomo, że prenatalne narażenie na BaP u szczurów wpływa na uczenie się i pamięć w modelach gryzoni. Wykazano, że ciężarne szczury spożywające BaP mają negatywny wpływ na funkcjonowanie mózgu w późnym okresie życia ich potomstwa. W czasie, gdy synapsy są po raz pierwszy formowane i regulowane w sile przez aktywność, BaP zmniejszał zależną od receptora NMDA aktywność komórek nerwowych mierzoną jako ekspresja mRNA podjednostki receptora NMDA NR2B.
Układ odpornościowyEdit
BaP ma wpływ na liczbę białych krwinek, hamując niektóre z nich przed różnicowaniem się w makrofagi, pierwszą linię obrony organizmu do zwalczania infekcji. W 2016 roku odkryto, że mechanizm molekularny polega na uszkodzeniu integralności tratwy lipidowej błony makrofaga poprzez obniżenie poziomu cholesterolu w błonie o 25%. Oznacza to, że mniej immunoreceptorów CD32 (członek rodziny immunoreceptorów Fc) może związać się z IgG i przekształcić białą krwinkę w makrofag. Dlatego błony makrofagów stają się podatne na zakażenia bakteryjne.
Układ rozrodczyEdit
W doświadczeniach z udziałem samców szczurów wykazano, że subchroniczne narażenie na wdychany BaP powoduje ogólne zmniejszenie funkcji jąder i najądrzy z mniejszą produkcją steroidów płciowych/testosteronu i produkcją plemników.
RakotwórczośćEdit
Metabolity BaP są mutagenne i wysoce rakotwórcze, i jest on wymieniony jako czynnik rakotwórczy grupy 1 przez IARC. Chemical agents and related occupations, Volume 10, A review of Human Carcinogens, IARC Monographs, Lyon France 2009
W czerwcu 2016 r., BaP został dodany jako benzochryzen do Listy kandydackiej substancji wzbudzających szczególnie duże obawy do autoryzacji w ramach REACH.
Numeryczne badania od lat 70. udokumentowały powiązania między BaP a nowotworami. Trudniej było powiązać nowotwory z konkretnymi źródłami BaP, zwłaszcza u ludzi, i trudno było określić ilościowo ryzyko stwarzane przez różne metody narażenia (wdychanie lub spożycie). W 2005 r. opisano związek między niedoborem witaminy A a rozedmą płuc u palaczy, który miał być spowodowany BaP, który wywołuje niedobór witaminy A u szczurów.
Badanie z 1996 r. dostarczyło dowodów molekularnych łączących składniki dymu tytoniowego z rakiem płuc. Wykazano, że BaP powoduje uszkodzenia genetyczne w komórkach płuc, które były identyczne z uszkodzeniami obserwowanymi w DNA większości złośliwych nowotworów płuc.
Regularne spożywanie gotowanych mięs było epidemiologicznie związane ze zwiększonym poziomem raka jelita grubego (chociaż samo w sobie nie dowodzi rakotwórczości),Badanie NCI z 2005 r. wykazało, że zwiększone ryzyko gruczolaków jelita grubego było związane ze spożyciem BaP, a silniej ze spożyciem BaP ze wszystkich środków spożywczych. Jednak sama żywność nie musi być rakotwórcza, nawet jeśli zawiera śladowe ilości substancji rakotwórczych, ponieważ przewód pokarmowy chroni się przed nowotworami poprzez ciągłe zrzucanie swojej zewnętrznej warstwy. Ponadto enzymy detoksykacyjne, takie jak cytochromy P450, wykazują zwiększoną aktywność w jelitach w celu ochrony przed toksynami pochodzącymi z żywności. Tak więc w większości przypadków niewielkie ilości BaP są metabolizowane przed przedostaniem się do krwi. Płuca nie są chronione w żaden z tych sposobów.
Egzymy detoksykacyjne cytochromu P450 1A1 (CYP1A1) i cytochromu P450 1B1 (CYP1B1) są zarówno ochronne, jak i niezbędne dla toksyczności benzopirenu. Eksperymenty z wykorzystaniem szczepów myszy, u których usunięto (znokautowano) CYP1A1 i CYP1B1 wykazały, że CYP1A1 działa przede wszystkim w celu ochrony ssaków przed niskimi dawkami BaP, a usunięcie tej ochrony powoduje akumulację dużych stężeń BaP. Jeśli CYP1B1 nie zostanie również znokautowany, toksyczność wynika z bioaktywacji BaP do benzopirenu -7,8-dihydrodiolu-9,10-epoksydu, ostatecznego związku toksycznego.
Interakcje z DNAEdit

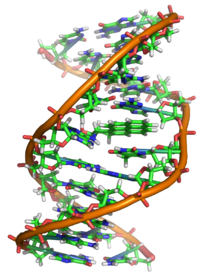
Właściwie BaP jest prokarcynogenem, co oznacza, że mechanizm kancerogenezy zależy od jego enzymatycznego metabolizmu do epoksydu diolu BaP. Interkaluje on w DNA, a elektrofilowy epoksyd jest atakowany przez nukleofilowe zasady guaninowe, tworząc nieporęczny addukt guaninowy.

Badania krystalografii rentgenowskiej i struktury magnetycznego rezonansu jądrowego wykazały, w jaki sposób to wiązanie zniekształca DNA, myląc strukturę dwuhelikalną DNA. To zakłóca normalny proces kopiowania DNA i powoduje mutacje, co wyjaśnia występowanie raka po ekspozycji. Ten mechanizm działania jest podobny do mechanizmu działania aflatoksyny, która wiąże się z pozycją N7 guaniny.
Istnieją przesłanki wskazujące na to, że epoksyd benzopirenu diolu w sposób szczególny celuje w ochronny gen p53. Gen ten jest czynnikiem transkrypcyjnym, który reguluje cykl komórkowy, a tym samym działa jako supresor nowotworu. Poprzez indukowanie transwersji G (guaniny) na T (tymidyny) w hotspotach transwersji w obrębie p53, istnieje prawdopodobieństwo, że diolowy epoksyd benzopirenu dezaktywuje zdolność tłumienia nowotworów w niektórych komórkach, prowadząc do raka.
Benzopiren-7,8-dihydrodiol-9,10-epoksyd jest rakotwórczym produktem trzech reakcji enzymatycznych:
- Benzopiren jest najpierw utleniany przez cytochrom P450 1A1, tworząc różne produkty, w tym (+)benzopiren-7,8-epoksyd.
- Produkt ten jest metabolizowany przez hydrolazę epoksydową, otwierającą pierścień epoksydowy w celu otrzymania (-)benzopirenu-7,8-dihydrodiolu.
- Końcowy czynnik rakotwórczy powstaje po kolejnej reakcji z cytochromem P450 1A1 w celu otrzymania (+)benzopirenu-7,8-dihydrodiolu-9,10-epoksydu. To właśnie ten epoksyd diolu wiąże się kowalencyjnie z DNA.
BaP indukuje cytochrom P4501A1 (CYP1A1) poprzez wiązanie się z AHR (receptor węglowodorów arylowych) w cytozolu. Po związaniu przekształcony receptor ulega translokacji do jądra, gdzie dimeryzuje z ARNT (aryl hydrocarbon receptor nuclear translocator), a następnie wiąże elementy odpowiedzi na ksenobiotyki (XREs) w DNA zlokalizowanym przed niektórymi genami. Proces ten powoduje wzrost transkrypcji niektórych genów, zwłaszcza CYP1A1, a następnie zwiększoną produkcję białka CYP1A1. Proces ten jest podobny do indukcji CYP1A1 przez niektóre polichlorowane bifenyle i dioksyny. Wydaje się, że aktywność CYP1A1 w błonie śluzowej jelita zapobiega przedostawaniu się znacznych ilości spożytego benzopirenu do krwi wrotnej i krążenia ogólnoustrojowego. Jelitowa, ale nie wątrobowa, ekspresja CYP1A1 zależy od receptora TOLL-like 2 (TLR2), który jest eukariotycznym receptorem dla struktur powierzchniowych bakterii, takich jak kwas lipoteichoinowy.
Co więcej, stwierdzono, że BaP aktywuje transpozon, LINE1, u ludzi.
.