Introduction
An enzym’s active sites are usually composed of amino acid residues; depending on which amino acid residues are present, the specificity of the substrate can vary greatly. W zależności od poziomu pH, właściwości fizyczne (głównie ładunek elektryczny) enzymu mogą ulec zmianie. Zmiana ładunku elektrycznego może zmienić interakcję pomiędzy resztami aminokwasowymi miejsca aktywnego a wchodzącym substratem. Dzięki temu substrat może wiązać się z miejscem aktywnym poprzez wiązanie wodorowe lub siły van der Waalsa. Gdy substrat zwiąże się z miejscem aktywnym, tworzy kompleks enzym-substrat, który jest następnie zaangażowany w dalsze reakcje chemiczne.
Aby enzym był aktywny i energetycznie korzystny, aby umożliwić postęp reakcji chemicznej, substrat musi związać się z „miejscem aktywnym” enzymu. O miejscu aktywnym można myśleć jak o zamku, a o substracie jak o kluczu; jest to znane jako model zamka i klucza. Klucz (substrat) musi zostać włożony i przekręcony (reakcja chemiczna), a następnie zamek (enzym) otwiera się (wytwarzanie produktów). Należy pamiętać, że enzym może mieć więcej niż jedno miejsce aktywne. Inną teorią dotyczącą relacji miejsce aktywne-substrat jest teoria indukowanego dopasowania, która jest przeciwieństwem teorii zamka i klucza (gdzie miejsce aktywne jest pozornie nieelastyczne). W teorii indukowanego dopasowania, miejsce aktywne enzymu jest bardzo elastyczne i zmienia swoją konformację tylko wtedy, gdy wiąże się z nim substrat.
Enzymy działają jako katalizator poprzez obniżenie swobodnej energii Gibbsa aktywacji kompleksu enzym-substrat. Poniżej znajdują się dwa rysunki przedstawiające podstawową reakcję enzymatyczną z katalizatorem i bez katalizatora:
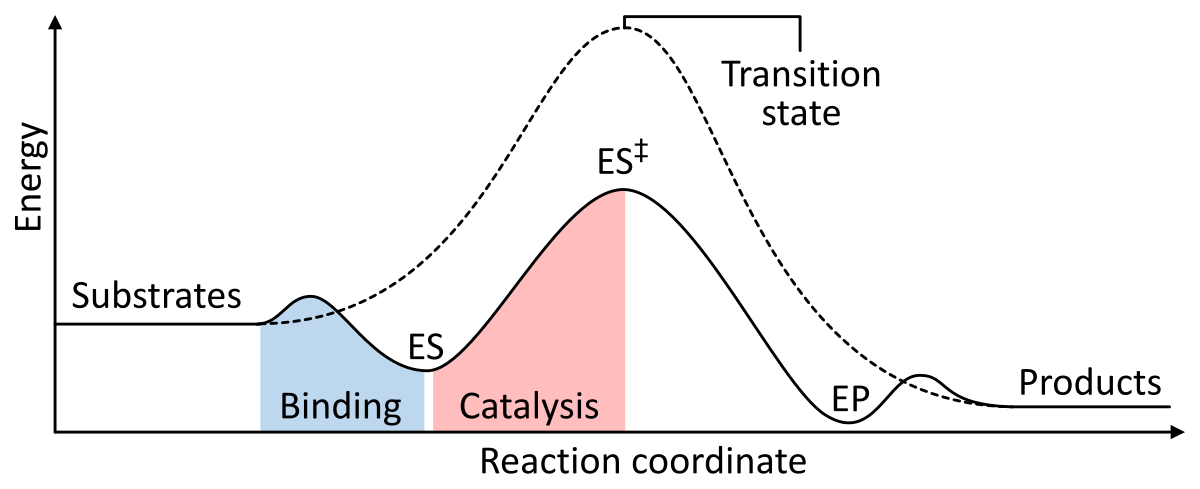
Rysunek 1: Energie etapów reakcji chemicznej. W stanie niekatalizowanym (linia przerywana), substraty potrzebują dużo energii aktywacji, aby osiągnąć stan przejściowy, który następnie rozpada się na produkty o niższej energii. Kiedy enzym jest katalizowany (linia ciągła), enzym wiąże substraty (ES), a następnie stabilizuje stan przejściowy (ES‡), aby zmniejszyć energię aktywacji wymaganą do wytworzenia produktów (EP), które są ostatecznie uwalniane. z Wikipedii.
Wydajność enzymu można określić w następujący sposób: rozważ prostą reakcję enzymatyczną:
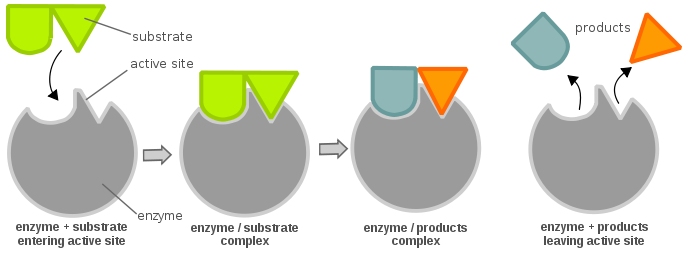
Niemiecki biochemik Leonor Michaelis i kanadyjska biochemiczka Maud Menten wyprowadzili równanie opisujące ten układ, znane później jako „równanie Michaelisa-Mentena”, przedstawione poniżej:
}{K_M + }
Równanie to podaje szybkość reakcji przy danym stężeniu substratu, zakładając znaną wartość Vmax, która jest maksymalną szybkością, z jaką może przebiegać reakcja, oraz KM, stałą Michaelisa. Jednakże, w praktycznym zastosowaniu równania Michaelisa-Mentena, V0 jest często mierzone, a Vmax jest obserwowane jako nasycenie lub plateau na wykresie danych. Ponieważ stężenie substratu jest znane, KM jest zwykle obliczoną wartością zainteresowania.
Dla \(K_M), załóż \(V_0= \dfrac{V_{max}}{2}}}:
}{K_M + }
}} \dfrac{V_{max}}{2} = V_{max} \tag{3}}
} = \dfrac{V_{max}}{2}} \tag{4}
= 2 \tag{5}}
\tag{6}}
O stałej Michaelisa można myśleć jako o szybkości, z jaką substrat odczepia się od enzymu, co może mieć miejsce albo w przypadku, gdy kompleks substrat-enzym staje się produktem, albo gdy substrat odczepia się od enzymu. KM można przedstawić w postaci równania.
Gdzie k-1 jest stałą szybkości, przy której substrat staje się niezwiązany z enzymem, co powoduje dysocjację kompleksu enzym-substrat, k2 jest stałą szybkości, przy której kompleks substrat-enzym znika i przekształca się w produkt, a K1 jest stałą szybkości tworzenia kompleksu substrat-enzym. Dlatego KM można postrzegać jako szybkość zanikania kompleksu substrat-enzym podzieloną przez szybkość tworzenia kompleksu substrat-enzym, czyli poziom, przy którym połowa substratu jest związana z enzymem. KM jest użytecznym wskaźnikiem obecności inhibitora, ponieważ możemy szukać zmian w KM i porównywać z naszą kontrolą (układy biologiczne, o których wiemy, że nie zawierają inhibitora). KM jest zmienną zależną, a jej wartość może się zmieniać z wielu powodów, w tym poziomu pH układu, temperatury lub innych warunków, które mogą wpływać na reakcję chemiczną. Małe KM wskazuje, że substrat ma wysokie powinowactwo do enzymu.
Równanie Michaelisa-Mentena jest najbardziej przydatne do pomiaru wydajności enzymu, jeśli v0 jest wykreślone względem , jak poniżej:
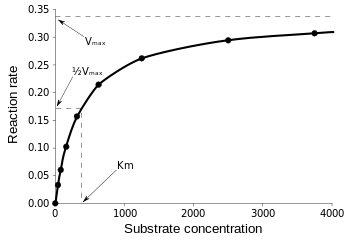
Rysunek 3: Wykres szybkości reakcji i stałej Michaelisa-Mentena. z Wikipedii.
Vmax to maksymalna szybkość, z jaką reakcja może przebiegać, niezależnie od , co oznacza, że nawet jeśli dodamy więcej substratu, reakcja nie może przebiegać szybciej. Dzieje się tak dlatego, że przy Vmax wszystkie miejsca aktywne na enzymie są zajęte. Po tych wszystkich wyjaśnieniach dotyczących różnych postaci równań kinetycznych enzymów, dochodzimy do naszego wniosku dotyczącego wydajności katalitycznej. Odwołując się z powrotem do Rys. 3, mamy:
{dfrac{k_{-1} + k_2}{k_1} + k_2 opisuje reakcję nieodwracalną, w przeciwieństwie do wyrażenia równowagowego, w porównaniu do k-1 i k1. k2 jest tu również znane jako kcat, czyli wydajność katalityczna enzymu. Z poprzedniej dyskusji wynika, że v0 to zmierzona szybkość reakcji, czyli tworzenie się produktu w czasie, więc można wywnioskować, że równanie wyglądałoby następująco:
}{dt} = k_2_0
Gdzie 0 to całkowite stężenie enzymu.
Wiadomo również, że VMax obserwuje się wtedy, gdy cały kompleks enzym-substrat znika i zamienia się w produkty, więc możemy przyjąć następujące założenie:
k_2_0 \tag{10}
i po przearanżowaniu mamy następujące równanie:
Jest to równanie do obliczania wydajności katalitycznej, które należy stosować po uzyskaniu danych z eksperymentów i po zastosowaniu równania Michaelisa-Mentena. Przy większym kcat , enzym jest wydajny, ponieważ potrzeba mniej enzymu.
.