Zważywszy na mnogość funkcji, które musi spełniać bioreaktor, możesz się zastanawiać, jak może to wszystko zrobić. Jakich komponentów potrzebuje? Skąd wiadomo, jakie warunki panują obecnie w bioreaktorze i jak można je poprawić? I na koniec, tak dla perspektywy: jak zebrać dane przechwycone podczas bioprocesu wsadowego, wyświetlić je w sensowny sposób, a następnie zapisać i ocenić, zachowując ich porządek?
Najważniejsze parametry procesu i mechanizmy ich regulacji są omówione poniżej:
- Mieszanie kultur
- Kontrola temperatury
- Kontrola pH
- Podawanie składników odżywczych
- Gazowanie
- Kontrola ciśnienia kontrola
- Zapobieganie tworzeniu się piany
Mieszanie kultur
Kultura w bioreaktorze musi być dokładnie mieszana przez cały czas. Jeśli składniki odżywcze w bioreaktorze nie są wystarczająco dobrze rozproszone, warunki w niektórych częściach bioreaktora będą znacznie odbiegać od ideału. Na przykład, pH może być zbyt kwaśne lub dostarczanie substancji odżywczych może być niewystarczające. Takie odchylenia nie tylko obniżają efektywność planowanego bioprocesu, ale mogą również sprzyjać modyfikacjom genetycznym. Dodatkowym problemem jest rozkład temperatury. Bez równomiernego mieszania, mikroorganizmy lub kultury komórkowe znajdujące się wzdłuż krawędzi naczynia zostaną dosłownie ugotowane, podczas gdy te znajdujące się w środku będą marzły. Jeśli kiedykolwiek podgrzałeś zupę w mikrofalówce, a następnie zjadłeś ją z wielką niecierpliwością bez mieszania, będziesz wiedział, co mamy na myśli.
Typowa prędkość mieszania różni się między innymi w zależności od uprawianego organizmu:
| Organizm | Prędkość mieszania | ||||
| Bakterie, Drożdże, Grzyby | 500 – 1500 min-1 | ||||
| Mammalian, Owady lub komórki roślinne | 30 – 300 min-1 | ||||
Dostosowanie prędkości mieszania do hodowli mikroorganizmów, komórek roślinnych, zwierzęcych lub owadzich jest bardzo ważne, ponieważ reagują one w różny sposób na stres ścinania, tj.e., odkształcenia mechaniczne spowodowane mieszaniem. W zależności od linii komórkowej, hodowle komórkowe mogą znacznie intensywniej reagować na zbyt energiczne mieszanie, tzn. po prostu obumierać, tendencja, którą naukowcy opisują dokładniej (i dyplomatycznie) jako „wrażliwość na stres ścinania”. Dostępność tlenu może być zróżnicowana podczas bioprocesu poprzez zmianę prędkości mieszania, zapewniając w ten sposób optymalny wzrost komórek.
Pomiar i kontrola temperatury
Mikroorganizmy i hodowle komórkowe mają enzymy, które działają najlepiej w określonych zakresach temperatury i pH. Jeśli warunki wykraczają poza te zakresy, pożądany bioproces będzie przebiegał znacznie wolniej, ponieważ wzrost i wydajność metaboliczna są w dużym stopniu zależne od tych enzymów, tj. katalitycznie aktywnych białek. W najgorszym przypadku, niekorzystne warunki środowiskowe mogą je nawet zniszczyć. Hodowle komórek ssaków czują się najlepiej w bardzo wąskim zakresie temperatur – takim, który z ich punktu widzenia jest obecny tylko wtedy, gdy temperatura wewnątrz naczynia hodowlanego wynosi 37 °C.
Dlatego w bioreaktorze do określania temperatury stosuje się platynowy czujnik rezystancyjny znany jako czujnik Pt100. Ma on rezystancję 100 Ω przy 0 °C i przy odpowiedniej kalibracji dość dobrze pokrywa oczekiwany biologicznie istotny zakres pomiarowy.
Typowy zakres temperatur zmienia się między innymi w zależności od hodowanego organizmu:
| Organizm | Zakres temperatur | ||||
| Bakterie, Drożdże, Grzyby | +20 °C do +60 °C | ||||
| Mammalian, Owady lub komórki roślinne | +25 °C do +37 °C | ||||
Jeśli pracujesz w temperaturach bliskich lub niższych od temperatury pokojowej, będziesz potrzebował aktywnego systemu chłodzenia, takiego jak agregat chłodniczy z recyrkulacją. Dla większości bioprocesów temperatura powinna pozostawać stała podczas całej hodowli. Jednak w przypadku niektórych produktów, takich jak penicylina lub białka rekombinowane (tj. białka bioinżynierowane przy użyciu organizmów modyfikowanych genetycznie), zmiana temperatury pod koniec fazy wzrostu aktywuje geny ważne dla tworzenia produktu i dlatego jest korzystna. W przypadku metod produkcji obejmujących kultury komórkowe, temperatura jest czasami obniżana również na końcu bioprocesu (technika znana w biotechnologii jako „zmiana temperatury”), tak aby gotowy produkt pozostał stabilny do późniejszego wykorzystania.
Istnieje kilka sposobów wykorzystania obwodu grzewczego i/lub chłodzącego do regulacji temperatury:
-
-
- Elektryczny blok grzewczy z wbudowaną spiralą chłodzącą
- Silikonowa podkładka grzewcza owinięta wokół naczynia hodowlanego po sterylizacji
- Podwójny płaszcz, w którym krąży woda. Temperatura jest regulowana za pomocą grzałki elektrycznej lub pary i zaworu elektromagnetycznego do poboru wody chłodzącej
-
Pomiar i kontrola pH
Pomiar i kontrola pH jest bardzo ważnym aspektem bioprocesów, ponieważ zmiany pH mogą znacząco zmienić warunki wzrostu – zazwyczaj z poważnymi konsekwencjami. Podłoża hodowlane powszechnie zawierają bufory, tj. substancje, które łagodzą zbyt nagłe zmiany pH spowodowane dodaniem kwasu lub zasady. Ponieważ kwas kapiący do podłoża hodowlanego może uszkodzić wiele linii komórkowych, naukowcy często starannie wzbogacają mieszaninę gazów używaną w hodowli komórkowej o CO2, zamiast dodawać płynny kwas. Gaz rozpuszcza się wtedy w podłożu hodowlanym, pozwalając dwutlenkowi węgla wpływać na pH w połączeniu z buforem.
Typowe zakresy pH w zależności od hodowanego organizmu:
| Organizm | pH | ||||
| Bakterie, Drożdże, Grzyby | 4.5 – 7.0 | ||||
| Komórki ssaków | 6.7 – 7.4 | ||||
| Komórki owadów | 6.2 – 6.9 | ||||
| Komórki roślin | 5.5 | ||||
Do pomiaru pH podczas bioprocesu, każdy bioreaktor jest wyposażony w czujnik pH znany jako elektroda kombinowana do pH. Bioreaktor może korygować wszelkie odchylenia pH; w tym celu udostępnia się roztwór kwasu i/lub zasady, który jest podłączony do naczynia hodowlanego za pomocą rurek i pomp. Stężenie kwasu i zasady musi być umiejętnie dobrane – jeśli jest zbyt wysokie, krople skoncentrowanego kwasu lub zasady mogą uszkodzić mikroorganizmy i kultury komórkowe, zanim zostaną rozprowadzone w bioreaktorze. Jeżeli, z drugiej strony, stężenie jest zbyt niskie, operatorzy będą musieli dodawać więcej kwasu lub zasady, niepotrzebnie rozcieńczając pożywkę.
Dodawanie składników odżywczych
Podczas bioprocesu, mikroorganizmy zwykle zużywają szeroki zakres składników odżywczych. Podstawowy skład pożywki składa się zwykle z wody, źródła energii użytecznej dla organizmu (np. glukozy), jak również potrzebnych mu składników odżywczych (węgla, azotu i fosforu), soli i pierwiastków śladowych. W zależności od organizmu niezbędne są inne związki, które nie mogą być syntetyzowane samodzielnie (witaminy, niezbędne aminokwasy itp.).
W zależności od strategii bioprocesu te składniki odżywcze są albo wszystkie udostępniane na początku bioprocesu (bioproces wsadowy), albo dodawane w czasie, np. w procesie wsadowym lub ciągłym.
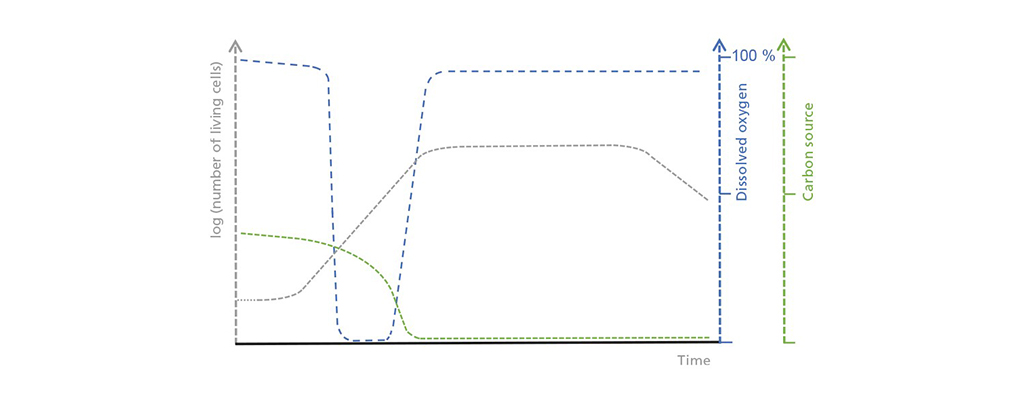
Schematyczna ilustracja korelacji pomiędzy stężeniem żywych komórek, rozpuszczonym tlenem i ograniczającym źródłem węgla w procesie wsadowym. W początkowej fazie lag, liczba żywych komórek wzrasta tylko powoli, co prowadzi do umiarkowanego, ale stałego poboru źródła węgla. Zużycie tlenu wzrasta podczas fazy wzrostu wykładniczego, aż do momentu, gdy przekroczy możliwy dopływ tlenu. Gdy źródło węgla zostanie wyczerpane, rozpoczyna się faza stacjonarna, po której następuje faza śmierci, podczas której liczba żywych komórek drastycznie spada.
Jeśli chcesz dowiedzieć się więcej o różnych strategiach karmienia zajrzyj na nasz blog-post: The Difference Between Batch, Fed-batch and Continuous Processes.
Gassing
Podczas bioprocesu, bioreaktor podaje do medium hodowlanego sterylną mieszaninę gazów, taką jak powietrze. Ciągłe mieszanie nie tylko rozprowadza składniki odżywcze – zmniejsza również rozmiar pęcherzyków gazu powstających w naczyniu hodowlanym, dzięki czemu skutecznie uwalnia tlen do roztworu odżywczego. Jest to ważne, ponieważ mikroorganizmy i kultury komórkowe mogą absorbować tylko ten tlen, który został rozpuszczony w pożywce.
Zapotrzebowanie na tlen jest różne: bakterie tlenowe potrzebują tlenu, podczas gdy inne preferują mieszanki gazowe, takie jak gaz syntezowy („syngaz”). Organizmy beztlenowe mogą jednak całkowicie zrezygnować z gazowania, żywiąc się jedynie nieorganicznymi i organicznymi substancjami z podłoża hodowlanego, takimi jak azotan lub fumaran.
W przeciwieństwie do mikroorganizmów, hodowle komórkowe są gazowane nie tylko powietrzem – zawartość tlenu w mieszaninie gazowej może być również kształtowana przy użyciu czystego azotu i czystego tlenu. Dokładny skład zależy od zastosowania hodowli komórkowej. Aby utrzymać atmosferę gazową na stałym poziomie, bioreaktor wymaga precyzyjnych systemów sterowania.
Na początku bioprocesu hodowla potrzebuje na przykład często mniej tlenu – a tym samym mniejszej ilości gazu – ponieważ wzrost postępuje jeszcze powoli. Później jednak, szybszy wzrost wymaga znacznie więcej tlenu. Oprócz zapewnienia stałego dopływu pożądanego gazu lub mieszaniny gazów, bioreaktor dostarcza również właściwą ilość gazu we właściwym czasie. W tym celu bioreaktor posiada porty gazowe podłączone do sprężonego powietrza z budynku, kompresora lub butli gazowej.
Szybkość gazowania jest zwykle mierzona w litrach na minutę. W celu uzyskania ogólnego parametru mającego zastosowanie do różnych bioreaktorów, szybkość ta jest również często określana jako specyficzna szybkość gazowania, która odnosi się do wielokrotności objętości roboczej (objętości zbiornika na minutę, vvm) i jest wyrażana w min-1. Typowa wartość dla bioprocesów mikrobiologicznych wynosi od 1 do 1,5-krotności objętości roboczej na minutę. W przypadku bioreaktora o objętości roboczej 4 L maksymalna szybkość gazowania wynosiłaby zatem 4 L * 2 L L-1 min-1 = 8 L min-1. W hodowlach komórkowych, dla kontrastu, maksymalna szybkość wynosi często 10% do 15% objętości roboczej na minutę, jako sposób utrzymania małych pęcherzyków gazu, a tym samym zapobiegania tworzeniu się piany i uszkodzeniu komórek przez pękające pęcherzyki.
Zmiana szybkości gazu, jednakże, nie jest jedynym sposobem kontrolowania wydajności, z jaką bioreaktor dostarcza tlen i inne gazy do medium hodowlanego. Im większa powierzchnia całkowitej liczby wszystkich pęcherzyków gazu w bioreaktorze – tzn. im bardziej drobno rozmieszczone są same pęcherzyki gazu – tym skuteczniej tlen będzie przenoszony z gazu do fazy ciekłej. Oznacza to na przykład, że zwiększenie prędkości mieszania może poprawić natlenianie mikroorganizmów, ponieważ mieszadło sprawia, że pęcherzyki gazu stają się jeszcze mniejsze, a tym samym zwiększa się całkowita powierzchnia wszystkich pęcherzyków gazu w bioreaktorze.
Precyzyjna regulacja pO2 – a tym samym precyzyjna kontrola szybkości gazowania i składu gazu – jest bardzo ważna, ponieważ w normalnych warunkach pO2 nie powinno być czynnikiem hamującym wzrost hodowli. Jeśli jednak nie jest wystarczająco kontrolowane, pO2 staje się czynnikiem ograniczającym.
Ponieważ gaz doprowadzany do bioreaktora jest zwykle suchy, wilgoć z bioreaktora może być gromadzona w strumieniu wylotowym podczas gazowania. Przy dużej szybkości gazowania, nie tylko spadłby poziom napełnienia, ale wilgoć zablokowałaby również filtr wylotowy, uniemożliwiając prawidłowe odpowietrzenie i pozwalając na wzrost ciśnienia. Aby uniknąć tego efektu, bioreaktory są wyposażone w wydajną chłodnicę wydechową, w której wilgoć zawarta w wydechu skrapla się i może ściekać z powrotem do bioreaktora, zanim dotrze do filtra wydechowego.
Pomiar i kontrola ciśnienia
Im wyższe ciśnienie w naczyniu, tym więcej tlenu jest rozpuszczane. Naczynia hodowlane wykonane ze szkła są często dopuszczone tylko dla ciśnienia do 0,5 bar, co nie jest nawet połową ciśnienia średnio napełnionej opony rowerowej. Przy wyższym ciśnieniu roboczym lekko uszkodzone szklane naczynia hodowlane mogą pęknąć, co stanowi zagrożenie dla bezpieczeństwa. Dlatego należy zawsze dbać o swobodny, bezciśnieniowy odpływ z bioreaktora, utrzymując filtr odpływowy w stanie suchym i regularnie go wymieniając – w ten sposób zapewnia się oczywiście również integralność naczynia hodowlanego. W przeciwieństwie do szklanych naczyń hodowlanych, bioreaktory ze stali nierdzewnej są przystosowane do wyższych ciśnień i nawet w standardowej konfiguracji mogą pracować pod ciśnieniem do 2 barów (dobrze wypełniona opona rowerowa). Ponadto, systemy tego typu są często wyposażone w mechanizm kontroli ciśnienia oparty na czujniku ciśnienia w bioreaktorze i zaworze proporcjonalnym w przewodzie wylotowym. Mogą one nie tylko mierzyć ciśnienie w bioreaktorze – mogą je również aktywnie kontrolować.

Zapobieganie powstawaniu piany
Poza wannami i szklankami z piwem, piana jest raczej niepopularnym efektem ubocznym, zwłaszcza w bioreaktorach. Piana tworzy się na granicy fazy ciekłej i gazowej w naczyniu hodowlanym i może szybko znaleźć się pod górną płytą. W najgorszym przypadku może ona zablokować filtr wylotowy, co z kolei blokuje przepływ gazu. Dlatego większość bioreaktorów jest wyposażona w system przeciwdziałania tworzeniu się piany. Mechaniczne urządzenia do rozbijania piany w przestrzeni roboczej są zarezerwowane dla raczej dużych bioreaktorów ze stali nierdzewnej, podczas gdy systemy kontroli przeciwpianowej oparte na środkach chemicznych (takich jak PPG, Struktol lub defoamery na bazie krzemu) można znaleźć w mniejszych bioreaktorach.
Typowy system kontroli przeciwpianowej składa się z czujnika zainstalowanego na określonej wysokości w naczyniu hodowlanym. Jeśli wysokość piany osiągnie czujnik, środek przeciwpieniący jest pompowany ze zbiornika do naczynia hodowlanego. Te środki przeciwpieniące są aktywne na granicy faz ciecz-gaz i zwiększają tendencję pęcherzyków piany do zapadania się. W szczególnie uporczywych przypadkach, gdy piana nie rozpuszcza się natychmiast, należy powtórzyć procedurę po upływie zadanego czasu (strategia „opóźnienia strzału &”). Zaleca się ostrożność przy stosowaniu środków przeciwpieniących – jeśli dozuje się ich nawet nieco więcej niż jest to konieczne, mogą one leżeć jak druga skóra na powierzchni cieczy, co utrudnia wymianę gazową. Środki przeciwpieniące przeciwdziałają również efektywnemu transferowi tlenu, ponieważ zmiana napięcia powierzchniowego sprzyja zapadaniu się pęcherzyków gazu w bioreaktorze, zmniejszając tym samym powierzchnię dostępną dla wymiany gazowej. Wybór odpowiedniego środka zależy również od danego bioprocesu, ponieważ bakterie i komórki różnie reagują na niektóre substancje chemiczne.
Bonus: Korzyści z zastosowania oprogramowania SCADA
W dzisiejszych czasach wyniki generowane w bioreaktorze powinny być gromadzone i oceniane w sposób jak najbardziej scentralizowany, ponieważ jest to jedyny sposób na efektywne wdrożenie nowoczesnych algorytmów big data w celu wygenerowania większej ilości informacji i lepszego zrozumienia działania procesu. To jest właśnie zadanie dla oprogramowania SCADA. W pierwszym kroku wszystkie dane z bioreaktora mogą być odczytywane – bez większego udziału użytkownika – i przechowywane centralnie, aby móc je oceniać samodzielnie lub porównywać z innymi danymi wsadowymi. W ten sposób szybko powstają pomysły na nowe eksperymenty, a nawet złożone strategie wsadowe. Profesjonalne oprogramowanie SCADA pozwala je łatwo zaplanować, a następnie sterować bioreaktorem, który w idealnym przypadku będzie w pełni zautomatyzowanym procesem. Poza tym oprogramowanie SCADA integruje kilka komponentów w środowisku bioreaktora. Należą do nich narzędzia do optymalizacji procesu z wykorzystaniem techniki Design-of-Experiment (DoE) lub wydajne czujniki programowe, które mogą być jednocześnie wykorzystywane do obliczania dodatkowych informacji bezpośrednio z parametrów procesu wsadowego, a nawet do regulacji tych parametrów. Na przykład, iloraz oddechowy (RQ) może być użyty do uzyskania szacunkowej oceny aktywności metabolicznej poprzez stosunek wydalonego dwutlenku węgla do zaabsorbowanego tlenu.
Możliwości jest tak wiele – zwłaszcza, gdy bioreaktor i oprogramowanie SCADA są doskonale dopasowane – że nie jesteśmy w stanie opisać ich wszystkich. Jeśli są Państwo zainteresowani poznaniem wszystkiego, co nowoczesne oprogramowanie SCADA ma do zaoferowania, proszę zapoznać się z oprogramowaniem eve® bioprocess platform

.