Introduction
Charophytes lub bazalne Streptophytes; (Becker i Marin, 2009; Leliaert i in., 2012) stanowią zróżnicowany taksonomicznie asortyment występujących słodkowodnych i lądowych glonów zielonych, które wykazują szeroki wachlarz form jednokomórkowych, nitkowatych i „parenchymatycznych” (Graham, 1993; Lewis i McCourt, 2004). Przodkowie charofitów pojawili się na lądzie i skolonizowali go 450-500 milionów lat temu. Organizmy te przystosowały się do warunków lądowych, stały się zdolne do przeżycia i rozmnażania przy pełnej ekspozycji na atmosferę, a niektóre ich przedstawiciele ostatecznie wyewoluowały w rośliny lądowe (Zhong i in., 2013; Delwiche i Cooper, 2015). Ta „terrestializacja” roślin zielonych stanowiła kluczowe wydarzenie biologiczne, które na zawsze zmieniło biogeochemię i historię naturalną naszej planety. Późniejsze rozprzestrzenianie się roślin lądowych zmieniło warunki atmosferyczne i jeszcze bardziej zmieniło warunki glebowe oraz umożliwiło pojawienie się na lądzie innych różnorodnych form życia. Ewolucja roślin lądowych również zmieniła historię ludzkości, najbardziej znacząco poprzez innowację rolnictwa i konsekwentne tworzenie nowoczesnej cywilizacji ludzkiej. Częściowo z powodu ich ewolucyjnego znaczenia, charofity były przedmiotem szczególnej uwagi biologów roślin w ciągu ostatnich dziesięcioleci (Pickett-Heaps i Marchant, 1972; Pickett-Heaps, 1975; Mattox i Stewart, 1984; Becker i Marin, 2009; Harholt i in., 2016). Jednak w miarę gromadzenia dodatkowych nowych danych dotyczących biologii tych glonów, stały się one ważnymi modelami do zrozumienia podstawowych zjawisk w biochemii, biologii komórki, biologii rozwoju, ekologii i coraz częściej biologii molekularnej (Delwiche i Cooper, 2015; Lemieux i in., 2016). Seria Frontiers in Plant Science poświęcona „Charophytes” ilustruje znaczenie tych organizmów w kilku specyficznych obszarach badań biologii roślin. Ten mini-przegląd podkreśla atrybuty charofitów jako organizmów modelowych w różnych obszarach badań. Mam nadzieję, że będzie on również zachętą dla nowej generacji naukowców do rozszerzenia wykorzystania tych glonów w badaniach podstawowych oraz do rozpoczęcia badań przesiewowych innych taksonów, które z kolei mogą prowadzić do identyfikacji i wykorzystania nowych modelowych charofitów.
The „Line-Up” of Charophytes
W latach 70-tych i 80-tych XX wieku, badania ultrastrukturalne (np, mechanizm podziału komórki, budowa aparatu flagowego) i dane biochemiczne (np. profile enzymatyczne) były głównymi kryteriami zaliczenia zielonej algi do linii charofitów (Mattox i Stewart, 1984; Lewis i McCourt, 2004; Leliaert i in., 2012). Od lat 90. XX wieku do dziś, badania skoncentrowane na molekularnych analizach genomów chloroplastowych i jądrowych oraz transkryptomów potwierdziły i udoskonaliły wcześniejsze schematy taksonomiczne i filogenetyczne (Timme i in., 2012; Delwiche i Cooper, 2015). Zostało to dodatkowo uzupełnione szczegółowymi analizami biochemicznymi, immunologicznymi i opartymi na biologii komórki, dotyczącymi ścian komórkowych charofitów oraz szlaków biosyntezy i sygnalizacji hormonów (Popper i Fry, 2003; Popper, 2008; Sørensen i in., 2010, 2011, 2012; Zhang i van Duijn, 2014; Ju i in., 2015; O’Rourke i in., 2015). Istniejące charofity wykazują stosunkowo niski procent różnorodności w porównaniu z innymi taksonami zielenic i obejmują 13 rodzin i 122 rodzaje (Becker i Marin, 2009; Leliaert i in., 2012). Aktualna opinia filogenetyczna umieszcza charofity w sześciu klasach (Rysunek 1; Delwiche i Cooper, 2015). Klasa bazalna, Mesostigmatophyceae, reprezentowana jest przez jeden znany rodzaj, Mesostigma. Alga ta jest jednokomórkowym biflagellatem o unikalnym asymetrycznym kształcie (tj. jak spłaszczona szalupa ratunkowa) i jest pokryta warstwami ozdobnie zaprojektowanych łusek (Manton i Ettl, 1965; Becker i in., 1991; Domozych i in., 1991, 1992). Druga klasa, Chlorokybophyceae, również składa się z jednego znanego rodzaju, Chlorokybus atmophyticus. Ta rzadka alga tworzy sarkoidalny pakiet komórek otoczonych grubą, żelopodobną powłoką (Rogers i in., 1980). Należy zauważyć, że alternatywne filogenezy umieszczają Mesostigma i Chlorokybus jako linie siostrzane, które razem są siostrzane do wszystkich innych Streptophytes (Rodríguez-Ezpeleta i in., 2007). W filogenezie sześciu klas, trzecia klasa, Klebsormidiophyceae, składa się z trzech rodzajów, które tworzą proste, nierozgałęzione włókna (Sluiman i in., 2008), często będące członkami „biologicznych skorup” porastających powierzchnie różnych siedlisk lądowych. Kilka gatunków z tej klasy może nawet wytrzymać znaczny stres suszy, gdy są częścią skorupy pustynnej (Mikhailyuk i in., 2008, 2014; Holzinger i Karsten, 2013); inne są tolerancyjne na stres suszy związany ze środowiskami niskotemperaturowymi (Stamenkovic i in., 2014; Herburger i Holzinger, 2015). Te trzy pierwsze klasy stanowią „wczesną dywergencję” charofitów. Linia „późno rozbieżna” również obejmuje trzy klasy. Charophyceae, lub stoneworts, są powszechnie spotykane w ekosystemach słodkowodnych i posiadają makroskopowe wielokomórkowe talie składające się z agregacji rozgałęzionych włókien zbudowanych z wyjątkowo wydłużonych komórek (Lewis i McCourt, 2004). Członkowie tej grupy wykazują reprodukcję płciową opartą na oogamii, która obejmuje ruchliwe plemniki i niemotylne jaja produkowane w wielokomórkowych gametangiach. Do Coleochaetophyceae należą taksony, które mają wielokomórkowe plechy zbudowane z rozgałęzionych, nitkowatych lub parenchymatycznych plech (Graham, 1993; Delwiche i in., 2002). Organizmy te wykazują również odrębne rozmnażanie płciowe oparte na oogamii. Coleochaetophyceae są zwykle spotykane na styku siedlisk słodkowodnych i lądowych, często jako epifity. Wreszcie, największa i najbardziej zróżnicowana grupa charofitów, Zygnematophyceae, składa się z jednokomórkowców i nierozgałęzionych włókien (Gontcharov et al., 2003; Guiry, 2013). Cechą wyróżniającą tę grupę jest obecność rozmnażania płciowego opartego na koniugacji, które wymaga złożonej sygnalizacji komórkowo-komórkowej i adhezji (Abe i in., 2016). Glony zygnematofitowe są powszechnymi mieszkańcami siedlisk słodkowodnych, występując niekiedy w spektakularnych efemerycznych zakwitach, a także w wilgotnych podłożach lądowych.

Rysunek 1. Charophytes Extant. Ekstantne Charophytes dzielą się na taksony o wczesnej i późnej dywergencji. Wczesne taksony obejmują Mesostigmatophyceae, Chlorokybophyceae i Klebsormidiophyceae, a późne taksony obejmują Charophyceae, Coleochaetophyceae i Zygnematophyceae. Przedstawicielami każdej z grup są Mesostigma (Mesostigmatophyceae), Chlorokybus atmophyticus (Chlorokybophyceae), Klebsormidium flaccidum (Klebsormidiophyceae), Chara (Charophyceae), Coleochaete scutata (Coleochaetophyceae) i Micrasterias (Zygnematophyceae).
Charophytes as Model Organisms
Several charophytes have been used extensively as model organisms in the study of basic biological processes. Ich małe i proste plechy (np. w porównaniu z roślinami lądowymi) oraz łatwość w eksperymentalnej manipulacji to tylko dwie z cech, które czynią je atrakcyjnymi organizmami modelowymi. Ostatnie dowody wykazały również, że wiele charofitów ma kilka cech niezwykle podobnych do roślin lądowych, w tym obecność szlaków biosyntezy dla wielu regulatorów wzrostu (Rysunek 2; Boot i in., 2012; Hori i in., 2014; Wang i in., 2014, 2015; Holzinger i Becker, 2015; Ju i in., 2015) i wielu polimerów ściany komórkowej (Popper, 2008; Sørensen i in., 2010, 2011, 2012; Mikkelsen i in., 2014). Te dwie cechy sprawiły, że charofity są skuteczne w takich obszarach badań jak rozwój molekularny roślin i fizjologia stresu. Podczas gdy wiele charofitów zostało wykorzystanych w szerokim wachlarzu badań biologicznych, następujące taksony są najbardziej godne uwagi ze względu na ich szerokie zastosowanie w wielu dziedzinach badań jako modele:
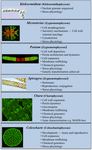
FIGURE 2. Aktualny model Charophytes. Kilka Charophytes, w tym Klebsormidium, Micrasterias, Penium, Spirogyra, Chara i Coleochaete są używane jako modele; każdy z nich ma specyficzne atrybuty, które czynią go szczególnie odpowiednim modelem dla określonych procesów fizjologicznych i biochemicznych.
Desmidy: Modele symetryczne
Wykazano ostatnio, że Zygnematophyceae są najprawdopodobniej najbliższymi żyjącymi przodkami roślin lądowych (Wodniok i in., 2011; Delwiche i Cooper, 2015). Jednokomórkowi członkowie inkluzywnej grupy placoderm desmidów stali się ważnymi modelami dla wyjaśnienia wielu fundamentalnych zasad biologii i rozwoju komórki roślinnej. Duży rozmiar komórek, godna uwagi symetria/kształt, wyraźna architektura ścian komórkowych i rozbudowane systemy endomembranowe/cytoszkieletowe to tylko kilka cech, które czynią z nich doskonałe systemy komórkowe do badania fizjologii i rozwoju komórek. Niedawne stworzenie stabilnych linii transformowanych i wkrótce sekwencjonowanie genomów/transkryptomów wybranych desmidów jeszcze bardziej zwiększyło ich wartość w badaniach botanicznych. Dwa taksony, Micrasterias i Penium, wyłoniły się jako najlepiej zbadane spośród desmidów.
Micrasterias był najbardziej popularnym desidem do badań biologii komórki przez ostatnie 50 lat ze względu na swoje unikalne cechy (Meindl, 1993; Lutz-Meindl, 2016). Komórka Micrasterias wykazuje bilateralną symetrię, która często jest podkreślana przez spektakularnie rozczłonkowany (tj. wieloboczny) peryferia. Nowe semikomórki córkowate powstałe w wyniku podziału komórki nie mają tej złożonej morfologii, lecz raczej mają kształt kulisty. Złożony post-cytokinetyczny program rozwojowy, który wykorzystuje wiele zestawów wysoce skoordynowanych mechanizmów subkomórkowych, generuje fenotyp wielopłatowy podczas ekspansji komórek potomnych. Program ten jest również odpowiedzialny za odkładanie polimerów do produkcji zarówno pierwotnej, jak i wtórnej ściany komórkowej. Wydarzenia te koncentruj± się w dużej sieci ciałek Golgiego i zwi±zanych z nimi pęcherzyków, które wytwarzaj± złożony mechanizm wydzielniczy. Proces ten jest z kolei ukierunkowany na specyficzne miejsca na powierzchni komórki, które generują wielobiegunową ekspansję komórki i jednoczesne wydzielanie makrocząsteczek ściany komórkowej oraz śluzu pozakomórkowego (Kim i in., 1996; Lutz-Meindl i Brosch-Salomon, 2000; Oertel i in., 2004; Aichinger i Lutz-Meindl, 2005). Dostarczanie składników sekrecyjnych do precyzyjnych miejsc na powierzchni komórek wymaga rozbudowanego systemu cytomotylowego opartego na aktynomiozynie i jest kontrolowane przez kilka kaskad transdukcji sygnału (Meindl i in., 1994; Oertel i in., 2003). Ponadto morfogeneza komórek jest bardzo wrażliwa na stresy zewnętrzne (np. stres oksydacyjny, zasolenie, metale ciężkie), które prowadzą do istotnych zmian w różnicowaniu się komórek (Darehshouri i in., 2008; Affenzeller i in., 2009; Andosch i in., 2012). Micrasterias jest doskonałym organizmem do analizy tych cech subkomórkowych, ponieważ jest łatwa w utrzymaniu i manipulacji w laboratorium i szczególnie dobrze nadaje się do pozyskiwania obrazów o wysokiej rozdzielczości przy użyciu mikroskopii świetlnej i elektronowej, w tym immunocytochemii, skaningowej mikroskopii elektronowej ze skupioną wiązką jonów (FIB-SEM) i obrazowania w spektroskopii strat energii elektronów (EELS) (Lutz-Meindl, 2007; Eder i Lutz-Meindl, 2008, 2010; Wanner et al., 2013; Lutz-Meindl et al., 2015). Ponadto, wstępne analizy molekularne, w tym produkcja transformowanych linii komórkowych, jeszcze bardziej rozszerzyły zastosowanie Micrasterias, zwłaszcza w molekularnej dynamice przetwarzania ściany komórkowej (Vannerum i in., 2010, 2011, 2012).
W ciągu ostatniej dekady desmid, Penium margaritaceum, również stał się cennym organizmem modelowym (Domozych i in., 2009, 2014; Sørensen i in., 2014; Rydahl i in., 2015; Worden i in., 2015). W przeciwieństwie do Micrasterias, Penium ma prosty cylindryczny kształt, posiada tylko pierwotną ścianę komórkową i podczas ekspansji odkłada polimery ścienne w dwóch specyficznych miejscach na powierzchni komórki (Domozych i in., 2011). Ta względna prostota jest bardzo atrakcyjna dla wyjaśnienia podstawowych zasad rozwoju komórek roślinnych, w tym rozwoju ściany komórkowej, ekspansji komórek i dynamiki wydzielania (Domozych i in., 2005, 2014; Ochs i in., 2014). Jedną z jego głównych cech jest to, że posiada polimery ściany podobne do tych obecnych w wielu roślinach lądowych (np. celuloza, pektyny, hemicelulozy) i że te polimery mogą być znakowane przeciwciałami monoklonalnymi. Po oznakowaniu żywych komórek, mogą one zostać zwrócone do hodowli, gdzie kolejne ekspansje komórek i wydarzenia związane z osadzaniem ścian mogą być monitorowane (Domozych i in., 2009; Rydahl i in., 2015). Penium jest również łatwe do utrzymania w laboratorium, a jego szybki wzrost w precyzyjnie kontrolowanych warunkach sprawia, że jest to doskonała próbka do równoległych badań mikromacierzowych na dużą skalę wielu czynników chemicznych (poprzez wzrost w płytkach wielodołkowych) oraz do oceny ich specyficznego wpływu na ekspansję/rozwój ściany (Worden et al., 2015). To znacząco pomaga w ujawnieniu roli specyficznych komponentów subkomórkowych i procesów w ekspansji/różnicowaniu. Ostatnio wyizolowanie stabilnych linii transformowanych (Sørensen i in., 2014) jeszcze bardziej wzmocniło potencjał tej algi w przyszłych badaniach nad komórkami roślinnymi.
Chara i Nitella: Cellular Giants for Plant Physiology
Gatunki Chara i Nitella (Charophyceae) od dawna były wykorzystywane jako okazy do różnych badań biologicznych, szczególnie tych dotyczących dynamiki komórkowej, ekspansji i strumieniowania cytoplazmatycznego (Green, 1954; Probine i Preston, 1962). Ich makroskopowe talie wyróżniają się węzłami, gdzie powstają rozgałęzienia i gametangia, oraz regionami międzywęźli, które składają się z wyjątkowo wydłużonych komórek. Komórki międzywęźli wykazują wyraźnie zauważalną stratyfikację składników subkomórkowych, przy czym spiralnie zorientowane chloroplasty definiują stacjonarną korę, która otacza endoplazmę, gdzie zachodzi najszybsze rejestrowane strumieniowanie cytoplazmatyczne generowane przez aktynomiozynę. Cytoplazma zawiera różnorodne elementy endomembranowe, które uczestniczą w dynamicznych sieciach trakcji błonowych (np. endocytoza i egzocytoza), kontrolowanych przez złożone kaskady transdukcji sygnałów (Foissner i Wastenys, 2000, 2012, 2014; Sommer i in., 2015; Foissner i in., 2016). Komórki międzywęźli posiadają ściany komórkowe bogate w celulozę i pektynę, homogalakturonan (HG). Turgor jest główną siłą napędową ekspansji, a pektyny są najprawdopodobniej składnikiem nośnym kontrolującym ekspansję ściany. Cykliczna, nieenzymatyczna modulacja i jednoczesne kompleksowanie wapnia z HG jest mechanizmem odpowiedzialnym za kontrolowanie modulacji ściany, które prowadzą do ekspansji komórek (Proseus i Boyer, 2007, 2008, 2012; Boyer, 2016). Jedną z technicznych zalet Chara i Nitella w badaniach komórkowych jest możliwość indywidualnego usuwania komórek międzywęzłowych; endoplazma i ściany komórkowe mogą być „wypreparowane”, a następnie użyte jako acellularne systemy do manipulacji eksperymentalnych.
Inne komponenty grasicy, takie jak kłącza, mają zorganizowaną polarną organizację cytoplazmy. Komórki te zawierają osadzające się, bogate w minerały statolity zlokalizowane w wierzchołku, które funkcjonują w percepcji grawitacji (Hodick i in., 1998; Braun, 2002; Braun i Limbach, 2006). Ta cecha sprawiła, że Chara jest pierwszym charofitem w kosmosie. Podczas parabolicznych lotów rakiety TEXUS wykazano, że statolity wywierają siły rozciągające na filamenty aktynowe. Równowaga sił (tj. grawitacja i przeciwdziałająca jej siła filamentów aktynowych) odpowiada za prawidłowe ułożenie statolitów w rizoidzie, co z kolei gwarantuje zdolność do reagowania na wektor grawitacji (Braun i Limbach, 2006). Zastosowanie pincety laserowej i mikroskopii w wirówce wolnoobrotowej wykazało, że sedymentacja statolitów nie jest wystarczająca do spowodowania grawitropowego wygięcia wierzchołka rizoidu. Bogate w minerały statolity muszą raczej osadzać się na specyficznych obszarach błony plazmatycznej, aby grawitropowe efekty morfologiczne mogły zachodzić (Braun, 2002). Chara została również wykorzystana do badania innych zjawisk, w tym elektrofizjologii oraz roli i ruchu hormonów (Belby, 2016).
Coleochaete for Developmental Studies and Pattern Development
Utworzenie wielokomórkowego thallusa (tj. tkanki, organu) rośliny wymaga precyzyjnych, przestrzennie regulowanych płaszczyzn podziału komórek, które są kontrolowane przez wiele zestawów genów wyrażanych w określonych punktach podczas rozwoju (Besson i Dumais, 2011; Umen, 2014). Ukierunkowana zarówno w przestrzeni trójwymiarowej, jak i w czasie, morfogeneza thallusa moduluje się również w odpowiedzi na zewnętrzne czynniki stresowe. U roślin, te programy rozwojowe są jeszcze bardziej złożone przez obecność ścian komórkowych, które nie pozwalają na migrację komórek lub elastyczność tkanek. Wyjaśnienie specyficznych zdarzeń, które mają kluczowe znaczenie dla manifestacji kształtu i rozmiaru plechy jest często trudne do rozszyfrowania u roślin lądowych, gdzie rozdzielczość specyficznych zachowań komórek jest często słabo widoczna, gdy są one osadzone w wysoce złożonych i ekspansywnych tkankach/organach. Wykorzystanie organizmów o prostszych kształtach ścian było korzystne dla zrozumienia podstawowych zjawisk rozwojowych, a charofitowy rodzaj Coleochaete jest jednym z takich przykładów. Niektóre gatunki (np. C. orbicularis, C. scutatum) wytwarzają parenchymatyczną dyskoidalną plechę, która rozrasta się na zewnątrz dzięki kombinacji anty- lub peryklinalnych podziałów komórkowych i późniejszej ekspansji najbardziej zewnętrznych komórek (Brown et al., 1994; Cook, 2004). Płaszczyzna podziału każdej komórki podlega prostym regułom, które są oparte na rozmiarze komórki, jej kształcie i geograficznym położeniu w obrębie zgrubienia (Dupuy i in., 2010; Besson i Dumais, 2011). Ta cecha pozwala na konstruowanie modeli matematycznych, które mogą być następnie wykorzystane do interpretacji morfogenezy wielokomórkowej (Domozych i Domozych, 2014; Umen, 2014) i dostarczyć krytycznego wglądu w ewolucję, biomechanikę i fizjologię organów i całych organizmów. Ponadto, niektóre gatunki Coleochaete były intensywnie badane w celu określenia strukturalnych i funkcjonalnych modulacji, które zachodzą w ogonku w warunkach suszy (Graham i in., 2012), tj. kluczowych cech w zrozumieniu wczesnej ewolucji roślin lądowych i dynamiki wzrostu roślin podczas suszy.
Insights from Genomic and Gene Studies
Podobnie jak wiele innych technologii, narzędzia molekularne mają zdolność do przekazywania nowych informacji istotnych dla wielu obszarów badań, w tym fizjologii i rozwoju. Na przykład członkowie rodziny genów MADS-box zostali wyizolowani i scharakteryzowani z trzech gatunków charofitów, Chara globularis, Coleochaete scutata i Closterium peracerosum-strigosum-littorale (Tanabe i in., 2005). Wzorzec ekspresji genów MADS-box u charofitów sugeruje, że odgrywają one rolę w rozwoju haploidalnym i reprodukcji (Tanabe i in., 2005). Uważa się, że zostały one włączone do pokolenia diploidalnego, a ich rola w rozwoju uległa dalszemu zróżnicowaniu podczas ewolucji roślin lądowych (Tanabe i in., 2005). Do chwili obecnej Klebsormidium flaccidum jest jedynym charofitem, dla którego dostępny jest niemal kompletny genom jądrowy (Hori i in., 2014); chociaż genomy chloroplastowe i mitochondrialne zostały zsekwencjonowane dla przedstawicieli każdej z sześciu klas charofitów, a ESTs (expressed sequence tags) są dostępne dla niektórych charofitów (Delwiche, 2016). Genom Klebsormidium ujawnił już obecność genów dla syntezy kilku hormonów roślinnych i intermediatów sygnałowych, mechanizmów ochrony przed wysokim natężeniem światła (Hori i in., 2014), a także obecność czynników transkrypcyjnych WRKY grupy IIb, o których wcześniej sądzono, że po raz pierwszy pojawiły się u mchów (Rinerson i in., 2015). Kilka projektów sekwencjonowania genomów charofitów jest obecnie w toku (Delwiche, 2016) i umożliwi bardziej szczegółowe analizy porównawcze obejmujące większą liczbę charofitów i potencjalnie da nowy wgląd w ewolucyjne relacje między gatunkami i genami. Unikalna pozycja charofitów jako najwcześniej różnicującej się grupy Streptophytes czyni z nich szczególnie potężne narzędzie do badań ewolucyjno-rozwojowych, a pojawiające się technologie, takie jak niedawne osiągnięcie stabilnej transformacji u Penium (Sørensen i in., 2014) umożliwią zbadanie funkcji specyficznych genów.
Przyszłe zastosowania charofitów jako organizmów modelowych
Krytycznym kolejnym krokiem w badaniach nad charofitami jest analiza genomów wszystkich taksonów i badania porównawcze z genomami roślin lądowych. Praca ta nie tylko dostarczy kluczowego wglądu w mechanizmy adaptacyjne, które ewoluowały u charofitów podczas pojawiania się i skutecznego kolonizowania siedlisk lądowych, ale także udoskonali i rozszerzy zastosowanie obecnych organizmów modelowych w badaniach nad roślinami podstawowymi. Chociaż badania molekularne będą wspierać wiele obszarów badań, dwa obszary, które natychmiast skorzystają to biologia ściany komórkowej i dynamika regulatorów wzrostu we wzroście i rozwoju. W pierwszym z nich, charofity mogą dostarczyć wyjaśnień na temat wielu podstawowych, ale słabo rozwiązanych zjawisk, w tym biosyntezy pektyn i białek ściany komórkowej, kontrolowanego wydzielania, osadzania i postsekrecyjnych modulacji polimerów ściany oraz specyficznych, interaktywnych sieci szlaków błonowych w komórkach roślinnych. W tym ostatnim przypadku, modele charofitów pomogłyby rozszyfrować sygnalizację molekularną, biologię komórki i dynamikę wzrostu i rozwoju związaną z hormonami takimi jak etylen i auksyna. Ostatnie badania ekofizjologiczne z udziałem charofitów oferują również potencjalną skarbnicę danych krytycznych w określaniu, w jaki sposób komórki roślinne przystosowują się do stresu, w tym wysychania i tolerancji na sól (Holzinger i Karsten, 2013; Pichrtová et al., 2014; Herburger et al., 2015; Holzinger i Becker, 2015; Holzinger i Pichrtová, 2016; Kondo et al., 2016). Przyszłość badań nad charofitami jest rzeczywiście bardzo świetlana i w konsekwencji stanie się dobrodziejstwem dla całej biologii roślin.
Author Contributions
Wszyscy wymienieni autorzy, wnieśli istotny, bezpośredni i intelektualny wkład w powstanie pracy oraz zatwierdzili ją do publikacji.
Conflict of Interest Statement
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Acknowledgment
Ta praca była wspierana przez NSF (USA) MCB collaborative grants 1517345 i 1517546.
Belby, M. J. (2016). Multi-scale characean experimental system: from electrophysiology of membrane transporters to cell-to-cell connectivity, cytoplasmic streaming and auxin metabolism. Front. Plant Sci. 7:1052. doi: 10.3389/fpls.2016.01052
CrossRef Full Text | Google Scholar
Braun, M. (2002). Gravity perception requires statoliths settled on specific plasma membrane areas in characean rhizoids and protonemata. Protoplasma 219, 150-159. doi: 10.1007/s007090200016
CrossRef Full Text | Google Scholar
Braun, M., and Limbach, C. (2006). Rhizoids and protonemata of characean algae: model cells for research on polarized growth and plant gravity sensing. Protoplasma 229, 133-142. doi: 10.1007/s00709-006-0208-9
CrossRef Full Text | Google Scholar
Graham, L. E. (1993). Origin of Land Plants. New York, NY: John Wiley & Sons, 287.
Google Scholar
Herburger, K., and Holzinger, A. (2015). Localization and quantification of callose in the Streptophyte green algae Zygnema and Klebsormidium: correlation with desiccation tolerance. Plant Cell Physiol. 56, 2259-2270. doi: 10.1093/pcp/pcv139
CrossRef Full Text | Google Scholar
Lemieux, C., Otis, C., and Turmel, M. (2016). Comparative chloroplast genome analyses of streptophyte green algae reveal major structural alterations in the Klebsormidiophyceae, Coleochaetophyceae and Zygnematophyceae. Front. Plant Sci. 7:697. doi: 10.3389/fpls.2016.00697
CrossRef Full Text | Google Scholar
Lutz-Meindl, U. (2007). Zastosowanie transmisyjnej mikroskopii elektronowej z filtrowaniem energii do generowania obrazów i analizy elementów w organizmach roślinnych. Micron 38, 181-196. doi: 10.1016/j.micron.2006.03.017
CrossRef Full Text | Google Scholar
Meindl, U. (1993). Komórki Micrasterias jako system modelowy do badań nad morfogenezą. Microbiol. Rev. 57, 415-433.
Google Scholar
Pichrtová, M., Kulichova, J., and Holzinger, A. (2014). Nitrogen limitation and slow drying induce desiccation tolerance in conjugating green algae (Zygnematophyceae, Streptophyta) from polar habitats. PLoS ONE 9:e113137. doi: 10.1371/journal.pone.0113137
CrossRef Full Text | Google Scholar
Pickett-Heaps, J. D., and Marchant, H. J. (1972). The phylogeny of green algae: a new proposal. Cytobios 6, 255-264.
Google Scholar
Stamenkovic, M., Woelken, E., and Hanelt, D. (2014). Ultrastructure of Cosmarium strains (Zygnematophyceae, Streptiophyta) collected from various geographic locations shows species-specific differences both at optimal and stress temperatures. Protoplasma 251, 1491-1509.
Google Scholar
.