Introduction
Rosnąca odporność na insektycydy oraz wpływ na zdrowie ludzi i środowiska zachęciły do wykorzystania grzybów entomopatogenicznych (EPF) do biokontroli (Inglis et al., 2001). Środowiska tropikalne wspierają imponującą bioróżnorodność mikroorganizmów (Thompson i in., 2017), w tym wielu pasożytów stawonogów (Mahe i in., 2017). Jednak zdecydowanie najczęściej występujące komercyjnie EPF w tropikalnych i subtropikalnych agroekosystemach należą do dwóch rodzajów: Beauveria i Metarhizium (Ascomycota: Hypocreales) (Faria i Wraight, 2007; Li i in., 2010; Kumar i in., 2018; Mascarin i in., 2019). Tutaj dokonujemy przeglądu literatury skupionej na kontrolowaniu szkodników stawonogów za pomocą entomopatogenów, ze szczególnym uwzględnieniem tych dwóch rodzajów.
Metarhizium i Beauveria mają panglobalne dystrybucje ujawniające znaczne zróżnicowanie genetyczne, z szerokim zakresem żywicieli owadów i rozległymi niszami ekologicznymi (Driver i in., 2000; Rehner i Buckley, 2005; Zimmermann, 2007). Tak więc wiele aspektów wykorzystania EPF do zwalczania szkodników obejmuje gradienty równoleżnikowe, które omawiamy ogólnie. Warunki środowiskowe i skład gatunkowy mogą się jednak znacznie różnić między regionami tropikalnymi i umiarkowanymi, dlatego omawiamy te czynniki ze szczególnym uwzględnieniem badań tropikalnych i wykorzystujemy ogólną teorię wynikającą z systemów modelowych, aby wypełnić luki w obecnej literaturze i stymulować dalsze badania.
EPF są generalnie formułowane jako biopestycydy i stosowane w odpowiedzi na pojawienie się szkodników. Jednakże, jeśli siedlisko jest dobrze przystosowane do konkretnego szczepu grzyba do środowiska, może być możliwe, aby aplikacje grzybowe służyły jako inokulacyjne uwolnienia, gdzie EPF pozostają w glebie i zapobiegają ogniskom owadów. Tutaj opisujemy preferencje niszowe entomopatogenicznych grzybów, aby pomóc w wykorzystaniu EPF do zapobiegania epidemii szkodników. Skupiamy się na dwóch gatunkach Beauveria bassiana i Metarhizium anisopliae, ale każdy z nich najprawdopodobniej reprezentuje szerszy zakres gatunków i szczepów, które wcześniej były zgrupowane razem. Dlatego większość cytowanych prac dotyczących tych gatunków grzybów odnosi się do Beauveria bassiana i Metarhizium anisopliae sensu lato, ze względu na ostatnie rewizje taksonomiczne (np. Driver i in., 2000; Bidochka i in., 2001; Inglis i in., 2019).
Beauveria i Metarhizium
Entomopatogeniczne gatunki grzybów, B. bassiana i M. anisopliae kontrolują szeroki zakres szkodników (Kassa et al., 2004; Castrillo et al., 2010; Migiro et al., 2010; Singha et al., 2010; Skinner et al., 2012; Akmal et al., 2013; Wraight et al., 2016). Grzyby te mogą również zasiedlać powierzchnię liści różnych gatunków roślin i środowisk (Meyling i Eilenberg, 2006a; Garrido-Jurado i in., 2015), zasiedlać glebę jako saprofity (Evans, 1982) lub rosnąć endofitycznie (Greenfield i in., 2016). Najwyraźniej szerokie rozmieszczenie i różnorodność żywicieli patogenów atakowanych przez te grzyby, a także utrzymywanie się w środowisku, gdy żywiciele są rzadcy, sugerują potencjalną wartość w programach zintegrowanej ochrony roślin w różnych miejscach i warunkach (Lacey i in., 2015).
Trwałość i skuteczność rozmnażania grzybów na roślinach jest bezpośrednio uzależniona od temperatury, wilgotności, nasłonecznienia i aktywności drobnoustrojów na filoplanie (Jaronski, 2010). Duża część naszej wiedzy pochodzi z badań in vitro (Fargues i in., 1997; Luz i Fargues, 1997; Fargues i Luz, 2000; Devi i in., 2005; Shin i in., 2017). Nie jest jednak jasne, czy dane in vitro można ekstrapolować na warunki polowe (Keyser i in., 2017), ze względu na wpływ środowiska na procesy takie jak potencjał infekcyjny, trwałość konidiów oraz złożone interakcje abiotyczne i biotyczne, które rzadko są powielane w środowiskach laboratoryjnych (Inglis i in., 2001; Lacey et al., 2015).
Metarhizium i Beauveria łatwo kolonizują ryzosfery roślin, tworząc endofityczne asocjacje (Vega et al., 2009; Behie et al., 2015). Gatunki Beauveria wiążą się z wieloma tropikalnymi i subtropikalnymi gatunkami roślin, w tym z kakao (Posada i Vega, 2005), bananem (Akello i in., 2008) i kawą (Vega, 2008). Po kolonizacji endofitycznej Metarhizium robertsii może nawet przenosić do roślin azot pochodzący z owadów (Behie i in., 2012). Przynależność Beauveria i Metarhizium do roślin żywicielskich w rolnictwie oraz usługi ekosystemowe (tj. korzystna symbioza w roślinach i zwalczanie populacji szkodników owadzich) czynią z nich obiecujących kandydatów do zastosowania jako biopestycydy w rolnictwie tropikalnym. Wykorzystanie EPF jako biopestycydów w różnych agroekosystemach stwarza ekscytujące i zrównoważone możliwości zarządzania gospodarstwem, ale dogłębna znajomość endemicznych gatunków grzybów jest kluczowa dla określenia scenariuszy i środowisk, w których patogen owadów będzie najbardziej efektywny (Meyling i Eilenberg, 2007; Meyling i in, 2009; Perez-Gonzalez et al., 2014).
Życie w glebie
Gleba może działać jako rezerwuar dla inokulantów grzybowych (Castrillo et al., 2010), rozpraszając się nadziemnie przez wiatr, rozpryskiwanie deszczu i aktywność owadów lub poprzez infekcję owadów żyjących w glebie i promienisty wzrost hyfusów (Meyling i Eilenberg, 2007). Skuteczność i trwałość grzybów hipokremicznych zależy od rodzaju gleby, poziomu wilgotności i interakcji mikrobiologicznych (Inglis i in., 2001). Podczas gdy gleby tropikalne mogą zawierać bardzo dużą ilość materii organicznej i różnorodność mikrobiologiczną, poziomy rolnicze dla każdego z nich zależą głównie od praktyk zarządzania gospodarstwem (Moeskops i in., 2010; Bai i in., 2018), a tekstura jest bardzo zróżnicowana wśród gleb tropikalnych, bez wyraźnego odróżnienia od systemów umiarkowanych (Pulla i in., 2016). Dlatego też badania z okresu umiarkowanego opisujące wpływ cech fizycznych gleby na trwałość i skuteczność EPF mają prawdopodobnie bezpośrednie zastosowanie do systemów tropikalnych.
Gleby o wysokiej zawartości materii organicznej często tętnią życiem mikrobów, potencjalnie umożliwiając antagonistyczne interakcje między mikrobami (Inglis i in., 1998; Pal i Gardener, 2006). W badaniach prowadzonych w klimacie umiarkowanym, antagonistyczne efekty zwiększonej aktywności mikrobiologicznej w glebie przyczyniły się do zahamowania rozwoju B. bassiana (Studdert i Kaya, 1990; Kessler i in., 2003; Quesada-Moraga i in., 2007), B. brongniartii (Kessler i in., 2004) oraz M. anisopliae (Jabbour i Barbercheck, 2009). Na przykład, wysoka wilgotność gleby sprzyjała występowaniu organizmów antagonistycznych, co sugeruje, że wilgotność gleby może bezpośrednio lub pośrednio ograniczać przeżywalność konidiów (Lingg i Donaldson, 1981; Jabbour i Barbercheck, 2009). Zostało to jednak obalone przez inne badania przeprowadzone w regionach o umiarkowanym klimacie, w których stwierdzono niewielki związek między wilgotnością gleby a występowaniem EPF lub brak takiego związku, potencjalnie z powodu ograniczonej zmienności poziomów wilgotności w próbkach gleby lub niedoboru tlenu (Griffin, 1963; Ali-Shtayeh et al., 2003; Kessler et al., 2003).
Poziomy tlenu w glebie podczas infekcji mogą promować wzrost grzybni, tolerancję termiczną, kiełkowanie i wirulencję wobec owadów (Garza-López et al., 2012; Miranda-Hernández et al., 2014; Garcia-Ortiz et al., 2015; García-Ortiz et al., 2018; Oliveira i Rangel, 2018). Badania in vitro ujawniają pozytywną korelację pomiędzy wzbogaconymi stężeniami tlenu (26 i 30% O2) a jakością konidiów w porównaniu do normalnych poziomów tlenu atmosferycznego (21% O2) (Miranda-Hernández et al., 2014; Garcia-Ortiz et al., 2015; García-Ortiz et al., 2018). Podobnie, przy pozbawionym tlenu poziomie, obowiązuje ten sam kontrast we wzroście konidiów i wirulencji, zmniejszający się w warunkach stężenia tlenu otoczenia (Garza-López i in., 2012; Oliveira i Rangel, 2018). Kiełkowanie w warunkach hipoksji jest niższe niż przy normalnych poziomach atmosferycznych (Garza-López i in., 2012), zwiększając się w miarę wzbogacania warunków tlenowych (Miranda-Hernández i in., 2014). Tak więc, napowietrzanie gleby podczas wzrostu grzybni może ułatwić optymalny rozwój grzybów entomopatogenicznych i zwalczanie szkodników.
Tekstura gleby wpływa na przenoszenie i zatrzymywanie propagul grzybowych. Zwiększona zawartość gliny może sprzyjać utrzymywaniu się entomopatogenicznych grzybów, prawdopodobnie ze względu na mniejszy rozmiar porów i/lub adsorpcję konidiów na glinie i cząstkach organicznych (Ignoffo i in., 1977; Storey i Gardner, 1988; Quesada-Moraga i in., 2007). Jednak wysoka zawartość gliny może również ograniczać zdolność potencjalnego gospodarza do napotkania innego, ze względu na zmniejszoną porowatość umożliwiającą penetrację konidiów do głębszych warstw gleby i potencjalne przenoszenie (Vänninen i in., 2000; Fuxa i Richter, 2004). Dlatego też mechaniczna filtracja struktury gleby może być głównym czynnikiem determinującym trwałość i skuteczność działania grzybów entomopatogenicznych w przypadku ich zastosowania w glebie (Storey i Gardner, 1988). Na przykład, skuteczność B. bassiana przeciwko czerwonym mrówkom ogniowym Solenopsis invicta poprawiła się, gdy zastosowano ją w bardziej wilgotnych glebach, co sprzyjało przenoszeniu konidiów i infekcji (Fuxa i Richter, 2004).
Niche Preference
The Habitat Selection Hypothesis
Interakcje biotyczne mogą zmieniać trwałość tropikalnych EPF (Jaronski, 2010), szczególnie The habitat selection hypothesis for Metarhizium species suggests this is a key difference between temperate and tropical regions (Bidochka et al., 2002). Bidochka i Small (2005) sugerują, że genotypy Metarhizium są związane z typami siedlisk w regionach umiarkowanych i polarnych, a w regionach (sub)tropikalnych są bardziej prawdopodobne, że są związane z określonymi owadami żywicielami. Autorzy zasugerowali również, że M. anisopliae pochodzi z południowo-wschodniej Azji, ale obecnie obejmuje zespół kryptycznych gatunków, z których wiele przekracza duże bariery geograficzne. Badania dotyczące Beauveria i Metarhizium w klimacie umiarkowanym podkreśliły, że preferują one wybór siedliska zamiast związków z żywicielami owadzimi (Meyling i Eilenberg, 2006b; Meyling et al., 2009; Ormond et al., 2010). Wszelkie związki M. anisopliae z owadami żywicielami na wyższych szerokościach geograficznych przypisywano siedlisku owada, co sugeruje, że czynniki abiotyczne mogą potencjalnie wpływać na strukturę genetyczną populacji (Bidochka i in., 2001).
Takatsuka (2007) scharakteryzował izolaty Beauveria z Japonii przy użyciu ISSR-PCR i nie znalazł dowodów na długotrwałą koewolucję między grzybem a owadami-żywicielami, wspierając hipotezę Bidochka et al. (2002), że zmienność w utrzymywaniu się wolno żyjącego, saprofitycznego stadium fakultatywnego patogenu owadów napędza strukturę genetyczną populacji. Z kolei Bridge i wsp. (1997) sugerowali koewolucję pomiędzy tropikalnymi izolatami M. flavoviride var. minus o jednym genotypie a owadami należącymi do nadrodziny Acridoidea. Tropikalne izolaty M. flavoviride var. minus z cechami preferencji żywiciela różniły się od tych o pochodzeniu europejskim. Co ciekawe, większość izolatów w publikacjach wspierających hipotezę Bidochki i Small (2005) dotyczącą związku Metarhizium spp. z gatunkami owadów żywicielskich ma pochodzenie tropikalne (Rombach i in., 1986; St. Leger i in., 1992; Bridge i in., 1993, 1997; Leal i in., 1994; Tigano-Milani i in., 1995). Potrzebne są jednak przyszłe analizy, aby określić te zależności.
Szczepy Metarhizium przystosowały się do poszczególnych środowisk, wspierając wszechstronne strategie życiowe (Lovett i St. Leger, 2015). Dostosowania w reakcjach na stres środowiskowy mogą wynikać z adaptacji do środowiskowych czynników abiotycznych (np. temperatura, promieniowanie UV, wilgotność) i biotycznych związanych z infekcją gospodarza (np. stresory przeciwdrobnoustrojowe i behawioralne) (Lovett i St. Leger, 2015; Ortiz-Urquiza i Keyhani, 2015). Konidia produkowane w warunkach stresu abiotycznego i biotycznego mogą wytrzymać szerszy zakres środowiskowy, a także poprawić wirulencję wobec owadów (Li i in., 2015; Rangel i in., 2015). Na przykład, przezwyciężenie ostrych gorączek behawioralnych gospodarza podczas infekcji może prowadzić do wytworzenia bardziej termotolerancyjnych izolatów grzybów entomopatogenicznych (Fargues i in., 1997; Blanford i Thomas, 2000; Rangel i in., 2005). Behawioralne cechy obronne u pasikoników mogą powodować rozbieżności pomiędzy gatunkami grzybów entomopatogenicznych i ich efektywnością w zwalczaniu populacji szkodników w różnych temperaturach (Inglis i in., 1999). Nimfy pasikoników zainfekowane B. bassiana i M. acridum doświadczały obniżonego poziomu śmiertelności, gdy temperatura była podwyższona, a M. acridum znacznie przewyższał B. bassiana w śmiertelności nimf w wyższych temperaturach (Inglis i in., 1999).
W oparciu o dowody przedstawione głównie dla Metarhizium proponujemy dwie ogólne hipotezy dla EPF: (i) Czynniki abiotyczne są głównymi determinantami struktury genetycznej populacji na wyższych szerokościach geograficznych, ze względu na wymóg dostosowania sezonowości i ekstremalnych warunków środowiskowych przez patogeny owadów. (ii) Z drugiej strony, czynniki biotyczne (interakcje z innymi gatunkami i szlaki infekcji związane z grzybami-gospodarzami) są głównymi regulatorami struktury genetycznej populacji EPF w niższych szerokościach geograficznych. Poniżej przedstawiamy ocenę tych hipotez w świetle najnowszych badań. Aby wizualnie przedstawić nasze hipotezy, skonstruowaliśmy model konceptualny (Ryc. 1). Ma to na celu jakościowe opisanie naszych hipotez, aby stymulować przyszłe badania, a nie stać samodzielnie jako model matematyczny.
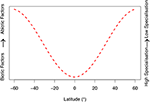
Rysunek 1. Jakościowy model konceptualny oparty na hipotezach opracowanych przez naszych recenzentów. Specyfika grzybowych zbiorowisk entomopatogenicznych zmienia się wraz z szerokością geograficzną, co odpowiada czynnikom biotycznym i abiotycznym. Czynniki biotyczne związane są z interakcjami z gospodarzem i innymi mikroorganizmami (np. koewolucyjne wyścigi zbrojeń i szlaki infekcji). Czynniki abiotyczne obejmują zmienne środowiskowe, takie jak temperatura, wilgotność, promieniowanie UV oraz stresory oksydacyjne i osmotyczne. Zakres równoleżnikowy został ograniczony do 60°N i 60°S, ponieważ ta liczba nie uwzględnia ekstremów klimatycznych poza tymi progami na zbiorowiska grzybów. Stawiamy hipotezę, że na niższych szerokościach geograficznych entomopatogeniczne grzyby zasiedlają bardziej idealne warunki środowiskowe, pomimo zwiększonej presji ze strony innych gatunków grzybów i większej obrony gospodarza (więcej informacji w rozdziałach „Warunki abiotyczne a adaptacja” i „Interakcje biotyczne a adaptacja” w tekście głównym). Odpowiada to wzrostowi specjalizacji grzybów entomopatogenicznych.
Warunki abiotyczne i adaptacja
Grzyby zamieszkujące wyższe szerokości geograficzne doświadczają szerszego zakresu temperatur ze względu na sezonowość (Wielgolaski i Inouye, 2003). Tak więc, abiotyczne czynniki stresowe (szczególnie temperatura) na wyższych szerokościach geograficznych mogą w głównej mierze wpływać na genetykę populacji i zdolności adaptacyjne EPF. W regionach umiarkowanych EPF musi przystosować się do szerokiego zakresu i większych poziomów intensywności warunków klimatycznych (Maggi i in., 2013; Wang i in., 2017), przy czym czynniki abiotyczne wpływają przede wszystkim na przeżywalność patogenu generalistycznego (Bidochka i in., 2001; Lennon i in., 2012). W przeciwieństwie do tego, stawiamy hipotezę, że czynniki biotyczne występujące na niskich szerokościach geograficznych, takie jak bogactwo gatunkowe i związki patogen-insekt, które napędzają koewolucyjne wyścigi zbrojeń, w przeważającym stopniu wpływają na historię życiową EPF. Filogenetycznie B. bassiana grupuje się według typu siedliska bardziej w sezonowo zmiennych wysokich szerokościach geograficznych (Ormond i in., 2010), chociaż jedno z badań nie wykazało efektu sezonowego w regionach o klimacie subtropikalnym (Garrido-Jurado i in., 2015). Badania o strukturze filogenetycznej sugerują, że B. bassiana dostosowuje regulację genów do warunków środowiskowych, przy czym adaptacja siedliskowa napędza dynamikę populacji (Bidochka i in., 2002; Xiao i in., 2012). Tak więc, różnice w wielkości sezonowych warunków środowiskowych na różnych szerokościach geograficznych mogą przyczyniać się do obserwowanych czasowych różnic w dynamice populacji B. bassiana pomiędzy badaniami.
Warunki środowiskowe w pobliżu granic przeżywalności grzybów entomopatogenicznych mogą napędzać lokalną adaptację, gdy granice te są regularnie doświadczane (Doberski, 1981; Vidal et al., 1997). Temperatura optymalna dla wzrostu i wirulencji gatunków Metarhizium i Beauveria w stosunku do owadów żywicieli wynosi na ogół od 25 do 30°C (Luz i Fargues, 1997; Ekesi i in., 1999; Devi i in., 2005; Bugeme i in., 2009). Jednakże, istnieje znaczna zmienność w preferencjach termicznych gatunków patogenów grzybowych i ich wpływu na potencjalnych gospodarzy, ze względu na środowisko, w którym patogeny ewoluowały (Fargues i in., 1997; Bugeme i in., 2009; Alali i in., 2019), a poszczególne szczepy mogą różnić się w swoich optymach termicznych (Doberski, 1981; Thomas i Jenkins, 1997; Alali i in., 2019). Izolaty M. acridum uzyskane z gorącego środowiska wykazywały większą wydajność w wyższych temperaturach niż te pochodzące ze znacznie chłodniejszego klimatu (Thomas i Jenkins, 1997). Podobnie, sub-tropikalne szczepy B. bassiana zebrane z gorętszych obszarów Syrii wykazywały większą zdolność termotolerancyjną niż ostaniec zebrany z miejsca doświadczającego niższych temperatur (Alali i in., 2019). Jeśli chodzi o wirulencję wobec owadów, umiarkowane izolaty B. bassiana były znacząco bardziej skuteczne wobec kornika wiązowego (Scolytus scolytus F.) w niskich temperaturach (od 2 do 6°C) niż izolaty M. anisopliae pochodzące z tropikalnych i subtropikalnych szerokości geograficznych (Doberski, 1981), chociaż niemożliwe jest oddzielenie różnic gatunkowych grzybów od różnic wynikających ze źródeł geograficznych obu szczepów grzybów. B. bassiana i M. anisopliae są również wrażliwe na promieniowanie ultrafioletowe, co skłania do stosowania środków ochronnych UV w olejowych opryskach polowych (Inglis i in., 1995; Shin i in., 2017; Kumar i in., 2018). Tolerancja na promieniowanie UV często różni się wśród izolatów pochodzących z różnych szerokości geograficznych (Braga i in., 2001; Fernandes i in., 2008) oraz typów siedlisk (Bidochka i in., 2001). Izolaty B. bassiana i M. anisopliae znajdujące się bliżej równika wykazują większą tolerancję na promieniowanie UV, a przystosowane do zimna populacje z wyższych szerokości geograficznych zazwyczaj doświadczają optymalnych warunków w niższych temperaturach (Fernandes et al., 2008). W Kanadzie izolaty Metarhizium spotykane w siedliskach leśnych są mniej tolerancyjne na promieniowanie UV i są bardziej zimnolubne w porównaniu z krajobrazami rolniczymi (Bidochka i in., 2001). Tak więc, selekcja abiotyczna na wysokich szerokościach geograficznych (np, UV w danym typie siedliska) dla określonych grup genetycznych entomopatogenów grzybowych może wpływać na ich efektywność w rolnictwie, szczególnie jeśli izolaty pochodzą z siedlisk leśnych lub żywopłotowych.
Interakcje biotyczne i adaptacja
Lasy tropikalne wspierają wysoką różnorodność entomopatogenicznych mykotaksji, gdzie teleomorfy (stadia płciowe) grzybów hipokrealnych występują w większości i są często bardziej wyspecjalizowane w swoim zasięgu żywicielskim niż morfotypy bezpłciowe (Evans, 1982; Vega i in., 2012; Hu i in., 2014). Natomiast rozwijające się bezpłciowo EPF (anamorfy) zasiedlają zarówno klimat tropikalny, jak i umiarkowany (Vega i in., 2012). W badaniach laboratoryjnych w systemach modelowych, w których zwiększono bioróżnorodność, zaobserwowano odpowiednią intensyfikację ewolucyjnych wyścigów zbrojeń między żywicielami i pasożytami (Betts i in., 2018). Podobnie, różnorodność genetyczna i specyficzność żywicielska niektórych gatunków grzybów sugeruje, że owady-gospodarze mogą wywierać silną presję selektywną na patogeny poprzez kaskadę mechanizmów obronnych i przeciwobronnych (Maurer i in., 1997; Evans i in., 2011; Mukherjee i Vilcinskas, 2018). Na przykład Metarhizium często ewoluowały ze specjalistycznych do ogólnych patogenów owadów; rozszerzenie zakresu żywicieli zbiegające się z zajęciem przez grzyby rozszerzającego się zakresu równoleżnikowego (Bidochka i Small, 2005; Hu i in., 2014). Jednakże na obszarach lasów deszczowych o wysokiej gęstości gatunkowej, wysoka różnorodność tropikalna grzybów może doświadczać silniejszej presji ze strony gospodarzy i konkurentów, co może sprzyjać występowaniu patogenów, takich jak teleomorficzny rodzaj Cordyceps (Evans, 1982; Sung i in., 2007; Aung i in., 2008), oraz wyspecjalizowanych entomopatogenów grzybowych z rodzaju Ophiocordyceps (Aung i in., 2008; Evans i in., 2011; Araújo i in., 2015). Analizy filogenomiczne sugerują, że Beauveria spp. jest bezpłciowym stadium rozwojowym linii Cordyceps (Xiao i in., 2012). Mimo że Beauveria ma bezpośrednie powiązania genetyczne z Cordyceps, uogólnione Beauveria i Metarhizium są mniej powszechne w siedliskach lasów tropikalnych, a częściej spotykane w rolnictwie (Rehner, 2005; Aung et al., 2008). Kontrast w historii życia między tymi specjalistami a grzybami generalistycznymi można przypisać utracie mutacji punktowych wywołanych przez powtórzenia u B. bassiana i Metarhizium spp. (co sugeruje, że cykl płciowy jest rzadki u obu grzybów), co było warunkiem wstępnym tych patogenów grzybowych dla ekspansji rodzin genów (Xiao i in., 2012; Lovett i St. Leger, 2017).
Zważywszy na prawdopodobne południowo-wschodnioazjatyckie pochodzenie Metarhizium (kontynent o największej różnorodności genotypowej) (Bidochka i Small, 2005; Lovett i St. Leger, 2017) oraz późniejsze ewolucyjne zmiany w specyficzności (Hu i in., 2014), rozszerzenie zasięgu geograficznego do regionów umiarkowanych mogło odpowiadać bardziej generalistycznemu zakresowi gospodarza. Stawiamy hipotezę, że mogło to być spowodowane częściowo mniejszym bogactwem gatunkowym żywicieli w regionach umiarkowanych (Thompson i in., 2017) oraz potrzebą dostosowania się do większej zmienności warunków klimatycznych, koncentrującej się na adaptacji do warunków abiotycznych. Pozostaje pytanie, jak większa potencjalna różnorodność żywicieli w środowiskach tropikalnych zmienia te presje selekcyjne. Przyszłe badania nad tym, jak owadzio-patogenowe wyścigi zbrojeń zmieniają skład zbiorowiska wraz ze zmianą szerokości geograficznej, poprawiłyby zarządzanie entomopatogenami na różnych szerokościach geograficznych. Dodatkowo, empiryczne oceny grzybów zebranych na różnych szerokościach geograficznych i eksperymenty laboratoryjne poprawią naszą wiedzę o endemicznych gatunkach grzybów i ich znaczeniu w danym systemie, wraz z ich odpowiednim wykorzystaniem w systemach biokontroli.
Ulepszanie trwałości grzybów i zapobieganie epidemiom owadów
Zdolność niektórych gatunków grzybów do przekraczania dużych barier geograficznych (tj, kosmopolityczny charakter) nie oznacza, że zastosowanie patogenów grzybowych jako biopestycydów rolniczych zapewni trwałość grzybów. Wymagane jest raczej zbadanie adekwatności patogenu grzybowego specyficznego dla środowiska docelowego, z uwzględnieniem interaktywnego wpływu poszczególnych czynników biotycznych/abiotycznych. Wysiłki powinny być ukierunkowane na skupienie się na endemicznych zbiorowiskach grzybów i zastosowanie ich w ramach systemu pochodnego. Regionalne różnice pomiędzy odpowiednim rodzajem zastosowania grzybów, zakresem gospodarza (tj. generalista vs. specjalista) i dominującymi czynnikami środowiskowymi (biotycznymi/abiotycznymi) na wydajność patogenu mogą lepiej przewidzieć długoterminowy sukces entomopatogenicznej biokontroli i pomóc w zapobieganiu epidemii owadów.
Wkład autorów
AM napisał pierwszy projekt. AM i TN wnieśli znaczący wkład do kolejnych projektów.
Funding
AM był wspierany przez grant AusIndustry Innovations Connections dla TN.
Konflikt interesów
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Akello, J., Dubois, T., Coyne, D., and Kyamanywa, S. (2008). Effect of endophytic Beauveria bassiana on populations of the banana weevil, Cosmopolites sordidus, and their damage in tissue-cultured banana plants. Entomol. Exp. Appl. 129, 157-165. doi: 10.1111/j.1570-7458.2008.00759.x
CrossRef Full Text | Google Scholar
Akmal, M., Freed, S., Malik, M. N., and Gul, H. T. (2013). Efficacy of Beauveria bassiana (Deuteromycotina: Hypomycetes) against different aphid species under laboratory conditions. Pak. J. Zool. 45, 71-78.
Google Scholar
Alali, S., Mereghetti, V., Faoro, F., Bocchi, S., Al Azmeh, F., and Montagna, M. (2019). Thermotolerant isolates of Beauveria bassiana as potential control agent of insect pest in subtropical climates. PLoS ONE 14:e0211457. doi: 10.1371/journal.pone.0211457
PubMed Abstract | CrossRef Full Text | Google Scholar
Ali-Shtayeh, M. S., Mara’i, A.-B. B. M., and Jamous, R. M. (2003). Distribution, occurrence and characterization of entomopathogenic fungi in agricultural soil in the Palestinian area. Mycopathologia 156, 235-244. doi: 10.1023/A:1023339103522
PubMed Abstract | CrossRef Full Text | Google Scholar
Araújo, J. P. M., Evans, H. C., Geiser, D. M., Mackay, W. P., and Hughes, D. P. (2015). Unravelling the diversity behind the Ophiocordyceps unilateralis complex: three new species of zombie-ant fungi from the Brazilian Amazon. Zootaxa 22, 224-238. doi: 10.11646/phytotaxa.220.3.2
CrossRef Full Text | Google Scholar
Aung, O. M., Soytong, K., and Hyde, K. (2008). Diversity of entomopathogenic fungi in rainforests of Chiang Mai Province, Thailand. Fungal Divers. 30, 15-22.
Google Scholar
Bai, Z., Caspari, T., Gonzalez, M. R., Batjes, N. H., Mäder, P., Bünemann, E. K., et al. (2018). Effects of agricultural management practices on soil quality: a review of long-term experiments for Europe and China. Agric. Ecosyst. Environ. 265, 1-7. doi: 10.1016/j.agee.2018.05.028
CrossRef Full Text | Google Scholar
Behie, S. W., Jones, S. J., and Bidochka, M. J. (2015). Plant tissue localization of the endophytic insect pathogenic fungi Metarhizium and Beauveria. Fungal Ecol. 13, 112-119. doi: 10.1016/j.funeco.2014.08.001
CrossRef Full Text | Google Scholar
Behie, S. W., Zelisko, P., and Bidochka, M. J. (2012). Endophytic insect-parasitic fungi translocate nitrogen directly from insects to plants. Science 336, 1576-1577. doi: 10.1126/science.1222289
PubMed Abstract | CrossRef Full Text | Google Scholar
Betts, A., Gray, C., Zelek, M., MacLean, R. C., and King, K. C. (2018). Wysoka różnorodność pasożytów przyspiesza adaptację i dywersyfikację gospodarza. Science 360, 907-911. doi: 10.1126/science.aam9974
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., Kamp, A. M., Lavender, T. M., Dekoning, J., and De Croos, J. N. (2001). Habitat association in two genetic groups of the insect-pathogenic fungus Metarhizium anisopliae: uncovering cryptic species? Appl. Environ. Microbiol. 67, 1335-1342. doi: 10.1128/AEM.67.3.1335-1342.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., Menzies, F. V., and Kamp, A. M. (2002). Genetic groups of the insect-pathogenic fungus Beauveria bassiana are associated with habitat and thermal growth preferences. Arch. Microbiol. 178, 531-537. doi: 10.1007/s00203-002-0490-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidochka, M. J., and Small, C. L. (2005). „Phylogeography of Metarhizium, an insect pathogenic fungus,” in Insect-Fungal Associations: Ecology and Evolution, eds F. E. Vega and M. Blackwell (New York, NY: Oxford University Press), 75-118.
Google Scholar
Blanford, S., and Thomas, M. B. (2000). Termiczne zachowanie dwóch gatunków cierpkich: wpływ siedliska i pory roku na temperaturę ciała i potencjalny wpływ na biokontrolę z patogenami. Environ. Entomol. 29, 1060-1069. doi: 10.1603/0046-225X-29.5.1060
CrossRef Full Text | Google Scholar
Braga, G., Flint, S., Miller, C., Anderson, A., and Roberts, D. (2001). Variability in response to UV-B among species and strains of Metarhizium isolated from sites at latitudes from 61°N to 54°S. J. Invertebr. Pathol. 78, 98-108. doi: 10.1006/jipa.2001.5048
PubMed Abstract | CrossRef Full Text | Google Scholar
Bridge, P. D., Prior, C., Sagbohan, J., Lomer, C. J., Carey, M., and Buddie, A. (1997). Molecular characterization of isolates of Metarhizium from locusts and grasshoppers. Biodivers. Conserv. 6, 177-189. doi: 10.1023/A:1018387918686
CrossRef Full Text | Google Scholar
Bridge, P. D., Williams, M. A. J., Prior, C., and Paterson, R. R. M. (1993). Morfologiczna, biochemiczna i molekularna charakterystyka Metarhizium anisopliae i M. flavoviride. J. Gen. Microbiol 139, 1163-1169. doi: 10.1099/00221287-139-6-1163
CrossRef Full Text | Google Scholar
Bugeme, D. M., Knapp, M., Boga, H. I., Wanjoya, A. K., and Maniania, N. K. (2009). Influence of temperature on virulence of fungal isolates of Metarhizium anisopliae and Beauveria bassiana to the two-spotted spider mite Tetranychus urticae. Mycopathologia 167, 221-227. doi: 10.1007/s11046-008-9164-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Castrillo, L. A., Bauer, L. S., Liu, H., Griggs, M. H., and Vandenberg, J. D. (2010). Characterization of Beauveria bassiana (Ascomycota: Hypocreales) isolates associated with Agrilus planipennis (Coleoptera: Buprestidae) populations in Michigan. Biol. Control 54, 135-140. doi: 10.1016/j.biocontrol.2010.04.005
CrossRef Full Text | Google Scholar
Devi, K. U., Sridevi, V., Mohan, C. M., and Padmavathi, J. (2005). Effect of high temperature and water stress on in vitro germination and growth in isolates of the entomopathogenic fungus Beauveria bassiana (Bals.) Vuillemin. J. Invertebr. Pathol. 88, 181-189. doi: 10.1016/j.jip.2005.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Doberski, J. W. (1981). Comparative laboratory studies on three fungal pathogens of the elm bark beetle Scolytus scolytus: wpływ temperatury i wilgotności na porażenie przez Beauveria bassiana, Metarhizium anisopliae i Paecilomyces farinosus. J. Invertebr. Pathol. 37, 195-200. doi: 10.1016/0022-2011(81)90075-6
CrossRef Full Text | Google Scholar
Driver, F., Milner, R. J., and Trueman, J. W. H. (2000). A taxonomic revision of Metarhizium based on a phylogenetic analysis of rDNA sequence data. Mycol. Res. 104, 134-150. doi: 10.1017/S0953756299001756
CrossRef Full Text | Google Scholar
Ekesi, S., Maniania, N. K., and Ampong-Nyarko, K. (1999). Effect of temperature on germination, radial growth and virulence of Metarhizium anisopliae and Beauveria bassiana on Megalurothrips sjostedti. Biocontrol Sci. Technol. 9, 177-185. doi: 10.1080/09583159929767
CrossRef Full Text | Google Scholar
Evans, H. C. (1982). Entomogenous fungi in tropical forest ecosystems: an appraisal. Ecol. Entomol. 7, 47-60. doi: 10.1111/j.1365-2311.1982.tb00643.x
CrossRef Full Text | Google Scholar
Evans, H. C., Elliot, S. L., and Hughes, D. P. (2011). Hidden diversity behind the zombie-ant fungus Ophiocordyceps unilateralis: Cztery nowe gatunki opisane z mrówek stolarskich w Minas Gerais, Brazylia. PLoS ONE 6:e17024. doi: 10.1371/journal.pone.0017024
PubMed Abstract | CrossRef Full Text | Google Scholar
Fargues, J., Goettel, M. S., Smits, N., Ouedraogo, A., and Rougier, M. (1997). Effect of temperature on vegetative growth of Beauveria bassiana isolates from different origins. Mycologia 89, 383-892. doi: 10.1080/00275514.1997.12026797
CrossRef Full Text | Google Scholar
Fargues, J., and Luz, C. (2000). Effects of fluctuating moisture and temperature regimes on the infection potential of Beauveria bassiana for Rhodnius prolixus. J. Invertebr. Pathol. 75, 202-211. doi: 10.1006/jipa.1999.4923
PubMed Abstract | CrossRef Full Text | Google Scholar
Faria, M. R. D., and Wraight, S. P. (2007). Mycoinsecticides and mycoacaricides: a comprehensive list with worldwide coverage and international classification of formulation types. Biol. Control 43, 237-256. doi: 10.1016/j.biocontrol.2007.08.001
CrossRef Full Text | Google Scholar
Fernandes, E. K., Rangel, D. E. N., Moraes, Á. M. L., Bittencourt, V. R. E. P., and Roberts, D. W. (2008). Cold activity of Beauveria and Metarhizium, and thermotolerance of Beauveria. J. Invertebr. Pathol. 98, 69-78. doi: 10.1016/j.jip.2007.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuxa, J. R., and Richter, A. R. (2004). Effects of soil moisture and composition and fungal isolate on prevalence of Beauveria bassiana in laboratory colonies of the red imported fire ant (Hymenoptera: Formicidae). Environ. Entomol. 33, 975-981. doi: 10.1603/0046-225X-33.4.975
CrossRef Full Text | Google Scholar
García-Ortiz, N., Figueroa-Martínez, F. J., Carrasco-Navarro, U., Favela-Torres, E., and Loera, O. (2018). Stężenie tlenu w kulturach moduluje ekspresję białek i enzymatyczne odpowiedzi antyoksydacyjne w konidiach Metarhizium lepidiotae. Fungal Biol. 122, 487-496. doi: 10.1016/j.funbio.2017.10.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Garcia-Ortiz, N., Tlecuitl-Beristain, S., Favela-Torres, E., and Loera, O. (2015). Production and quality of conidia by Metarhizium anisopliae var. lepidiotum: critical oxygen level and period of mycelium competence. Appl. Microbiol. Biotechnol. 99, 2783-2791. doi: 10.1007/s00253-014-6225-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Garrido-Jurado, I., Fernandez-Bravo, M., Campos, C., and Quesada-Moraga, E. (2015). Diversity of entomopathogenic Hypocreales in soil and phylloplanes of five Mediterranean cropping systems. J. Invertebr. Pathol. 130, 97-106. doi: 10.1016/j.jip.2015.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Garza-López, P. M., Konigsberg, M., Gómez-Quiroz, L. E., and Loera, O. (2012). Physiological and antioxidant response by Beauveria bassiana Bals (Vuill.) to different oxygen concentrations. World J. Microbiol. Biotechnol. 28, 353-359. doi: 10.1007/s11274-011-0827-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Greenfield, M., Gomez-Jimenez, M. I., Ortiz, V., Vega, F. E., Kramer, M., and Parsa, S. (2016). Beauveria bassiana and Metarhizium anisopliae endophytically colonize cassava roots following soil drench inoculation. Biol. Control 95, 40-48. doi: 10.1016/j.biocontrol.2016.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Griffin, D. M. (1963). Wilgotność gleby i ekologia grzybów glebowych. Biol. Rev. 38, 141-166. doi: 10.1111/j.1469-185X.1963.tb00781.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Hu, X., Xiao, G., Zheng, P., Shang, Y., Su, Y., Zhang, X., et al. (2014). Trajectory and genomic determinants of fungal-pathogen speciation and host adaptation. Proc. Natl. Acad. Sci. U.S.A. 111, 16796-16801. doi: 10.1073/pnas.1412662111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ignoffo, C. M., Garcia, C., Hostetter, D. L., and Pinnell, R. E. (1977). Vertical movement of conidia of Nomuraea rileyi through sand and loam soils. J. Econ. Entomol. 70, 163-164. doi: 10.1093/jee/70.2.163
CrossRef Full Text | Google Scholar
Inglis, G., Goettel, M. S., Butt, T., and Strasser, H. (2001). „Use of hyphomycetous fungi for managing insect pests,” in Fungi as Biocontrol Agents: Progress, Problems and Potential, eds T. M. Butt, C. Jackson, and N. Magan (Oxfordshire: CABI Publishing), 23-69. doi: 10.1079/9780851993560.0023
CrossRef Full Text | Google Scholar
Inglis, G. D., Duke, G. M., Goettel, M. S., Kabaluk, J. T., and Ortega-Polo, R. (2019). Biogeografia i różnorodność genotypowa Metarhizium brunneum i Metarhizium robertsii w północno-zachodnich glebach Ameryki Północnej. Can. J. Microbiol. 65, 261-281. doi: 10.1139/cjm-2018-0297
PubMed Abstract | CrossRef Full Text | Google Scholar
Inglis, G. D., Duke, G. M., Kawchuk, L. M., and Goettel, M. S. (1999). Influence of oscillating temperatures on the competitive infection and colonization of the migratory grasshopper by Beauveria bassiana and Metarhizium flavoviride. Biol. control 14, 111-120. doi: 10.1006/bcon.1998.0666
CrossRef Full Text | Google Scholar
Inglis, G. D., Goettel, M. S., and Johnson, D. L. (1995). Influence of ultraviolet light protectants on persistence of the entomopathogenic fungus, Beauveria bassiana. Biol. Control 5, 581-590. doi: 10.1006/bcon.1995.1069
CrossRef Full Text | Google Scholar
Inglis, G. D., Johnson, D. L., Kawchuk, L. M., and Goettel, M. S. (1998). Effect of soil texture and soil sterilization on susceptibility of ovipositing grasshoppers to Beauveria bassiana. J. Invertebr. 71, 73-81. doi: 10.1006/jipa.1997.4698
PubMed Abstract | CrossRef Full Text | Google Scholar
Jabbour, R., and Barbercheck, M. E. (2009). Soil management effects on entomopathogenic fungi during the transition to organic agriculture in a feed grain rotation. Biol. Control 51, 435-443. doi: 10.1016/j.biocontrol.2009.08.004
CrossRef Full Text | Google Scholar
Jaronski, S. T. (2010). Ecological factors in the inundative use of fungal entomopathogens. Biocontrol 55, 159-185. doi: 10.1007/s10526-009-9248-3
CrossRef Full Text | Google Scholar
Kassa, A., Stephan, D., Vidal, S., and Zimmermann, G. (2004). Laboratory and field evaluation of different formulations of Metarhizium anisopliae var. acridum submerged spores and aerial conidia for the control of locusts and grasshoppers. Biocontrol 49, 63-81. doi: 10.1023/B:BICO.0000009384.46858.aa
CrossRef Full Text | Google Scholar
Kessler, P., Enkerl, J., Schweize, C., and Keller, S. (2004). Survival of Beauveria brongniartii in the soil after application as a biocontrol agent against the European cockchaff Melolontha melolontha. Biocontrol 49, 563-581. doi: 10.1023/B:BICO.0000036441.40227.ed
CrossRef Full Text | Google Scholar
Kessler, P., Matzke, H., and Keller, S. (2003). The effect of application time and soil factors on the occurrence of Beauveria brongniartii applied as a biological control agent in soil. J. Invertebr. Pathol. 84, 15-23. doi: 10.1016/j.jip.2003.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Keyser, C. A., Fernandes, É. K. K., Rangel, D. E. N., Foster, R. N., Jech, L. E., Reuter, K. C., et al. (2017). Laboratoryjne testy biologiczne i polowe próby klatkowe izolatów Metarhizium spp. z zebranymi w terenie świerszczami mormońskimi (Anabrus simplex). Biocontrol 62, 257-268. doi: 10.1007/s10526-016-9782-8
CrossRef Full Text | Google Scholar
Kumar, K. K., Sridhar, J., Murali-Baskaran, R. K., Senthil-Nathan, S., Kaushal, P., Dara, S. K., et al. (2018). Mikrobiologiczne biopestycydy do zwalczania szkodników owadzich w Indiach: obecny status i perspektywy na przyszłość. J. Invertebr. Pathol. 165, 74-81. doi: 10.1016/j.jip.2018.10.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lacey, L. A., Grzywacz, D., Shapiro-Ilan, D. I., Frutos, R., Brownbridge, M., and Goettel, M. S. (2015). Patogeny owadów jako czynniki kontroli biologicznej: powrót do przyszłości. J. Invertebr. Pathol. 132, 1-41. doi: 10.1016/j.jip.2015.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Leal, S. C. M., Bertioli, T. M., Butt, T. M., and Peberdy, J. F. (1994). Characterization of isolates of the entomopathogenic fungus Metarhizium anisopliae by RAPD-PCR. Mycol. Res. 98, 1077-1081. doi: 10.1016/S0953-7562(09)80436-X
CrossRef Full Text | Google Scholar
Lennon, J. T., Aanderud, Z. T., Lehmkuhl, B. K., and Schoolmaster, D. R. Jr. (2012). Mapping the niche space of soil microorganisms using taxonomy and traits. Ecology 93, 1867-1879. doi: 10.1890/11-1745.1
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, F., Shi, H.-Q., Ying, S.-H., and Feng, M.-G. (2015). Distinct contributions of one Fe- and two Cu/Zn-cofactored superoxide dismutases to antioxidation, UV tolerance and virulence of Beauveria bassiana. Fungal Genet. Biol. 81, 160-171. doi: 10.1016/j.fgb.2014.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Z. B., Alves, S., Roberts, D., Fan, M., Delalibera, I., Tang, J., et al. (2010). Biological control of insects in Brazil and China: history, current programs and reasons for their successes using entomopathogenic fungi. Biocontrol Sci. Technol. 20, 117-136. doi: 10.1080/09583150903431665
CrossRef Full Text | Google Scholar
Lingg, A. J., and Donaldson, M. D. (1981). Biotyczne i abiotyczne czynniki wpływające na stabilność konidiów Beauveria bassiana w glebie. J. Invertebr. Pathol. 38, 191-200. doi: 10.1016/0022-2011(81)90122-1
CrossRef Full Text | Google Scholar
Lovett, B., and St. Leger, R. J. (2015). Stres jest raczej regułą niż wyjątkiem dla Metarhizium. Curr. Genet. 61, 253-261. doi: 10.1007/s00294-014-0447-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett, B., and St. Leger, R. J. (2017). The insect pathogens. Microbiol. Spectr. 5, 1-19. doi: 10.1128/microbiolspec.FUNK-0001-2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Luz, C., and Fargues, J. (1997). Temperature and moisture requirements for conidial germination of an isolate of Beauveria bassiana, pathogenic to Rhodnius prolixus. Mycopathologia 138, 117-125. doi: 10.1023/A:1006803812504
PubMed Abstract | CrossRef Full Text | Google Scholar
Maggi, O., Tosi, S., Angelova, M., Lagostina, E., Fabbri, A. A., Pecoraro, L., et al. (2013). Adaptacja grzybów, w tym drożdży, do zimnych środowisk. Plant Biosyst. 147, 247-258. doi: 10.1080/11263504.2012.753135
CrossRef Full Text | Google Scholar
Mahe, F., de Vargas, C., Bass, D., Czech, L., Stamatakis, A., Lara, E., et al. (2017). Parasites dominate hyperdiverse soil protist communities in Neotropical rainforests. Nat. Ecol. Evol. 1:0091. doi: 10.1038/s41559-017-0091
PubMed Abstract | CrossRef Full Text | Google Scholar
Mascarin, G. M., Lopes, R. B., Delalibera, I., Fernandes, E. K. K., Luz, C., and Faria, M. (2019). Current status and perspectives of fungal entomopathogens used for microbial control of arthropod pests in Brazil. J. Invertebr. Pathol. 165, 46-53. doi: 10.1016/j.jip.2018.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Maurer, P., Couteaudier, Y., Girard, P. A., Bridge, P. D., and Riba, G. (1997). Genetic diversity of Beauveria bassiana and relatedness to host insect range. Mycol. Res. 101, 159-164. doi: 10.1017/S0953756296002213
CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2006a). Isolation and characterisation of Beauveria bassiana isolates from phylloplanes of hedgerow vegetation. Mycol. Res. 110, 188-195. doi: 10.1016/j.mycres.2005.09.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2006b). Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agric. Ecosyst. Environ. 113, 336-341. doi: 10.1016/j.agee.2005.10.011
CrossRef Full Text | Google Scholar
Meyling, N. V., and Eilenberg, J. (2007). Ecology of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae in temperate agroecosystems: potential for conservation biological control. Biol. Control 43, 145-155. doi: 10.1016/j.biocontrol.2007.07.007
CrossRef Full Text | Google Scholar
Meyling, N. V., Lubeck, M., Buckley, E. P., Eilenberg, J., and Rehner, S. A. (2009). Community composition, host range and genetic structure of the fungal entomopathogen Beauveria in adjacent agricultural and seminatural habitats. Mol. Ecol. 18, 1282-1293. doi: 10.1111/j.1365-294X.2009.04095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Migiro, L. N., Maniania, N. K., Chabi-Olaye, A., and Vandenberg, J. (2010). Pathogenicity of entomopathogenic fungi Metarhizium anisopliae and Beauveria bassiana (Hypocreales: Clavicipitaceae) isolates to the adult pea leafminer (Diptera: Agromyzidae) and prospects of an autoinoculation device for infection in the field. Environ. Entomol. 39, 468-475. doi: 10.1603/EN09359
PubMed Abstract | CrossRef Full Text | Google Scholar
Miranda-Hernández, F., Saucedo-Castañeda, G., Alatorre-Rosas, R., and Loera, O. (2014). Oxygen-rich culture conditions enhance the conidial infectivity and the quality of two strains of Isaria fumosorosea for potentially improved biocontrol processes. Pest Manage. Sci. 70, 661-666. doi: 10.1002/ps.3605
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeskops, B., Sukristiyonubowo Buchan, D., Sleutel, S., Herawaty, L., Husen, E., et al. (2010). Soil microbial communities and activities under intensive organic and conventional vegetable farming in West Java, Indonesia. Appl. Soil Ecol. 45, 112-120. doi: 10.1016/j.apsoil.2010.03.005
CrossRef Full Text | Google Scholar
Mukherjee, K., and Vilcinskas, A. (2018). Entomopatogeniczny grzyb Metarhizium robertsii komunikuje się z owadzim gospodarzem Galleria mellonella podczas infekcji. Virulence 9, 402-413. doi: 10.1080/21505594.2017.1405190
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira, A. S., and Rangel, D. E. N. (2018). Transient anoxia during Metarhizium robertsii growth increases conidial virulence to Tenebrio molitor. J. Invertebr. Pathol. 153, 130-133. doi: 10.1016/j.jip.2018.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Ormond, E. L., Thomas, A. P., Pugh, P. J., Pell, J. K., and Roy, H. E. (2010). A fungal pathogen in time and space: the population dynamics of Beauveria bassiana in a conifer forest. FEMS Microbiol. Ecol. 74, 146-154. doi: 10.1111/j.1574-6941.2010.00939.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ortiz-Urquiza, A., and Keyhani, N. O. (2015). Stress response signaling and virulence: insights from entomopathogenic fungi. Curr. Genet. 61, 239-249. doi: 10.1007/s00294-014-0439-9
CrossRef Full Text | Google Scholar
Pal, K. K., and Gardener, M. B. (2006). Biologiczne zwalczanie patogenów roślin. Plant Health Instr. doi: 10.1094/PHI-A-2006-1117-02Dostępne online na: http://www.apsnet.org/edcenter/advanced/topics/Pages/BiologicalControl.aspx
CrossRef Full Text | Google Scholar
Perez-Gonzalez, V. H., Guzman-Franco, A. W., Alatorre-Rosas, R., Hernandez-Lopez, J., Hernandez-Lopez, A., Carrillo-Benitez, M. G., et al. (2014). Specific diversity of the entomopathogenic fungi Beauveria and Metarhizium in Mexican agricultural soils. J. Invertebr. Pathol. 119, 54-61. doi: 10.1016/j.jip.2014.04.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Posada, F., and Vega, F. E. (2005). Establishment of the fungal entomopathogen Beauveria bassiana (Ascomycota: Hypocreales) as an endophyte in cocoa seedlings (Theobroma cacao). Mycologia 97, 1195-1200. doi: 10.1080/15572536.2006.11832729
PubMed Abstract | CrossRef Full Text | Google Scholar
Pulla, S., Riotte, J., Suresh, H. S., Dattaraja, H. S., and Sukumar, R. (2016). Controls of soil spatial variability in a dry tropical forest. PLoS ONE 11:e0153212. doi: 10.1371/journal.pone.0153212
PubMed Abstract | CrossRef Full Text | Google Scholar
Quesada-Moraga, E., Navas-Cortes, J. A., Maranhao, E. A., Ortiz-Urquiza, A., and Santiago-Alvarez, C. (2007). Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycol. Res. 111(Pt 8), 947-966. doi: 10.1016/j.mycres.2007.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Rangel, D. E. N., Braga, G. U. L., Anderson, A. J., and Roberts, D. W. (2005). Variability in conidial thermotolerance of Metarhizium anisopliae isolates from different geographic origins. J. Invertebr. Pathol. 88, 116-125. doi: 10.1016/j.jip.2004.11.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rangel, D. E. N., Braga, G. U. L., Fernandes, É. K. K., Keyser, C. A., Hallsworth, J. E., and Roberts, D. W. (2015). Stress tolerance and virulence of insect-pathogenic fungi are determined by environmental conditions during conidial formation. Curr. Genet. 61, 383-404. doi: 10.1007/s00294-015-0477-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehner, S., and Buckley, E. (2005). A Beauveria phylogeny inferred from nuclear ITS and EF1-alpha sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia 97, 84-98. doi: 10.3852/mycologia.97.1.84
PubMed Abstract | CrossRef Full Text | Google Scholar
Rehner, S. A. (2005). „Phylogenetics of the insect pathogenic genus Beauveria,” in Insect-Fungal Associations: Ecology and Evolution, eds F. E. Vega and M. Blackwell (New York, NY: Oxford University Press), 3-27.
Google Scholar
Rombach, M. C., Humber, R. A., and Roberts, D. W. (1986). Metarhizium flavoviride var. minus, var. nov., a pathogen of plant- and leafhoppers on rice in the Philippines and Solomon Islands. Mycotaxon 27, 87-92.
Google Scholar
Shin, T. Y., Bae, S. M., Kim, D. J., Yun, H. G., and Woo, S. D. (2017). Evaluation of virulence, tolerance to environmental factors and antimicrobial activities of entomopathogenic fungi against two-spotted spider mite, Tetranychus urticae. Mycoscience 58, 204-212. doi: 10.1016/j.myc.2017.02.002
CrossRef Full Text | Google Scholar
Singha, D., Singha, B., and Dutta, B. K. (2010). Potential of Metarhizium anisopliae and Beauveria bassiana in the control of tea termite Microtermes obesi Holmgren in vitro and under field conditions. J. Pest. Sci. 84, 69-75. doi: 10.1007/s10340-010-0328-z
CrossRef Full Text | Google Scholar
Skinner, M., Gouli, S., Frank, C. E., Parker, B. L., and Kim, J. S. (2012). Management of Frankliniella occidentalis (Thysanoptera: Thripidae) with granular formulations of entomopathogenic fungi. Biol. Control 63, 246-252. doi: 10.1016/j.biocontrol.2012.08.004
CrossRef Full Text | Google Scholar
St. Leger, R. J., May, B., Allee, L. L., Frank, D. C., Staples, R. C., and Robers, D. W. (1992). Genetic differences in allozymes and in formation of infection structures among isolates of the entomopathogenic fungus Metarhizium anisopliae. J. Invertebr. 60, 89-101. doi: 10.1016/0022-2011(92)90159-2
CrossRef Full Text | Google Scholar
Storey, G. K., and Gardner, W. A. (1988). Movement of an aqueous spray of Beauveria bassiana into the profile of four Georgia soils. Environ. Entomol. 17, 135-139. doi: 10.1093/ee/17.1.135
CrossRef Full Text | Google Scholar
Studdert, J. P., and Kaya, H. K. (1990). Effect of water potential, temperature, and clay coating on survival of Beauveria bassiana conidia in a loam and peat soil. J. Invertebr. Pathol. 55, 417-427. doi: 10.1016/0022-2011(90)90086-L
CrossRef Full Text | Google Scholar
Sung, G.-H., Hywel-Jones, N. L., Sung, J.-M., Luangsa-ard, J. J., Shrestha, B., and Spatafora, J. W. (2007). Phylogenetic classification of Cordyceps and the clavicipitaceous fungi. Stud. Mycol. 57, 5-59. doi: 10.3114/sim.2007.57.01
PubMed Abstract | CrossRef Full Text | Google Scholar
Takatsuka, J. (2007). Characterization of Beauveria bassiana isolates from Japan using inter-simple-sequence-repeat-anchored polymerase chain reaction (ISSR-PCR) amplification. Appl. Entomol. Zool. 42, 563-571. doi: 10.1303/aez.2007.563
CrossRef Full Text | Google Scholar
Thomas, M. B., and Jenkins, N. E. (1997). Effects of temperature on growth of Metarhizium flavoviride and virulence to the variegated grasshopper, Zonocerus variegatus. Mycol. Res 101, 1469-1474. doi: 10.1017/S0953756297004401
CrossRef Full Text | Google Scholar
Thompson, L. R., Sanders, J. G., McDonald, D., Amir, A., Ladau, J., Locey, K. J., et al. (2017). A communal catalogue reveals Earth’s multiscale microbial diversity. Nature 551, 457-463. doi: 10.1038/nature24621
PubMed Abstract | CrossRef Full Text | Google Scholar
Tigano-Milani, M. S., Gomes, A. C. M. M., and Sobral, B. W. S. (1995). Genetic variability among Brazilian isolates of the entomopathogenic fungus Metarhizium anisopliae. J. Invertebr. 65, 206-210. doi: 10.1006/jipa.1995.1031
CrossRef Full Text | Google Scholar
Vänninen, I., Tyni-Juslin, J., and Hokkanen, H. (2000). Persistence of augmented Metarhizium anisopliae and Beauveria bassiana in Finnish agricultural soils. Biocontrol 45, 201-222. doi: 10.1023/A:1009998919531
CrossRef Full Text | Google Scholar
Vega, F. E. (2008). Insect pathology and fungal endophytes. J. Invertebr. Pathol. 98, 277-279. doi: 10.1016/j.jip.2008.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Vega, F. E., Goettel, M. S., Blackwell, M., Chandler, D., Jackson, M. A., Keller, S., et al. (2009). Fungal entomopathogens: new insights on their ecology. Fungal Ecol. 2, 149-159. doi: 10.1016/j.funeco.2009.05.001
CrossRef Full Text | Google Scholar
Vega, F. E., Meyling, N. V., Luangsa-ard, J. J., and Blackwell, M. (2012). „Fungal entomopathogens,” in Insect Pathology, eds F. E. Vega and H. K. Kaya (Cambridge, MA: Academic Press), 171-220. doi: 10.1016/B978-0-12-384984-7.00006-3
CrossRef Full Text | Google Scholar
Vidal, C., Fargues, J., and Lacey, L. A. (1997). Intraspecific variability of Paecilomyces fumosoroseus: effect of temperature on vegetative growth. J. Invertebr. 70, 18-26. doi: 10.1006/jipa.1997.4658
CrossRef Full Text | Google Scholar
Wang, M., Tian, J., Xiang, M., and Liu, X. (2017). Living strategy of cold-adapted fungi with the reference to several representative species. Mycology 8, 178-188. doi: 10.1080/21501203.2017.1370429
PubMed Abstract | CrossRef Full Text | Google Scholar
Wielgolaski, F. E., and Inouye, D. W. (2003). „High latitude climates,” in Phenology: An Integrative Environmental Science, ed M. D. Schwartz (Dordrecht: Springer), 175-194. doi: 10.1007/978-94-007-0632-3_12
CrossRef Full Text | Google Scholar
Wraight, S. P., Ugine, T. A., Ramos, M. E., and Sanderson, J. P. (2016). Efficacy of spray applications of entomopathogenic fungi against western flower thrips infesting greenhouse impatiens under variable moisture conditions. Biol. Control 97, 31-47. doi: 10.1016/j.biocontrol.2016.02.016
CrossRef Full Text | Google Scholar
Xiao, G., Ying, S. H., Zheng, P., Wang, Z. L., Zhang, S., Xie, X. Q., et al. (2012). Genomic perspectives on the evolution of fungal entomopathogenicity in Beauveria bassiana. Sci. Rep. 2:483. doi: 10.1038/srep00483
PubMed Abstract | CrossRef Full Text | Google Scholar
Zimmermann, G. (2007). Review on safety of the entomopathogenic fungus Metarhizium anisopliae. Biocontrol Sci. Technol. 17, 879-920. doi: 10.1080/09583150701593963
CrossRef Full Text | Google Scholar
.