Zastawkowe zwężenie aorty (AS) jest najczęstszą chorobą zastawkową w krajach rozwiniętych. Rozpoznanie AS klasycznie potwierdza się za pomocą echokardiografii, która jest standardowym narzędziem do wykrywania i oceny stopnia zaawansowania choroby (1). Niemniej jednak ocena stopnia zaawansowania AS nadal stanowi wyzwanie. Ciężka AS jest zwykle definiowana jako średni gradient >40 mmHg, powierzchnia zastawki aortalnej (AVA) <1 cm2 i szczytowa prędkość strumienia aortalnego >4,0 m/s (2). Często jednak obserwuje się rozbieżności między średnim gradientem a powierzchnią zastawki u jednego pacjenta (3). Rozbieżności te są zrozumiałe u pacjentów z niskim rzutem serca wtórnym do obniżonej frakcji wyrzutowej LV, ale mogą występować również u pacjentów z pozornie zachowaną funkcją LV (4). W codziennej praktyce mogą one potencjalnie prowadzić do niedoszacowania stopnia zwężenia i nasilenia objawów, a tym samym do niewłaściwego opóźnienia zabiegu wymiany zastawki aortalnej (AVR), co z kolei może mieć negatywny wpływ na wynik leczenia pacjenta (5-7). W tym numerze Cardiovascular Diagnosis and Therapy, OZKAN w elegancki sposób zrewidował koncepcję AS o niskim gradiencie u pacjentów z zachowaną funkcją LV (8).
Nowa klasyfikacja stopniowania stenozy aortalnej
Ostatnio kilku autorów doniosło, że pod tym samym określeniem ciężkiej AS (AVA <1 cm2) można zidentyfikować kilka jednostek, które różnią się pod względem szybkości przepływu przezzastawkowego i rozwijających się gradientów ciśnienia (9-11). Pierwszymi, którzy podkreślili znaczenie uwzględnienia relacji zastawka – gradient w obrazie przepływu, była grupa Pibarot i wsp. (5), natomiast Miners i wsp. (3) jako pierwsi wyraźnie wykazali niespójność w ocenie ciężkości ZZSK i zaproponowali wraz z Dumesnil i wsp. (6) nową klasyfikację ZZSK. U pacjentów z AVA <1 cm2 można wyróżnić cztery kategorie AS o gradiencie przepływu: normalny przepływ/niski gradient (NF/LG), normalny przepływ/wysoki gradient (NF/HG), niski przepływ/wysoki gradient (LF/HG) oraz niski przepływ/niski gradient (LF/LG). LF definiuje się jako indeksowaną objętość wyrzutową LV <35 mL/m2 , a LG jako średni gradient ciśnienia przezaortalnego <40 mmHg (12).
Normal flow-low gradient
Ten schemat obserwuje się u 31-38% pacjentów i wydaje się on identyfikować grupę pacjentów z mniejszym nasileniem ZZSK – wewnętrzna niespójność zawarta w wytycznych – lub u których choroba była eksponowana przez krótszy czas. Jednostka ta charakteryzuje się zachowaną funkcją podłużną mięśnia sercowego LV, co skutkuje niższym poziomem BNP i wskaźnikiem ryzyka Monina (12,13). Rokowanie u tych pacjentów wydaje się być względnie zachowane w porównaniu z pozostałymi kategoriami.
Normal flow-high gradient
Ten wzorzec stanowi najczęstszą jednostkę (39-72%) i jest w pełni zgodny z kryteriami zaproponowanymi przez wytyczne (4,5,12). W porównaniu z grupą NF/LG, mimo że funkcja podłużna LV jest zachowana, stężenie BNP jest wyższe, a przeżycie wolne od zdarzeń sercowych w grupie NF/HG jest zmniejszone. Ponadto pacjenci z NF/HG wydają się mieć bardziej nasiloną AS, co sugeruje dłuższą ekspozycję na tę postępującą chorobę. W przypadku objawów pacjenci ci są zwykle kierowani do AVR, natomiast w przypadku bezobjawowym postępowanie u tych pacjentów podkreśla potrzebę optymalnej stratyfikacji ryzyka.
Niski przepływ-wysoki gradient
Ten wzorzec stanowi 8% pacjentów z ciężką AS (4,12). Charakteryzuje się indeksowaną objętością wyrzutową LV <35 mL/m2 pomimo zachowanej frakcji wyrzutowej LV, wysokim poziomem BNP i wskaźnikiem ryzyka Monina oraz znacznym ograniczeniem funkcji podłużnej LV (14). Należy pamiętać, że frakcja wyrzutowa LV jest przybliżoną oceną funkcji skurczowej LV. Na frakcję wyrzutową LV ma wpływ zarówno wewnętrzna funkcja mięśnia sercowego, jak i geometria jamy LV. W związku z tym przy podobnym stopniu skrócenia miokardium frakcja wyrzutowa LV będzie miała tendencję do zwiększania się w zależności od stopnia koncentrycznej przebudowy LV. Frakcja wyrzutowa LV może zatem znacznie niedoszacować stopnia upośledzenia funkcji mięśnia sercowego w obecności koncentrycznej przebudowy LV, co na ogół ma miejsce u pacjentów z AS. Dlatego to, co jest prawidłowe dla LV o prawidłowej geometrii, może być nieprawidłowe dla LV z koncentrycznym remodelingiem. Co więcej, zmniejszenie rzutu LV (związane z wewnętrzną dysfunkcją mięśnia sercowego i istotną przebudową LV) może z kolei powodować niższe niż oczekiwane gradienty przezzastawkowe. Rokowanie u tych chorych jest niemal identyczne jak u pacjentów z NF/HG. W przypadku objawów chorzy ci mają lepsze przeżycie, jeśli są leczeni chirurgicznie.
Niski przepływ-niski gradient
Powszechność wzorca LF/LG wydaje się być mniejsza niż początkowo podawano. Jednostka ta stanowi 7% u chorych bezobjawowych i do 15-35% u chorych objawowych (4-6,12,14). Paradoksalna niskoprzepływowa AS jest trudną jednostką kliniczną, na którą zwraca się ostatnio uwagę. Wiąże się on z wyraźniejszym koncentrycznym remodelingiem LV, mniejszą jamą LV, zwiększonym globalnym obciążeniem następczym LV, wewnętrzną dysfunkcją mięśnia sercowego, włóknieniem mięśnia sercowego i fatalnym rokowaniem (12,15). U bezobjawowych pacjentów wykazaliśmy, że prawdopodobieństwo pozostania przy życiu bez AVR w ciągu 3 lat było 5-krotnie niższe niż w przypadku schematu NF/LG i 4,3-krotnie wyższe niż w grupie NF/HG (12). Ta jednostka kliniczna jest często błędnie diagnozowana, co może prowadzić do niedoceniania stopnia zaawansowania AS, a tym samym do niewykorzystania lub niewłaściwego opóźnienia zabiegu operacyjnego. Ważne jest, aby rozpoznać tę jednostkę, aby nie odmawiać operacji objawowemu pacjentowi z małym AVA i LG.
Niezgodność między gradientem a obszarem zastawki
Potencjalne przyczyny niezgodności między AVA a gradientem u pacjentów z zachowaną frakcją wyrzutową LV obejmują (I) błędy pomiarowe; (II) małe rozmiary ciała; (III) paradoksalnie niskoprzepływową AS; oraz (IV) niespójną klasyfikację związaną z wewnętrznymi rozbieżnościami w kryteriach wytycznych (4,6,7,10,11). Po pierwsze, pacjenci z małymi wymiarami ciała i LV mogą wykazywać mniejszy gradient ciśnienia przezzastawkowego z powodu mniejszej, choć prawidłowej objętości wyrzutowej. Po drugie, objętość wyrzutowa, a tym samym AVA, może być niedoszacowana z powodu niedoszacowania drogi odpływu LV i/lub błędnego umiejscowienia objętości próbki doplera pulsacyjnego. W celu potwierdzenia dopplerowsko-echokardiograficznych pomiarów objętości wyrzutowej i AVA można zastosować kilka metod. Na przykład, przy braku istotnej niedomykalności mitralnej, objętość wyrzutową można łatwo oszacować metodą Simpsona (wolumetryczna metoda pomiaru frakcji wyrzutowej i objętości LV). Jeśli objętość wyrzutowa mierzona tymi niezależnymi metodami jest zgodna z objętością wyrzutową mierzoną w drodze odpływu LV, można być spokojnym o dokładność pomiaru objętości wyrzutowej. Po trzecie, paradoksalna LF/LG stanowi nową jednostkę, w której stan LF wynika zarówno z koncentrycznej przebudowy LV, jak i ze zmniejszonej podwsierdziowej funkcji podłużnej. Nakreśla to brak możliwości błędnej oceny stopnia zaawansowania AS. Po czwarte, w niektórych przypadkach rozbieżności w relacji gradient – pole powierzchni zastawki mogą być związane z niespójnością obowiązujących wytycznych. Ujednolicenie definicji ciężkiej AS może spowodować przeklasyfikowanie niektórych z tych pacjentów z „ciężką” AS do „umiarkowanej” AS. Kiedy połączy się obecne prospektywne dane kliniczne z wcześniejszymi danymi hemodynamicznymi i inwazyjnymi, wydaje się, że gradient 40 mmHg bardziej pasuje do powierzchni zastawki 0,8 cm2 , podczas gdy powierzchnia zastawki 1 cm2 odnosi się do średniego gradientu 26 mmHg (3,6,16). Ponadto, gdy u pacjentów z zachowaną frakcją wyrzutową LV występuje rozbieżność między obszarem zastawki (w zakresie ciężkim) a gradientem (w zakresie umiarkowanym), konieczna może być bardziej kompleksowa echokardiograficzna ocena dopplerowska i potencjalnie inne badania diagnostyczne (BNP, ocena stężenia wapnia w wielorzędowej tomografii komputerowej, wysiłkowa/dobutaminowa echokardiografia obciążeniowa), aby potwierdzić stopień zaawansowania choroby i ukierunkować postępowanie terapeutyczne.
Implikacje kliniczne i postępowanie
W codziennej praktyce ocena ciężkości AS powinna uwzględniać wzorzec gradientu przepływu do klasycznego pomiaru AVA. Ogólną zasadą jest, że niski gradient przezzastawkowy (<40 mmHg) lub prędkość (<4 m/s) nie wykluczają obecności ciężkiej AS u pacjentów z małym AVA i zachowaną frakcją wyrzutową LV. Ponadto, zachowana frakcja wyrzutowa LV (>50%) nie wyklucza obecności dysfunkcji skurczowej mięśnia sercowego i niskiego przepływu przezzastawkowego w AS. U pacjentów z NF/LG AS klasycznie nie stwierdza się dysfunkcji podwsierdziowej lub jest ona minimalna, a wyniki leczenia są względnie dobre. W tej kategorii NF/LG wskazania do AVR powinny być ograniczone do pacjentów, u których objawy można jednoznacznie przypisać AS. W kategorii NF/HG AVR (chirurgiczna lub przezskórna) jest jedyną metodą leczenia, która znacząco poprawia przeżycie i objawy. W przypadku pacjentów bezobjawowych indywidualna stratyfikacja ryzyka może pomóc w identyfikacji pacjentów, którzy mogą odnieść korzyści z wczesnej operacji. W pozostałych kategoriach stan LF jest świadectwem wewnętrznej dysfunkcji mięśnia sercowego i bardziej zaawansowanego procesu chorobowego. Objawowi pacjenci z LF/HG również powinni odnieść korzyści z szybkiego AVR. W przypadku pacjentów bezobjawowych należy również zachęcać do indywidualnej stratyfikacji ryzyka. Echokardiografia wysiłkowa może być interesująca, ponieważ ujawnia pacjentów z ograniczoną podatnością zastawek i/lub wyczerpaną rezerwą kurczliwości LV (17,18). Paradoksalna LF/LG wiąże się z gorszym rokowaniem nawet u bezobjawowych pacjentów. W tej kategorii chorych, choć korzyść z operacji nie jest udowodniona, AVR może być prawdopodobnie korzystna u wybranych chorych objawowych (7,19,20) (tab. 1). W praktyce klinicznej ustalenie tej jednostki stanowi wyzwanie. Przed rozważeniem zabiegu operacyjnego należy dopasować objawy do stopnia zaawansowania AS. U pacjentów z niskim ryzykiem można zalecić AVR. U pacjentów wysokiego ryzyka potrzebne są dodatkowe badania wyników w celu określenia najbardziej odpowiedniej metody i czasu leczenia.
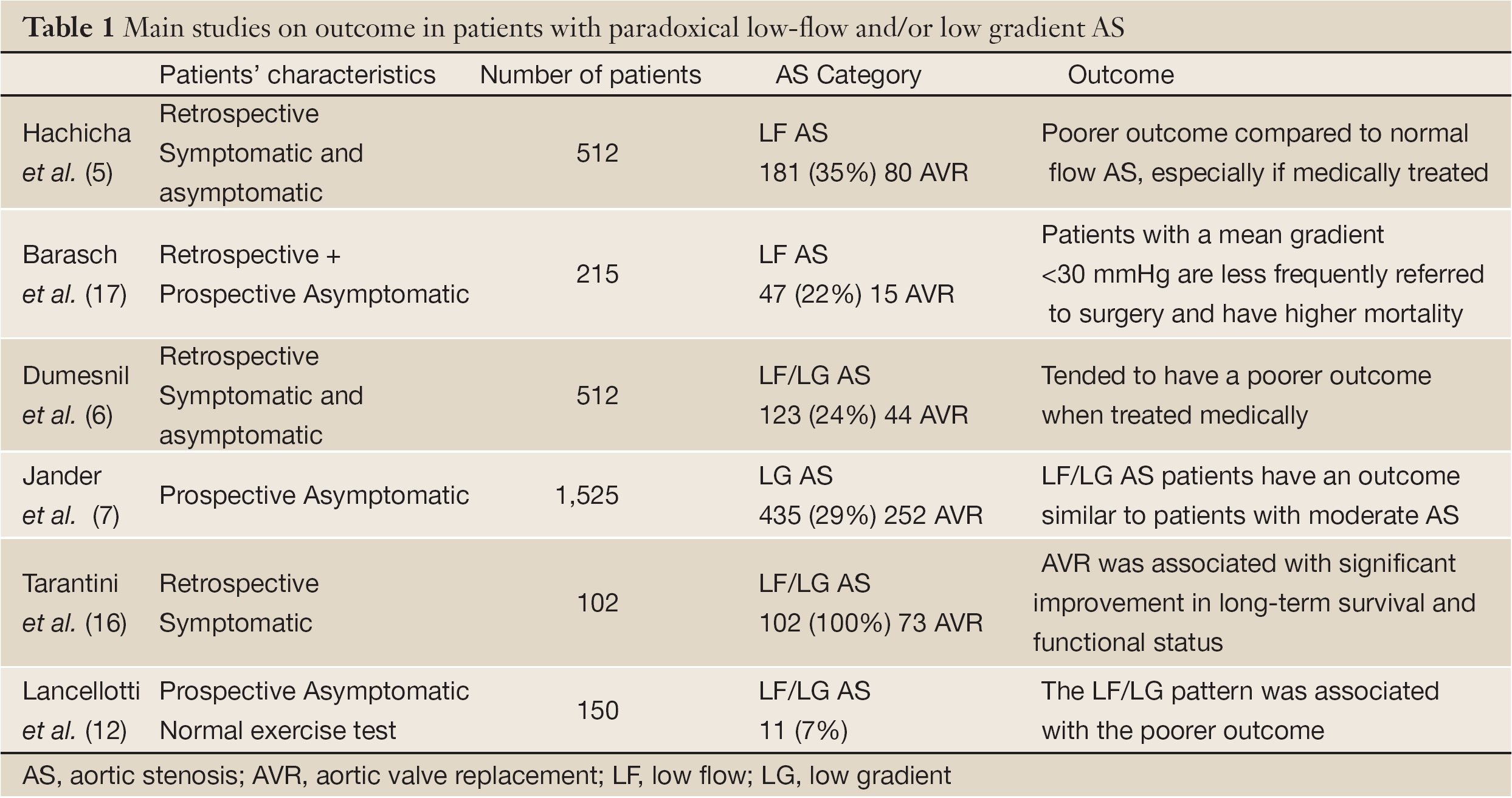
Pełna tabela
Podziękowania
Ujawnienie informacji: Autorzy nie zgłaszają konfliktu interesów.
- Lancellotti P, Donal E, Magne J, et al. Risk stratification in asymptomatic moderate to severe aortic stenosis: the importance of the valvular, arterial and ventricular interplay. Heart 2010;96:1364-71.
- Bonow RO, Carabello BA, Kanu C, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease): developed in collaboration with the Society of Cardiovascular Anesthesiologists: endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons. Circulation 2006;114:e84-231.
- Minners J, Allgeier M, Gohlke-Baerwolf C, et al. Inconsistent grading of aortic valve stenosis by current guidelines: haemodynamic studies in patients with apparently normal left ventricular function. Heart 2010;96:1463-8.
- Adda J, Mielot C, Giorgi R, et al. Low-Flow, Low-Gradient Severe Aortic Stenosis Despite Normal Ejection Fraction Is Associated With Severe Left Ventricular Dysfunction as Assessed by Speckle-Tracking Echocardiography: A Multicenter Study. Circ Cardiovasc Imaging 2012;5:27-35.
- Hachicha Z, Dumesnil JG, Bogaty P, et al. Paradoxical low-flow, low-gradient severe aortic stenosis despite preserved ejection fraction is associated with higher afterload and reduced survival. Circulation 2007;115:2856-64.
- Dumesnil JG, Pibarot P, Carabello B. Paradoxical low flow and/or low gradient severe aortic stenosis despite preserved left ventricular ejection fraction: implications for diagnosis and treatment. Eur Heart J 2010;31:281-9.
- Jander N, Minners J, Holme I, et al. Outcome of patients with low-gradient „severe” aortic stenosis and preserved ejection fraction. Circulation 2011;123:887-95.
- Ozkan A. Low gradient „severe” aortic stenosis with preserved left ventricular ejection fraction. Cardiovasc Diagn Ther 2012;2:19-27.
- Dumesnil JG, Pibarot P, Akins C. New approaches to quantifying aortic stenosis severity. Curr Cardiol Rep 2008;10:91-7.
- Pibarot P, Dumesnil JG. Assessment of aortic stenosis severity: when the gradient does not fit with the valve area. Heart 2010;96:1431-3.
- Lancellotti P, Magne J. Valvuloarterial impedance in aortic stenosis: look at the load, but do not forget the flow. Eur J Echocardiogr 2011;12:354-7.
- Lancellotti P, Magne J, Donal E, et al. Clinical outcome in asymptomatic severe aortic stenosis insights from the new proposed aortic stenosis grading classification. J Am Coll Cardiol 2012;59:235-43.
- Monin JL, Lancellotti P, Monchi M, et al. Risk score for predicting outcome in patients with asymptomatic aortic stenosis. Circulation 2009;120:69-75.
- Lancellotti P, Donal E, Magne J, et al. Impact of global left ventricular afterload on left ventricular function in asymptomatic severe aortic stenosis: a two-dimensional speckle-tracking study. Eur J Echocardiogr 2010;11:537-43.
- Herrmann S, Störk S, Niemann M, et al. Low-gradient aortic valve stenosis myocardial fibrosis and its influence on function and outcome. J Am Coll Cardiol 2011;58:402-12.
- Zoghbi WA. Low-gradient „severe” aortic stenosis with normal systolic function: time to refine the guidelines? Circulation 2011;123:838-40.
- Lancellotti P, Lebois F, Simon M, et al. Prognostic importance of quantitative exercise Doppler echocardiography in asymptomatic valvular aortic stenosis. Circulation 2005;112:I377-82.
- Maréchaux S, Hachicha Z, Bellouin A, et al. Usefulness of exercise-stress echocardiography for risk stratification of true asymptomatic patients with aortic valve stenosis. Eur Heart J 2010;31:1390-7.
- Tarantini G, Covolo E, Razzolini R, et al. Valve replacement for severe aortic stenosis with low transvalvular gradient and left ventricular ejection fraction exceeding 0.50. Ann Thorac Surg 2011;91:1808-15.
- Barasch E, Fan D, Chukwu EO, et al. Severe isolated aortic stenosis with normal left ventricular systolic function and low transvalvular gradients: pathophysiologic and prognostic insights. J Heart Valve Dis 2008;17:81-8.
.