Wprowadzenie
Według Światowej Organizacji Zdrowia nowotwory są drugą wiodącą przyczyną zgonów na świecie.1 Znaczne i ciągłe postępy w leczeniu zwiększyły przeżywalność pacjentów z nowotworami, ale niekorzystne działania chemioterapii, szczególnie na serce, są istotną przyczyną śmiertelności i zachorowalności. Śmiertelność wśród chorych na nowotwory, u których rozwinie się kardiomiopatia wywołana antracyklinami, jest duża (ponad 60% po dwóch latach),2 ale rokowanie można poprawić poprzez wczesne wykrywanie i zapobieganie.
Antracykliny, takie jak doksorubicyna, daunorubicyna, epirubicyna, mitoksantron i idarubicyna, są najczęściej stosowanymi lekami w chemioterapii nowotworów. Są one znaną przyczyną kardiotoksyczności (tab. 1), z ostrymi lub/i podostrymi skutkami, które mogą objawiać się zmianami elektrokardiograficznymi, komorowymi i nadkomorowymi zaburzeniami rytmu, zaburzeniami przewodzenia w sercu (blok przedsionkowo-komorowy lub blok odnogi), zaburzenia czynności komór, zwiększenie stężenia peptydu natriuretycznego typu mózgowego (BNP, marker zwiększonego obciążenia wstępnego i niewydolności serca), zapalenie mięśnia sercowego i zapalenie osierdzia, które mogą wystąpić w dowolnym czasie od rozpoczęcia leczenia do dwóch tygodni po zakończeniu leczenia. Działania te są stosunkowo rzadkie i większość z nich ustępuje w ciągu tygodnia po zaprzestaniu leczenia. Przewlekła kardiomiopatia jest definiowana jako wczesna, jeśli rozpoczyna się w ciągu roku od zakończenia chemioterapii i późna po tym okresie. W obu przypadkach obserwuje się dysfunkcję skurczową lub rozkurczową (tab. 2), która może postępować do ciężkiej kardiomiopatii, a nawet prowadzić do zgonu.3 Chociaż niektóre badania sugerują, że ryzyko rozwoju dysfunkcji komór i jej nasilenie można przewidzieć na podstawie ostrego uszkodzenia mięśnia sercowego,4 związek między ostrą i przewlekłą toksycznością nie jest w pełni zrozumiały. Diagnostyka dysfunkcji serca wywołanej terapią przeciwnowotworową była przedmiotem różnych badań,3,5 z których jedno5 jest uważane za publikację referencyjną na ten temat i opiera się na objawach HF, badaniu fizykalnym i parametrach funkcji lewej komory.
Kardiotoksyczność, farmakokinetyka i zastosowanie terapeutyczne antracyklin.
| Mechanizmy działania | Mechanizmy kardiotoksyczności | Antracykliny | Stosowanie terapeutyczne | Kardiotoksyczność |
|---|---|---|---|---|
| Tworzenie kompleksu DNA przez koniugację płaskich pierścieni z nukleotydami hamuje syntezę DNA i RNA oraz białek. Wywołuje to rozszczepienie DNA przez topoizomerazę II, powodując cytotoksyczność. Antracykliny hamują helikazę, zapobiegając enzymatycznemu rozszczepieniu podwójnej nici DNA, a tym samym zaburzają replikację i transkrypcję. Wywołują reakcje redoks poprzez tworzenie cytotoksycznych wolnych rodników. |
Główne mechanizmy: – uszkodzenie DNA wywołane przez topoizomerazę II beta – peroksydacja lipidów – stres oksydacyjny – apoptoza i martwica komórek serca Zaburzenia syntezy DNA, RNA i białek oraz czynników transkrypcyjnych biorących udział w regulacji genów specyficznych dla serca. Negatywna równowaga białek sarkomerycznych w komórkach mięśnia sercowego spowodowana zmniejszoną ekspresją białek i zwiększoną degradacją miofilamentów. Terapia skojarzona nasila utratę miofilamentów. Uszkodzenie mitochondrialnego DNA i zmiany w bioenergetyce mitochondrialnej. Zaburzenia dynamicznej regulacji czynności serca, zmieniające aktywność cyklazy adrenergicznej i adenylowej oraz homeostazę wapnia. |
Doksorubicyna | Zaawansowany rak żołądka Rak pęcherza moczowego Rak piersi Rak jajnika Drobnokomórkowy rak płuca Rak tarczycy Choroba Hodgkina Ostra białaczka Chłoniak nie-…Hodgkin lymphoma Neuroblastoma Sarcoma Wilms tumor |
Acute: Nadciśnienie tętnicze Arytmie Tachykardia Tromboembolizm Podostre: Zapalenie osierdzia Zapalenie mięśnia sercowego Przewlekłe: Kardiomiopatia rozstrzeniowa Dysfunkcja skurczowa Zwężona niewydolność serca |
| Daunorubicyna | Ostra białaczka limfoblastyczna Ostra białaczka szpikowa |
Ostre: Tachykardia zatokowa Tachyarytmie Występowanie ekstrasystolii komorowych BlokAV Przewlekłe: Kardiomiopatia rozstrzeniowa Dysfunkcja skurczowa Zwężona niewydolność serca |
||
| Epirubicyna | Zaawansowany rak jajnika Rak żołądka Rak piersi Rak płuca |
Ostre: Tachykardia komorowa BlokAV Blok odnogi pęczka Hisa Bradykardia Tromboembolizm Przewlekłe: Kardiomiopatia rozstrzeniowa Dysfunkcja skurczowa Zwężona niewydolność serca |
||
| Idarubicyna | Ostra białaczka limfocytowa Ostra białaczka szpikowa |
Ostre: Arytmie Migotanie przedsionków Zawał serca Zawał serca Tromboembolizm Przewlekłe: Kardiomiopatia rozstrzeniowa Zaburzenia kurczliwości Zawałowa niewydolność serca |
||
| Mitoksantron | Zaawansowany rak piersi Ostra białaczka szpikowa u dorosłych Chłoniak nieziarniczy |
Ostre: Arytmie Zapalenie mięśnia sercowego Nadciśnienie tętnicze Niedokrwienie mięśnia sercowego Przewlekłe: Kardiomiopatia rozstrzeniowa Zaburzenia kurczliwości Zawieszona niewydolność serca |
AV: atrioventricular.
Adaptacja z 24,58,59.
Kryteria potwierdzenia lub rewizji wstępnego rozpoznania dysfunkcji serca wywołanej chemioterapią, według Cardiac Review and Evaluation Committee.
Każde z kryteriów jest wystarczające do potwierdzenia rozpoznania dysfunkcji serca.
Kardiomiopatia charakteryzująca się zmniejszeniem LVEF serca o charakterze globalnym lub bardziej nasilonym w przegrodzie międzykomorowej
Objawy CHF
Wykrywanie galopu S3, tachykardii lub obu tych objawów;
Zmniejszenie LVEF o co najmniej 5% do mniej niż 55% z towarzyszącymi oznakami lub objawami CHF, lub zmniejszenie LVEF o co najmniej 10% do poniżej 55% bez towarzyszących oznak lub objawów.
CHF: zastoinowa niewydolność serca; LVEF: frakcja wyrzutowa lewej komory.
Adaptacja z 3,60.
Jedna z proponowanych klasyfikacji dzieli kardiomiopatię wywołaną chemioterapią na dwa typy: typ I, spowodowany antracyklinami, które wywołują nieodwracalne, zależne od dawki uszkodzenie serca; oraz typ II, spowodowany trastuzumabem, który nie jest związany z dawką kumulacyjną i często jest odwracalny po przerwaniu leczenia.6. Drugi typ nie będzie omawiany w tym artykule przeglądowym.
W niniejszym przeglądzie autorzy omawiają strategie stosowane u chorych leczonych antracyklinami w celu zapobiegania lub łagodzenia ich głównych działań niepożądanych na serce.
Ocena wstępna
W związku z kardiotoksycznością antracyklin wszyscy chorzy kierowani do chemioterapii powinni być poddani ocenie kardiologicznej w celu ustalenia wyjściowej charakterystyki układu sercowo-naczyniowego, którą można następnie wykorzystać podczas schematu leczenia w celach porównawczych. Ocena ta powinna obejmować wywiad kliniczny i badanie przedmiotowe, elektrokardiografię w celu określenia rytmu serca i wykrycia objawów niedokrwienia oraz badania obrazowe serca, zwykle echokardiografię przezklatkową z pełnym badaniem dopplerowskim (tabele 3 i 4). Gdy echokardiogram nie dostarcza wystarczających informacji, zaleca się wykonanie rezonansu magnetycznego serca (cardiac magnetic resonance imaging – CMRI). Należy również oznaczyć wyjściowe stężenie troponin w celu przyszłych porównań.5
Zalecany protokół echokardiogramu w kardio-onkologii.
Standardowa echokardiografia przezklatkowa
– Zgodnie z wytycznymi ASE/EAE i IAC-Echo
Akwizycja obrazowania odkształceń 2D
– koniuszkowe 3-, 4-, i 2-widoki komorowe
– Akwizycja ≥3 cykli pracy serca
– Obrazy uzyskane jednocześnie przy zachowaniu tej samej częstotliwości odświeżania 2D i głębokości obrazowania
Częstotliwość odświeżania między 40 a 90 klatek/s lub ≥40% HR
– Aortalna VTI (czas wyrzutu aorty) Czas wyrzutu
Analiza obrazowania odkształcenia 2D
– Kwantyfikacja segmentalnego i globalnego odkształcenia podłużnego
– Wyświetlanie krzywych odkształcenia segmentalnego z widoków koniuszkowych w formacie quad
– Wyświetlanie globalnego odkształcenia w postaci wykresu
Pułapki obrazowania odkształceń 2D
– Ektopia
– Translacja oddechowa
Akwizycja obrazowania 3D
– Apikalna 4-komorowa pełna objętość do oceny objętości LVkomorowa objętość pełna do oceny objętości LV i obliczenia LVEF
– Pojedyncze i wielokrotne uderzenia optymalizujące rozdzielczość przestrzenną i czasową
Raportowanie
– Czas wykonania echokardiografii w odniesieniu do wlewu dożylnego (liczba dni przed lub po)
– Parametry życiowe (BP, HR)
– 3D LVEF/2D dwupłaszczyznowa metoda Simpsona
– GLS (użyty aparat echokardiograficzny, oprogramowanie i wersja)
– W przypadku braku GLS pomiar przyśrodkowej i bocznej s′ i MAPSE
– RV: TAPSE
Adaptacja z 5.
2D: dwuwymiarowy; 3D: trójwymiarowy; ASE/EAE: American Society of Echocardiography/European Association of Echocardiography; BP: ciśnienie krwi; GLS: globalne odkształcenie podłużne; HR: częstość akcji serca; IAC-Echo: Intersocietal Accreditation Commission Echocardiography; IV: dożylnie; LV: lewa komora; LVEF: frakcja wyrzutowa lewej komory; MAPSE: skurczowe wychylenie płaszczyzny pierścienia mitralnego; RV: prawa komora; TAPSE: skurczowe wychylenie płaszczyzny pierścienia trójdzielnego; VTI: całka prędkości w czasie.
Echokardiograficzna ocena funkcji skurczowej i rozkurczowej u pacjenta z chorobą nowotworową.
Funkcja skurczowa LV
– Echokardiografia jest metodą z wyboru w ocenie pacjentów przed, w trakcie i po terapii przeciwnowotworowej.
– Dokładne wyliczenie LVEF powinno być wykonane najlepszą metodą dostępną w pracowni echokardiograficznej (najlepiej 3DE).
– W przypadku stosowania 2DE metodą z wyboru jest zmodyfikowana dwupłaszczyznowa technika Simpsona.
– LVEF powinna być połączona z obliczeniem wskaźnika wall motion score.
– W przypadku braku GLS w badaniu STE zaleca się ilościowe określenie funkcji podłużnej LV za pomocą MAPSE i/lub szczytowej prędkości skurczowej (s′) pierścienia mitralnego za pomocą TDI z falą pulsacyjną.
– LVEF oceniana za pomocą 2DE często nie pozwala wykryć niewielkich zmian w kurczliwości LV.
Funkcja rozkurczowa
– Chociaż nie stwierdzono, aby parametry rozkurczowe miały znaczenie prognostyczne w kardiomiopatii indukowanej antracyklinami, konwencjonalna ocena funkcji rozkurczowej LV, Zgodnie z zaleceniami ASE/EAE dotyczącymi oceny funkcji rozkurczowej LV za pomocą echokardiografii, do oceny funkcji skurczowej LV należy dodać konwencjonalną ocenę funkcji rozkurczowej LV, w tym ocenę stopniowania funkcji rozkurczowej i nieinwazyjną ocenę ciśnienia napełniania LV.
Adaptacja z 5.
2DE: echokardiografia dwuwymiarowa; 3DE: echokardiografia trójwymiarowa; ASE/EAE: American Society of Echocardiography/European Association of Echocardiography; GLS: global longitudinal strain; LV: lewa komora; LVEF: frakcja wyrzutowa lewej komory; STE: speckle-tracking echocardiography; TDI: tissue Doppler imaging.
Monitorowanie podczas terapii
Ważne jest monitorowanie oznak i objawów kardiotoksyczności podczas chemioterapii (Tabela 5). 12-odprowadzeniowy elektrokardiogram może być rutynowo stosowany w badaniach przesiewowych w kierunku arytmii spowodowanych kardiotoksycznością związaną z antracyklinami, natomiast 24-godzinne monitorowanie metodą Holtera lub rejestrator zdarzeń może być przydatny w badaniu etiologii omdleń, co do których istnieje przypuszczenie, że są wynikiem arytmii lub zaawansowanego bloku przedsionkowo-komorowego.7 U pacjentów leczonych antracyklinami należy monitorować czynność serca metodą echokardiograficzną. Globalne odkształcenie podłużne (GLS) oceniane za pomocą dwuwymiarowego śledzenia plamki jest bardziej czułym wskaźnikiem predykcyjnym HF niż frakcja wyrzutowa lewej komory (LVEF),8 ponieważ podczas leczenia antracyklinami zmiany GLS poprzedzają zmniejszenie LVEF.5 Jednak w praktyce klinicznej najczęściej stosowanymi parametrami są frakcja skracania i LVEF,9 chociaż frakcja skracania okazuje się w tym kontekście mniej wiarygodna. Parametry te, zależne od obciążenia wstępnego i następczego, są mniej czułe w przypadku wczesnego wykrywania przedklinicznej choroby serca. W różnych badaniach sugerowano, że ocena funkcji rozkurczowej za pomocą echokardiografii dopplerowskiej może umożliwić wczesne wykrycie kardiomiopatii wywołanej antracyklinami.10,11 Jeśli LVEF wynosi Tabela 6) i/lub stężenie troponin jest podwyższone, należy rozważyć konsultację kardiologiczną, z omówieniem przez kardiologa i onkologa stosunku ryzyka do korzyści chemioterapii.5 Spadek LVEF podczas terapii antracyklinami wiąże się ze zwiększonym ryzykiem zdarzeń sercowych i chociaż zmniejszenie GLS o 15% prawdopodobnie wskazuje na kardiotoksyczność.5 Badanie powinno być powtórzone dwa do trzech tygodni po badaniu wyjściowym w celu potwierdzenia rozpoznania. CMRI może wykryć subtelne zmiany w mięśniu sercowym i wzrost objętości pozakomórkowej, co sugeruje obrzęk lub rozproszone zwłóknienie. Chociaż CMRI charakteryzuje się dużą czułością i powtarzalnością w ocenie funkcji serca i charakterystyce tkanki mięśnia sercowego, jego wadami są ograniczona dostępność i wysoki koszt.12 Angiografia radionuklidowa jest powtarzalna i łatwiej dostępna, ale naraża pacjentów na promieniowanie jonizujące, co zwiększa ich dawkę kumulacyjną, zwłaszcza gdy wymagane są badania seryjne, i dostarcza jedynie ograniczonych informacji na temat funkcji rozkurczowej i morfologii zastawek, dlatego nie powinna być metodą z wyboru.12 Biopsja endomiokardialna charakteryzuje się większą czułością i swoistością w wykrywaniu i monitorowaniu działań niepożądanych antracyklin,5 umożliwiając uwidocznienie utraty miofibryli, wakuolizacji cytoplazmy, poszerzenia siateczki sarkoplazmatycznej, zwiększonej liczby lizosomów i obrzęku mitochondriów.12 Inwazyjny charakter procedury ogranicza jednak jej zastosowanie w praktyce klinicznej. Biomarkery zostały zwalidowane w różnych badaniach; są one specyficzne nie tylko w wykrywaniu uszkodzenia układu sercowo-naczyniowego, ale także w określaniu jego rozległości i odwracalności. Podczas gdy troponiny T i I są wskaźnikami uszkodzenia kardiomiocytów, BNP i N-końcowa część pro-BNP (NT-proBNP) odzwierciedlają zwiększone obciążenie mięśnia sercowego.13,14 Według piśmiennictwa podwyższenie troponin jest wczesnym wskaźnikiem kardiotoksyczności, natomiast BNP jest mniej konsekwentne.
Wady i zalety badań diagnostycznych w ocenie kardiotoksyczności indukowanej antracyklinami.
| Badanie diagnostyczne | Wady | Wady |
|---|---|---|
| Elektrokardiografia | Nieinwazyjna Niski koszt Pomiar odstępu QT, którego wydłużenie jest znanym markerem kardiotoksyczności |
Nie mierzy LVEF Zmienność wewnątrz- i międzyobserwacyjna w pomiarze odstępu QT |
| Echokardiografia doplerowska | Nieinwazyjna Niski koszt Ocena czynnościowego i morfologicznego rozkurczu (płucny przepływ żylny, stosunek E/A, czas relaksacji izowolumetrycznej) i skurczowych (pogrubienie ściany w czasie skurczu, LVEF, frakcja skracania), struktura zastawki i osierdzia |
Zmienność wewnątrz- i międzyobserwacyjnazmienność obserwatorów Pomiar LVEF podlegający zmienności i zależny od jakości obrazu Wątpliwa wartość predykcyjna dla wczesnego wykrywania zmian subklinicznych |
| Doppler tkankowy obrazowanie | Doskonała rozdzielczość czasowa Wczesne wykrywanie zmian subklinicznych (w połączeniu z markerami stanu zapalnego i stresu oksydacyjnego) Funkcjonalna ocena ciśnień napełniania (stosunek E/e′), prędkości, odkształcenia i tempa odkształcania ścian komór w skurczu i rozkurczu Wykrywanie izolowanej dysfunkcji rozkurczowej |
Więcej czasochłonnych analiz |
| 2D strain/speckle tracking i GLS | Przewyższa LVEF w przewidywaniu śmiertelności z przyczyn sercowo-naczyniowych w populacji ogólnej Lepsza stratyfikacja ryzyka u pacjentów z HF Możliwość rozpoznać wczesną dysfunkcję LV u pacjentów poddawanych terapii kardiotoksycznej Reprodukowalne, gdy wykonywane przez doświadczonego operatora |
Ważnie zależne od jakości obrazu echokardiografii 2D Brak długotrwałych badań klinicznych oceniających zdolność dodługotrwałych badań klinicznych oceniających zdolność GLS do przewidywania trwałego spadku LVEF lub objawowej HF |
| Echokardiografia obciążeniowa | Ocena rezerwy kurczliwości mięśnia sercowego | Pół-inwazyjna Kontrowersyjne i ograniczone dane dotyczące wczesnego wykrywania kardiotoksyczności |
| Angiografia radionuklidowa | Wysoka odtwarzalność Niska zmienność wewnątrz- i międzyobserwacyjnaobserwatorów Zatwierdzona do pomiaru LVEF |
Promieniowanie jonizujące Niska rozdzielczość przestrzenna i czasowa Niedoszacowanie objętości komór Niedoszacowanie LVEF w małych komorach (kobiety i dzieci) Nie ocenia funkcji zastawek Mało informacji na temat funkcji rozkurczowej Ograniczona wartość predykcyjna dla wczesnego wykrywania zmian subklinicznych i zmian w LVEF |
| Resonans magnetyczny | Reprodukowalny Brak promieniowania jonizującego Ocena perfuzji i funkcji mięśnia sercowego oraz osierdzia, oraz wykrywanie mas mięśnia sercowego Przydatna u pacjentów ze słabą jakością obrazu echokardiograficznego Złoty standard obliczania objętości LV i LVEF Sekwencje T2: wykrywa segmentalne lub globalne zmiany zawartości wody w mięśniu sercowym wynikające z zapalenia lub uszkodzenia mikronaczyń lub miocytów Sekwencje T1: dostarczają informacji o zmianach i zwłóknieniu mięśnia sercowego; z kontrastem gadolinowym wykrywa zmiany histopatologiczne, w tym wakuolizację wewnątrzkomórkową, umożliwiając przewidywanie późniejszego spadku LVEF Późne wzmocnienie: wykrywanie zwłóknienia mięśnia sercowego związanego ze złym rokowaniem u pacjentów z CAD, kardiomiopatią przerostową i chorobą naciekową |
Wysoki koszt Ograniczona dostępność Wskazane u pacjentów z urządzeniami niekompatybilnymi z rezonansem magnetycznym (rozruszniki serca, Ryzyko nefrotoksyczności kontrastu u pacjentów z niewydolnością nerek (GFR |
| Tomografia komputerowa | Obrazy o wysokiejrozdzielczości Identyfikuje zwapnienie lub pogrubienie osierdzia u pacjentów poddawanych radioterapii lub operacji Wizualizuje i ocenia zwapnienie tętnic wieńcowych |
Promieniowanie jonizujące Dokumentowane zwapnienie tętnic wieńcowych przed leczeniem przeciwnowotworowym nie jest predyktorem ryzyka CV u pacjentów poddawanych chemioterapii antracyklinowej Mało stosowane do wykrywania i monitorowania subklinicznych zmian w czynności serca |
| Scyntygrafia | Non-inwazyjna Ocena czynnościowa i strukturalna |
Promieniowanie jonizujące Limitowana dostępność Niska rozdzielczość czasowa Limitowane dane |
| Biomarkery | Nieinwazyjna Niska zmienność międzyobserwator variability Ocena funkcji CV i potencjalnych oznak uszkodzenia mięśnia sercowego Promising for early detection of myocardial injury |
Nieokreślona wartość predykcyjna |
| Biopsja endomiokardialna | Wykrywa histologiczne dowody uszkodzenia mięśnia sercowego, w tym utratę miofibryli, wakuolizację cytoplazmy, poszerzenie siateczki sarkoplazmatycznej, zwiększona liczba lizosomów i obrzęk mitochondriów | Inwazyjne Interpretacja histologiczna wymaga specjalistycznej wiedzy Brak informacji funkcjonalnych Wyniki ograniczone ilością i jakością próbki biopsyjnej |
| Ocena uszkodzenia śródbłonka | Alternatywne parametry kardiotoksyczności, takie jak cytokiny, cząsteczki adhezyjne i grubość błony środkowej tętnicy szyjnej | Nieokreślona wartość predykcyjna |
| Analiza genetyczna | Minimalnie inwazyjna Ocena indywidualnej podatności na kardiotoksyczność |
Nieokreślona wartość predykcyjna. |
Adaptowane z 5,12,61.
2D: dwuwymiarowe; CAD: choroba wieńcowa; CV: układ sercowo-naczyniowy; EKG: elektrokardiografia; GFR: współczynnik filtracji kłębuszkowej; GLS: globalne odkształcenie podłużne; HF: niewydolność serca; LV: lewa komora; LVEF: frakcja wyrzutowa lewej komory.
Normalne wartości globalnego odkształcenia podłużnego według sprzedawcy skanera, płci i wieku.
| Wiek (lata) | |||||||
|---|---|---|---|---|---|---|---|
| 0-19 | 20-29 | 30-.39 | 40-49 | 50-59 | ≥65 | p | |
| V1 | |||||||
| Ogółem | -22.1±2,4 | -21,2±1,9 | -21,1±2,1 | -21,4±2,0 | -21,0±2,2 | -20,3±1,9 | 0,0218 |
| Mężczyzna | -21,7±3.1 | -20.9±1.9 | -20.6±1.9 | -20.9±1.8 | -21.0±1.9 | -19.7±1.4 | 0.1982 |
| Kobieta | -22.4±1.6 | -22.3±1,6 | -22,8±1,8 | -22,6±2,1 | -23,3±1,9 | -20,9±2,1 | 0,0348 |
| p (mężczyzna vs. kobieta) | 0,4292 | 0.0316 | 0,0178 | 0,0029 | 0,1381 | ||
| V2 | |||||||
| Ogółem | -19.9±2,5 | -19,0±2,1 | -19,5±2,2 | -18,2±2,5 | -17,6±2,5 | -16,7±2,1 | |
| Mężczyzna | -19,4±2,7 | -18.8±2,0 | -19,1±2,3 | -17,9±2,8 | -16,9±2,3 | -15,8±1,4 | 0,0019 |
| Kobieta | -20,5±2,2 | -20.6±2,3 | -20,2±2,0 | -19,3±0,9 | -20,4±1,5 | -17,3±2,3 | 0,0002 |
| p (mężczyzna vs. kobieta) | 0,1349 | 0.0248 | 0,1083 | 0,4316 | 0,0294 | 0,0928 | |
| V3 | |||||||
| Ogółem | -21.4±1,7 | -20,2±2,1 | -20,4±2,3 | -19,4±2,2 | -18,5±2,6 | -17,8±2,8 | |
| Mężczyzna | -21.6±2,0 | -20,2±2,0 | -20,4±2,2 | -19,8±2,3 | -18,7±2,6 | -16,3±3,1 | |
| Kobieta | -21.2±1,5 | -20,2±2,4 | -20,4±2,8 | -18,7±1,8 | -18,3±2,8 | -18,6±2,3 | 0,0141 |
| p (male vs. kobiety) | 0,6076 | 0,9787 | 0,9201 | 0,1415 | 0,7374 | 0,0668 | |
V1: Vivid 7 lub Vivid E9 (GE Healthcare); V2: iE33 (Philips Medical Systems); V3: Artida lub Apilo (Toshiba Medical Systems).
Adaptacja z 62.
Jeśli dawka antracyklin przekracza 240 mg/m2, przed podaniem kolejnych cykli należy powtórzyć ocenę serca (ryc. 1).
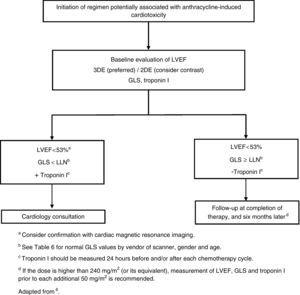
Początek schematu potencjalnie związanego z kardiotoksycznością indukowaną antracyklinami. 2DE: echokardiografia dwuwymiarowa; 3DE: echokardiografia trójwymiarowa; GLS: globalne odkształcenie podłużne; LLN: dolna granica normy; LVEF: frakcja wyrzutowa lewej komory.
Zapobieganie kardiotoksyczności
Zapobieganie kardiotoksyczności indukowanej antracyklinami, przy jednoczesnym zachowaniu skuteczności terapeutycznej leków, można osiągnąć za pomocą środków farmakologicznych i niefarmakologicznych.
Zapobieganie niefarmakologiczne
Czynniki ryzyka sercowo-naczyniowego należy zidentyfikować i odpowiednio leczyć zaraz po rozpoznaniu nowotworu. Pacjentów należy zachęcać do prowadzenia zdrowego stylu życia, w tym stosowania diety o niskiej zawartości tłuszczów nasyconych i maksymalnie 2,5 g sodu dziennie, unikania substancji toksycznych, takich jak alkohol i tytoń, oraz utrzymywania wskaźnika masy ciała na poziomie zbliżonym do 25 kg/m2. Ćwiczenia fizyczne, zarówno o małej, jak i dużej intensywności, podczas leczenia antracyklinami zwiększają rezerwę sercowo-naczyniową15 , a badania na modelach zwierzęcych wskazują, że mogą one zmniejszać kardiotoksyczne działanie tych leków.16 Chociaż ćwiczenia fizyczne okazały się obiecujące w poprawie czynności układu krążenia u chorych, którzy przeżyli raka piersi,17,18 nie przeprowadzono jeszcze badań klinicznych u ludzi, które potwierdzałyby ich kardioprotekcyjną rolę. Innym środkiem jest ograniczenie lub unikanie stosowania leków wydłużających odstęp QT, zwłaszcza antagonistów 5-hydroksytryptaminy 3 (często stosowanych w celu zapobiegania niepożądanym skutkom chemioterapii, w tym nudnościom i wymiotom) oraz leków przeciwhistaminowych.19,20 Ważne jest również minimalizowanie ekspozycji na promieniowanie, korygowanie zaburzeń elektrolitowych i leczenie chorób współistniejących (tab. 7).21
Czynniki ryzyka kardiotoksyczności indukowanej antracyklinami.
| Dawki skumulowane przekraczające: | Zalecane maksymalne (mg/m2)a: | |
| Doksorubicyna | 400-550 | |
| Daunorubicyna | 550-800 | |
| Epirubicyna | 900-.1000 | |
| Idarubicyna | 150-225 | |
| Mitoksantron | 100-.140 | |
| Przed wystąpieniemIstniejąca choroba układu krążenia | Cukrzyca | |
| Choroba wieńcowa | ||
| Przewlekła choroba naczyń obwodowych | ||
| Nadciśnienie tętnicze | ||
| Predyspozycje genetyczne: płeć żeńska, rasa czarna | ||
| Poprzednie lub jednoczesne napromienianie śródpiersia | ||
| Podawanie dożylne w bolusie | ||
| Kombinacja z innymi lekami, w tym cyklofosfamidem, trastuzumab lub paklitaksel | ||
| Długość czasu od zakończenia chemioterapii | ||
| Zaburzenia elektrolitowe: hipokalcemia, hipomagnezemia | ||
| Hemochromatoza (mutacja C282Y) | ||
| Hypertermia | ||
| Choroba wątroby | ||
CV: układ sercowo-naczyniowy.
Pacjenci w wieku powyżej 65 lat i dzieci mogą rozwinąć kardiotoksyczność przy niższych dawkach skumulowanych.
Adaptacja z 12,24.
Zmniejszenie dawki antracyklin jest innym sposobem zmniejszenia częstości występowania dysfunkcji skurczowej lewej komory (LVSD), jak wykazano w badaniu z udziałem pacjentów przyjmujących doksorubicynę w dawce 400, 500 lub 550 mg/m2 , w którym częstość występowania zastoinowej HF wynosiła odpowiednio 5%, 16% i 26%.22. Chociaż antracykliny wydają się być kardiotoksyczne niezależnie od podawanej dawki, w kilku badaniach wykazano, że ciągły wlew mniejszych dawek przez 24-92 godziny23 może zmniejszyć nasilenie uszkodzenia serca i został opisany jako skuteczny sposób postępowania.24 Wydłużenie czasu wlewu zmniejsza kardiotoksyczność bez zmniejszenia skuteczności chemioterapii,25 ale wlew trwający dłużej niż 96 godzin wiąże się z dużą częstością występowania zapalenia jamy ustnej. Jedyny przypadek, w którym ciągły wlew doksorubicyny wydaje się nie mieć działania kardioprotekcyjnego w porównaniu z szybkim wlewem, dotyczy dzieci z ostrą białaczką limfoblastyczną (acute lymphoblastic leukemia, ALL).26 W innych badaniach klinicznych z zastosowaniem biopsji endomiokardialnej do oceny uszkodzenia serca wywołanego przez antracykliny w różnych schematach leczenia stwierdzono, że ciągła perfuzja prowadzi do znacznie mniej istotnych uszkodzeń niż szybkie podanie dożylne.27 W badaniach tych wykazano również, że chorzy otrzymujący wlew ciągły lepiej tolerowali większe dawki kumulacyjne doksorubicyny. Chociaż w badaniach na zwierzętach wykazano, że stężenia antracyklin w tkance nowotworowej były takie same, niezależnie od tego, jak podawano leki (infuzja ciągła czy szybka), nie dotyczyło to tkanki mięśnia sercowego, w której szybka infuzja prowadziła do wyższych stężeń i tym samym większej toksyczności.28
Prewencja farmakologicznaAntyoksydanty
Ale antyoksydanty neutralizują wolne rodniki powstające w wyniku terapii antracyklinami i w ten sposób teoretycznie zmniejszają lub zapobiegają kardiotoksyczności, badania kliniczne N-acetylocysteiny, koenzymu Q, L-karnityny, fenetylamin, amifostyny oraz połączenia witamin E i C oraz N-acetylocysteiny nie wykazały działania kardioprotekcyjnego.29 Wykazano, że erytropoetyna i iloprost30 chronią przed kardiotoksycznym działaniem doksorubicyny in vitro, nie wpływając na jej skuteczność przeciwnowotworową, ale ich zdolność kardioprotekcyjna będzie musiała być wykazana in vivo.
Preparaty liposomalne
Jednym ze sposobów zwalczania niekorzystnego działania kardiologicznego antracyklin jest zmiana formulacji leków, np. enkapsulacja w liposomach.31 W badaniach porównujących doksorubicynę w postaci niekapsułkowanej i zamkniętej w liposomach nie stwierdzono różnicy w odsetku odpowiedzi na leczenie przeciwnowotworowe, przeżyciu całkowitym lub przeżyciu wolnym od progresji choroby, ale częstość występowania HF i LVSD była mniejsza u chorych leczonych preparatem liposomalnym, a w grupie tej obserwowano również mniejszą częstość występowania innych działań niepożądanych, w tym neutropenii, nudności, wymiotów i biegunki.32 Ze względu na wysokie koszty preparaty te nie są szeroko stosowane, a amerykańska Agencja Żywności i Leków (FDA) zatwierdziła ich stosowanie jedynie w przypadku raka jajnika, mięsaka Kaposiego związanego z AIDS oraz u chorych na szpiczaka mnogiego, u których nie uzyskano odpowiedzi na trwające rok leczenie innymi lekami.33
Deksrazoksan
Podawanie deksrazoksanu jednocześnie ze schematami przeciwnowotworowymi może mieć działanie kardioprotekcyjne, zapobiegając podwyższeniu stężenia troponin i zmniejszając częstość występowania HF.34 Niektórzy autorzy przypisują kardioprotekcyjne działanie tego chelatora żelaza zmniejszeniu ilości żelaza wewnątrzkomórkowego, co może zmniejszać generowanie wolnych rodników indukowane doksorubicyną.34 W badaniach nad innymi chelatorami żelaza nie wykazano jednak działania kardioprotekcyjnego.35,36 Sugeruje się również, że działanie kardioprotekcyjne deksrazoksanu wynika nie tylko z antagonizowania przez niego tworzenia kompleksu rozszczepiającego topoizomerazę II, ale również z indukcji szybkiej degradacji topoizomerazy II beta, co sugeruje, że enzym ten jest zaangażowany w kardiotoksyczność indukowaną antracyklinami.37 W badaniu dotyczącym stosowania deksrazoksanu u ponad 200 dzieci z ALL wykazano, że zmniejszał on podwyższenie stężenia troponiny T u obu płci,38 a także ograniczał zmniejszenie frakcji skracania i utrzymywał stosunek grubości do wymiaru lewej komory w ciągu 5 lat, ale tylko u dziewczynek.39 Ostatnio opisano trzy przypadki osób dorosłych poddanych chemioterapii skojarzonej z deksrazoksanem z powodu raka piersi, u których rozwinęła się ostra białaczka szpikowa. Jednak dwa badania porównujące deksrazoksan z placebo u dzieci z ALL, u których obserwowano przez 5 i 10 lat, nie wykazały różnicy w częstości występowania wtórnych nowotworów złośliwych.40,41 Niemniej jednak, ze względu na znane działania niepożądane, FDA i Europejska Agencja Leków ograniczyły stosowanie deksrazoksanu do dorosłych pacjentów z zaawansowanym lub przerzutowym rakiem piersi, którzy otrzymali już skumulowaną dawkę doksorubicyny przekraczającą 300 mg/m2 i którzy odniosą korzyści z dodatkowego leczenia antracyklinami.42
Beta-blokery
Ochrona serca zapewniana przez beta-blokery (BB) wydaje się wynikać z ich właściwości antyoksydacyjnych i antyapoptotycznych. Jeden z BB, karwedilol, okazał się szczególnie obiecujący w zmniejszaniu częstości występowania kardiomiopatii wywołanej antracyklinami oraz w zachowaniu funkcji skurczowej i rozkurczowej.43 U dzieci karwedilol ograniczał podwyższenie stężenia troponiny I i poprawiał zarówno frakcję skracania, jak i szczytowe globalne napięcie skurczowe.44 Według niektórych badań BB i inhibitory konwertazy angiotensyny (ACE) (patrz niżej) mogą zapobiegać przebudowie związanej z HF poprzez zmniejszenie odpowiedzi adrenergicznej.45,46 Nie stwierdzono natomiast działania kardioprotekcyjnego w przypadku stosowania metoprololu lub enalaprilu.47
Inhibitory konwertazy angiotensyny i blokery receptora angiotensyny
Inhibitory konwertazy angiotensyny i blokery receptora angiotensyny (ARB) wykazują właściwości kardioprotekcyjne, prawdopodobnie poprzez zmniejszenie stresu oksydacyjnego, przebudowy lewej komory i apoptozy.48 Podawany przez co najmniej 2 lata po zaprzestaniu chemioterapii u dzieci z LVSD wywołaną antracyklinami enalapril nie przyniósł korzyści pod względem zmniejszenia naprężenia końcowoskurczowego ściany lewej komory ani zachowania frakcji skracania.49 Natomiast u dorosłych leczonych dużymi dawkami antracyklin enalapril zapobiegał HF i pogorszeniu parametrów czynności serca, takich jak LVEF.50 Badania na myszach pozbawionych receptora angiotensyny II typu I wykazały, że doksorubicyna nie wywierała u tych zwierząt działania kardiotoksycznego, a podawanie ARBs może zapobiegać kardiomiopatii wywołanej przez daunorobucin.48 Chociaż według naszej wiedzy przeprowadzono tylko dwa badania z randomizacją dotyczące stosowania ARB u pacjentów poddawanych chemioterapii, wykazano, że walsartan zapobiega ostremu wydłużeniu skorygowanego odstępu QT, rozkurczowemu poszerzeniu lewej komory i zwiększeniu BNP podczas jednego tygodnia chemioterapii, chociaż bez wpływu na LVEF,51 a telmisartan zapobiega zmniejszeniu szczytowej częstości skurczów podczas leczenia dużymi dawkami antracyklin52. W celu potwierdzenia tych efektów konieczne są dalsze badania z dłuższą obserwacją.
Statyny
Statyny mają właściwości antyoksydacyjne i przeciwzapalne.53 Badania na modelach zwierzęcych wykazały, że fluwastatyna łagodzi kardiotoksyczność wywołaną antracyklinami, zmniejszając stres oksydacyjny i zwiększając ekspresję enzymu antyoksydacyjnego – mitochondrialnej dysmutazy ponadtlenkowej 2, co prowadzi do zmniejszenia stanu zapalnego serca.53 W jednym z badań klinicznych oceniających wpływ ciągłego leczenia statynami u chorych na raka piersi otrzymujących chemioterapię opartą na antracyklinach, u pacjentów otrzymujących statyny stwierdzono mniejszą częstość występowania HF.54 W innym badaniu u chorych z uprzednio prawidłową LVEF poddawanych chemioterapii antracyklinami, LVEF pozostała niezmieniona po 6 miesiącach u osób leczonych atorwastatyną, w porównaniu ze spadkiem o 8% w grupie kontrolnej.55
Na koniec należy podkreślić, że jak dotąd nie ma solidnych dowodów na skuteczność farmakologicznej prewencji kardiomiopatii indukowanej antracyklinami, dlatego główną strategią prewencyjną pozostaje dokładna wcześniejsza ocena stanu układu sercowo-naczyniowego pacjentów oraz odpowiednie monitorowanie, dobór i dostosowanie dawek chemioterapii.
Leczenie niewydolności serca
Po wystąpieniu oznak lub objawów HF lub zmniejszenia LVEF z powodu kardiotoksyczności związanej z chemioterapią, leczenie powinno być oparte na aktualnych wytycznych.56 Chociaż wybór najlepszej terapii jest oczywiście ważny, w jednym z badań wykazano, że głównym czynnikiem decydującym o powodzeniu leczenia jest czas między zakończeniem chemioterapii a rozpoczęciem terapii HF, ponieważ jeśli jest on dłuższy niż 6 miesięcy, całkowite przywrócenie LVEF jest mało prawdopodobne.57
Perspektywy na przyszłość
Obecnie prowadzonych jest wiele badań klinicznych mających na celu ocenę różnych strategii terapeutycznych, farmakologicznych i niefarmakologicznych, w zapobieganiu kardiomiopatii wywołanej przez antracykliny (tab. 8). Minie jeszcze kilka lat, zanim poznamy wyniki, a nadal istnieje pilna potrzeba opracowania opartych na dowodach naukowych wytycznych dotyczących oceny i monitorowania klinicznego tych chorych.
Badania kliniczne dotyczące zapobiegania kardiomiopatii indukowanej antracyklinami.
| Lead author and ClinicalTrials.gov no. | Typ badania | Choroba | Chemoterapia | Interwencja | Nr. pacjentów | Kolejność | Pierwotna miara wyników | Planowane zakończenie badania | |
|---|---|---|---|---|---|---|---|---|---|
| Mavrudis D NCT01120171 |
Randomizowane, faza 2 | Rak piersi | Antracykliny | Cyklofosfamid vs. liposome-encapsulated doxorubicin | 48 | 4 lata | Overall response rate by CT or MRI | May 2015 | |
| Campbell K NCT02006979 |
Single blind, faza 2 | Rak piersi | Antracykliny | Ostry wysiłek fizyczny wykonywany 24 godziny przed każdym wlewem antracykliny | 24 | 1 rok | GLS | grudzień 2015 | |
| Cipolla C NCT01968200 |
Randomizowane, fazy 3 | Nowotwory | Antracykliny | Enalapril po wystąpieniu uszkodzenia serca vs. enalapril concomitantly to chemotherapy | 268 | Up to one year after completion of chemotherapy | Cardiac troponin levels | July 2016 | |
| Virani S NCT01708798 |
Podwójnie ślepa próba, faza 2, 3 | Rak piersi | Antracykliny | Eplerenon vs. placebo | 78 | 6 miesięcy | Zmiana w LVDF | Maj 2015 | |
| Bocchi E NCT01724450 |
Podwójnie ślepa próba, faza 3 | Rak piersi | Antracykliny | Carvedilol vs. placebo | 200 | 2 lata | LVSD (10% zmniejszenie LVEF) | październik 2016 | |
| Livi L NCT02236806 |
Jednolicie ślepa próba, faza 3 | Rak piersi | Antracykliny i trastuzumab | Bisoprolol vs. ramipril, bisoprolol vs placebo, ramipril vs placebo | Bisoprolol vs. placebo | 480 | 1 rok | LVEF | listopad 2017 |
| Smith K NCT02096588 |
Randomizowane, faza 2 | Rak piersi | Antracykliny | Simwastatyna | 90 | 5 lat | GLS | Kwiecień 2021 |
CT: tomografia komputerowa; GLS: globalne naprężenie podłużne; LVDF: funkcja rozkurczowa lewej komory; LVEF: frakcja wyrzutowa lewej komory; LVSD: dysfunkcja skurczowa lewej komory; MRI: rezonans magnetyczny.
Podsumowanie
Dłuższe przeżycie pacjentów poddawanych terapii przeciwnowotworowej i związany z tym wzrost częstości występowania kardiomiopatii indukowanej antracyklinami oznaczają, że konieczne jest zbadanie i określenie dokładnych mechanizmów prowadzących do niekorzystnych efektów kardiologicznych, w celu ich zapobiegania. Dalsze badania pozwolą na ustalenie konkretnych i potwierdzonych planów prewencji.
Konflikty interesów
Autorzy nie mają konfliktów interesów do zgłoszenia.
.