Apoptosis

Apoptoza, lub programowana śmierć komórki, jest wysoce regulowanym sposobem selektywnej eliminacji komórek przez organizm. Proces ten odgrywa ważną rolę w embriogenezie, utrzymaniu wielkości organizmu i eliminacji uszkodzonych lub nieprawidłowych komórek. Znaczenie apoptozy dla zdrowia człowieka jest podkreślane przez wiele chorób wynikających z zaburzeń apoptozy. Dysregulację apoptozy powiązano z różnymi nowotworami, zaburzeniami neurologicznymi i sercowo-naczyniowymi oraz chorobami autoimmunologicznymi.
Powszechnie rozróżniamy dwa różne typy apoptozy: szlak wewnątrzpochodny, w którym pośredniczą mitochondria w odpowiedzi na bodźce wewnętrzne, takie jak uszkodzenia DNA, oraz szlak zewnątrzpochodny, w którym pośredniczą zewnątrzkomórkowe receptory śmierci (na przykład wiązanie FasL z receptorem FasLG) (rysunek 1). Oba szlaki opierają się na proteazach zwanych kaspazami inicjującymi, które aktywują kaskadę kaspaz efektorowych, prowadząc do apoptozy. W wymianie między szlakiem wewnątrz- i zewnątrzpochodnym pośredniczy agonista śmierci z domeną interakcyjną BH-3 (Bid).
Ścieżka wewnątrzpochodna (rysunek 1) jest inicjowana przez białka homologiczne Bcl-2. W klasycznym szlaku apoptozy białka Bcl-2 Bax i Bak są aktywowane w odpowiedzi na bodźce wewnętrzne, takie jak uszkodzenie DNA lub stres oksydacyjny. Te dwa białka następnie oddziałują z Bid i są wprowadzane do zewnętrznej błony mitochondrialnej. Skutkiem tego jest to, co uważa się za punkt bez powrotu w apoptozie – permeabilizacja zewnętrznej błony mitochondrialnej (MOMP). MOMP prowadzi do uwolnienia czynników proapoptotycznych, takich jak cytochrom c, do cytoplazmy. Cytochrom c w cytoplazmie wiąże APAF-1 i dATP w celu rekrutacji pro-kaspazy 9, tworząc apoptosom. Tworzenie apoptosomu wyzwala rozszczepienie pro-kaspazy-9 do jej aktywnej formy proteazowej, kaspazy-9. Kaspaza-9 jest kaspazą inicjującą, która następnie aktywuje kaspazy efektorowe, takie jak kaspaza-3 i -7, poprzez proteolizę, uruchamiając kaskadę kaspaz, która prowadzi do apoptozy.
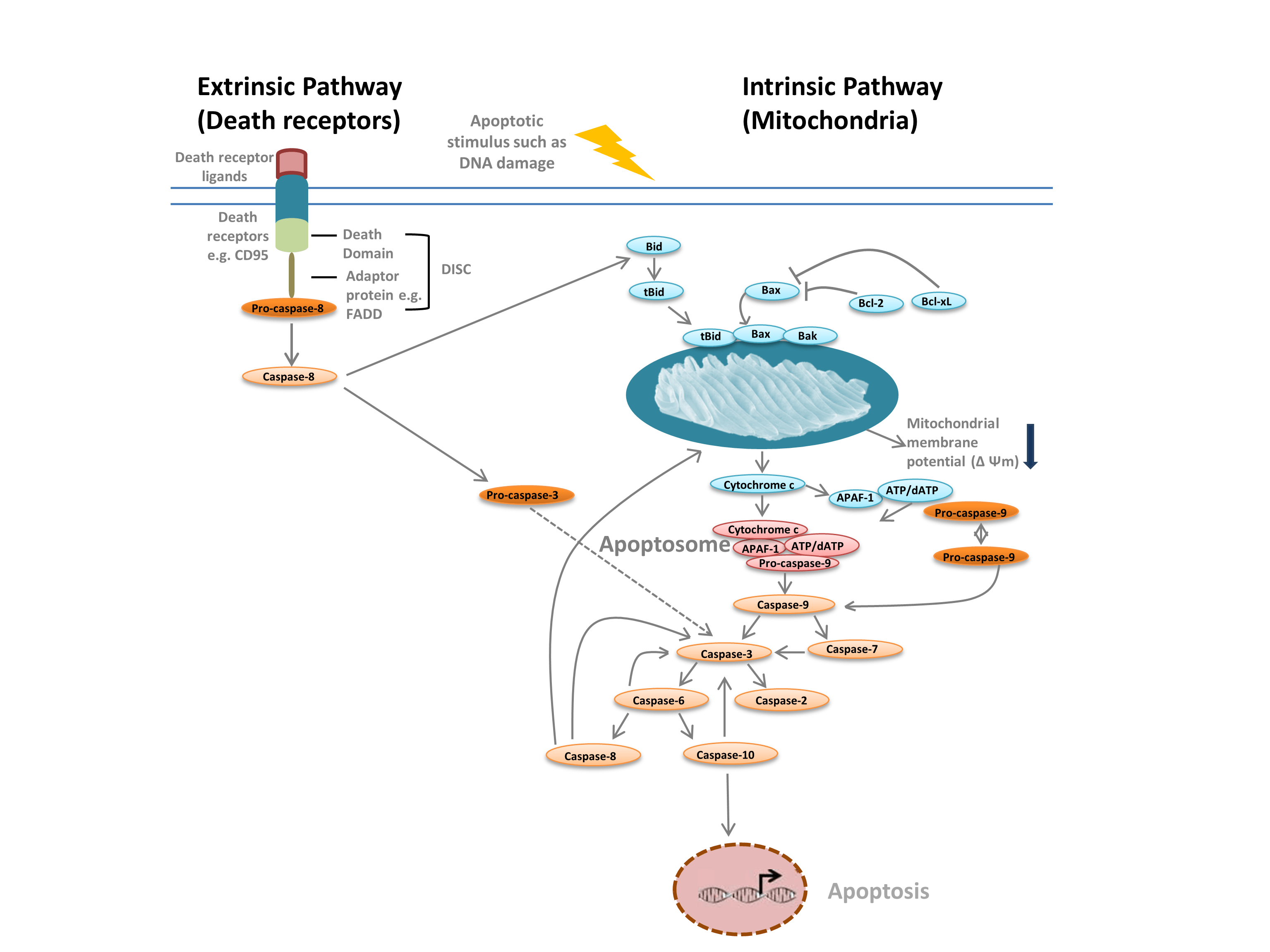
Fig. 1. Ścieżki apoptozy.
Scieżka zewnątrzpochodna jest uruchamiana przez wiązanie ligandów do receptorów śmierci. Po związaniu liganda, receptory śmierci oligomeryzują i rekrutują białka adaptorowe, takie jak FADD. Umożliwia to rekrutację pro-kaspazy-8, nieaktywnej formy inicjującej kaspazy-8, i utworzenie kompleksu sygnałowego indukującego śmierć (DISC). Pro-kaspaza-8 oligomeryzuje i ulega rozszczepieniu do swojej aktywnej formy, kaspazy-8, która z kolei rozszczepia i aktywuje kaspazę efektorową-3. Kaspaza-3 z kolei proteolitycznie aktywuje różne inne kaspazy, prowadząc w ten sposób do apoptozy. W niektórych przypadkach aktywacja szlaku zewnątrzpochodnego może również prowadzić do aktywacji szlaku wewnątrzpochodnego, w którym pośredniczy Bid.
Apoptoza różni się od niezaprogramowanej śmierci komórki/nekrozy. Nekroza jest nieuregulowanym procesem zapoczątkowanym przez uszkodzenie zewnętrzne i różni się od apoptozy na kilka kluczowych sposobów (Tabela 1). Jednakże, w miarę jak coraz więcej wiemy o apoptozie i nekrozie oraz zidentyfikowaliśmy nowe mechanizmy śmierci komórki, takie jak nekroptoza, granice między apoptozą i nekrozą stały się bardziej rozmyte. Cechy rozróżniające przedstawione w tabeli 1 są jednak nadal pomocnymi wskazówkami.
Tabela 1. Cechy apoptozy i nekrozy.
| Apoptoza | Nekroza | ||
| Komórki kurczą się | Komórki puchną | ||
| Fagocyty/makrofagi pochłaniają komórki | Uwalniane są resztki komórkowe | Komórki są uwalniane | . debris cell is released |
| Process is noninflammatory | Process is inflammatory |
Przy analizie apoptozy przydatne jest podzielenie tego procesu na etapy:
- Apoptoza zostaje zainicjowana i aktywowane są kaskady sygnalizacyjne
- Komórki kurczą się i zaokrąglają, w czym pośredniczą kaspazy
- Organelle zmieniają kształt, a błony zaczynają pękać
- Zaczyna się kondensacja jądrowa
- Daje się zaobserwować fragmentację DNA
- Powstają ciała apoptotyczne
- Ciała apoptotyczne są fagocytowane
Te etapy apoptozy, wraz ze znanymi mediatorami apoptozy, mogą być wykorzystywane jako identyfikatory apoptozy. Przy wyborze oznaczenia apoptozy należy zastanowić się, jakie pytanie chcemy zadać – oznaczenia aktywności kaspaz są doskonałymi wskaźnikami inicjacji apoptozy, podczas gdy oznaczenia fragmentacji DNA mogą być stosowane do identyfikacji komórek w późnych stadiach apoptozy, kiedy są one nieodwracalnie zaangażowane w programowaną śmierć komórki.
Przy wykonywaniu oznaczeń apoptozy zawsze rozsądnie jest dołączyć barwniki żywotności takie jak jodek propidium (PI) w celu odróżnienia komórek apoptotycznych od komórek nekrotycznych oraz wizualnie zbadać komórki lub tkanki pod mikroskopem pod kątem kluczowych wskaźników morfologicznych apoptozy.
Ocena apoptozy
1. Zmiany morfologiczne
Obrazowanie poklatkowe żywych komórek może być stosowane do śledzenia apoptozy w czasie rzeczywistym i jest szczególnie przydatne do identyfikacji pęcherzyków błonowych. W przypadku tkanek, transmisyjna mikroskopia elektronowa może być wykorzystana do identyfikacji wielu zmian strukturalnych, które towarzyszą etapom apoptozy. Tkanki mogą być również barwione hematoksyliną i eozyną w celu uwidocznienia makrofagów, które pochłonęły komórki apoptotyczne. Innym barwnikiem powszechnie stosowanym do wizualizacji komórek apoptotycznych jest oranż akrydynowy (AO). Ten popularny barwnik, służący do oceny żywotności i proliferacji, może być stosowany do oceny apoptozy, ponieważ jego widmo emisyjne zmienia barwę na pomarańczową, gdy znajduje się w kwaśnym środowisku lizosomu, co czyni go przydatnym do identyfikacji wchłoniętych komórek apoptotycznych. Barwniki wiążące DNA, takie jak DAPI, Hoechst, jodek propidium (PI) i 7-AAD mogą być stosowane do wizualizacji pęcherzyków jądrowych, podczas gdy kurczenie się komórek może być wykryte albo w cytometrze przepływowym jako redukcja rozproszenia w przód (FSC) lub wizualnie przy użyciu mikroskopii świetlnej.
2. Zmiany w potencjale błony mitochondrialnej
Zmiany w potencjale błony wskazują, że komórka przekroczyła punkt bez powrotu i jest teraz zaangażowana w apoptozę. Załamanie potencjału błony mitochondrialnej można wykryć za pomocą cytometrii przepływowej lub immunofluorescencji z wykorzystaniem barwników potencjometrycznych.
Ester etylowy tetrametylodrhodaminy (TMRE), ester metylowy tetrametylodrhodaminy (TMRM) i JC-1 są powszechnie stosowanymi barwnikami potencjometrycznymi. TMRE i TMRM agregują w mitochondriach komórek nieapoptotycznych i fluoryzują na jasnopomarańczowo lub czerwono. W komórkach apoptotycznych z obniżonym potencjałem błony mitochondrialnej barwniki te znajdują się w cytoplazmie w formie monomerycznej i wykazują zmniejszoną czerwoną fluorescencję. Barwniki te mogą być stosowane w połączeniu ze znakowanym fluoroforami inhibitorem kaspaz (FLICA) (patrz następny rozdział) do identyfikacji komórek apoptotycznych w oparciu o dwie cechy: rozkład potencjału błony mitochondrialnej i aktywację kaspaz (rysunek 2).
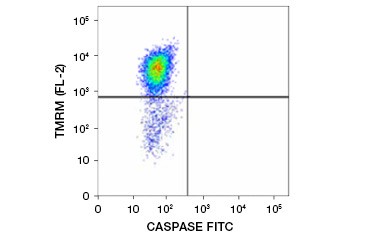
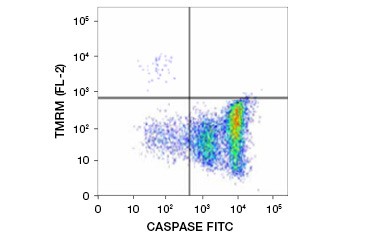
Fig. 2. Wykrywanie obniżenia potencjału błonowego mitochondriów i aktywacji kaspaz metodą cytometrii przepływowej. Jednoczesna utrata pomarańczowej fluorescencji z TMRM i wzrost zielonej fluorescencji, wskazujący na aktywację kaspaz mierzoną przez FAM-FLICA Polycaspase Kit, wskazuje na komórki apoptotyczne (prawy dolny kwadrant).
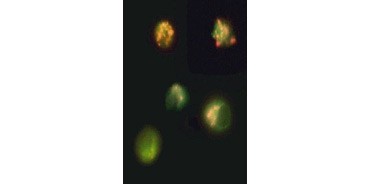
Fig. 3. Załamanie mitochondrialnego potencjału błonowego wizualizowane przy użyciu JC-1. Komórki Jurkat barwiono za pomocą MitoPT JC-1. Komórki nieapoptotyczne (u góry) wykazują mitochondria wybarwione na czerwono, podczas gdy komórki w różnych stadiach apoptozy wykazują zieloną fluorescencję cytoplazmatyczną.
JC-1 agreguje również w mitochondriach komórek nieapoptotycznych i znajduje się rozproszony w całej komórce w komórkach apoptotycznych. W przeciwieństwie do TMRE i TMRM , które wykazują zmniejszoną fluorescencję, JC-1 zmienia kolor, z czerwonego na zielony. Pozwala to na łatwe rozróżnienie nieapoptotycznych komórek fluoryzujących na czerwono i apoptotycznych komórek fluoryzujących na zielono (Rysunek 3). Te oznaczenia mogą być odczytywane przy użyciu mikroskopu fluorescencyjnego, cytometru przepływowego lub odpowiednio wyposażonego czytnika mikropłytek.
3. Aktywacja kaspaz
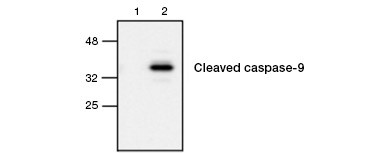
Fig. 4. Aktywna kaspaza-9 jest wykrywana metodą western blot. Analiza Western blot komórek nieleczonych (pas 1) i leczonych etopozydem (pas 2) sondowanych przeciwciałem Rabbit anti-caspase-9 (active). Aktywna, rozszczepiona kaspaza-9 jest wykrywana tylko po indukcji apoptozy etopozydem.
Aktywacja kaspazy jest cechą definiującą apoptozę. Powszechnie oznaczanymi kluczowymi kaspazami apoptotycznymi są kaspazy inicjujące 3, 6 i 7 oraz kaspazy efektorowe 2, 8, 9 i 10. Aktywacja kaspaz może być zidentyfikowana albo przez zmniejszenie rozmiaru pro-kaspaz, gdy są one rozszczepione, albo przez użycie przeciwciał, które oddziałują tylko z rozszczepioną, aktywowaną formą (Rysunek 4). Oba podejścia mogą być odczytywane przy użyciu western blotting, podczas gdy to drugie podejście może być również dostosowane do badań fluorescencyjnych i immunohistochemicznych poprzez wybór przeciwciał sprzężonych z fluoroforami lub biotyną. Te oznaczenia są kompatybilne zarówno z utrwalonymi jak i nieutrwalonymi komórkami.
Jedną rzeczą, o której należy pamiętać jest to, że inicjujące kaspazy są daleko w górę w szlaku sygnalizacyjnym apoptozy i że ich aktywacja nie zawsze skutkuje apoptozą. Dlatego mądrze jest łączyć oznaczenia dla kaspaz inicjujących z oznaczeniami dla kaspaz efektorowych lub, jeszcze lepiej, z sondami do oznaczania zdarzeń poniżej punktu bez powrotu, takich jak MOMP.
Inną klasą oznaczeń aktywacji kaspaz są substraty kaspaz znakowane fluoroforami, takie jak FLICA Assays. Testy FLICA wiążą się kowalencyjnie i nieodwracalnie z aktywowanymi kaspazami; każdy niezwiązany inhibitor dyfunduje z komórek i/lub może być usunięty przez płukanie. Inhibitory te są dostępne w połączeniu z czerwonymi lub zielonymi barwnikami. Intensywność fluorescencji może być wykorzystana jako ilościowa miara aktywności kaspaz – komórki apoptotyczne o wysokiej aktywności kaspaz będą wykazywać większą fluorescencję niż komórki o niskiej aktywności kaspaz. Testy FLICA są kompatybilne z żywymi komórkami, przekrojami tkanek i cienkimi zamrożonymi przekrojami, ale nie z komórkami utrwalonymi lub tkankami zatopionymi w parafinie i mogą być odczytywane przez ilościowe określenie intensywności fluorescencji przy użyciu mikroskopu fluorescencyjnego, cytometrii przepływowej (Rysunek 2) lub czytnika mikropłytek.
Aby wyciągnąć rzetelne wnioski z testów aktywności kaspaz, zawsze mądrze jest wybrać więcej niż jeden cel.
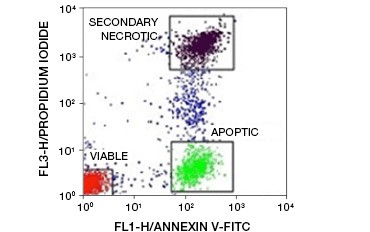
Rys. 5. Koniugaty aneksyny-V mogą być użyte do odróżnienia komórek apoptotycznych od nekrotycznych i żywych. Dot-plot przedstawiający komórki Ramosa wybarwione aneksyną V:FITC w zestawieniu z jodkiem propidium. Można zaobserwować trzy odrębne populacje.
4. Eksternalizacja fosfatydyloseryny
Kluczową cechą apoptozy, która jest wykrywalna nawet we wczesnych stadiach, jest eksternalizacja fosfatydyloseryny (PS), fosfolipidu występującego wyłącznie w błonie wewnętrznej zdrowych komórek. Aneksyna-V wiąże fosfatydyloserynę, a koniugaty aneksyny-V mogą być zatem wykorzystywane do oceny apoptozy. Oznaczenia te są powszechnie przeprowadzane za pomocą cytometrii przepływowej z wykorzystaniem znakowanej fluoroforem aneksyny-V. Przez połączenie tego barwnika z dowolnym barwnikiem żywotności, takim jak PI, można odróżnić komórki apoptotyczne od komórek martwiczych. W tych dwukolorowych doświadczeniach cytometrii przepływowej trzy populacje są łatwo rozróżnialne: annexin-V/PI podwójnie ujemne żywotne komórki, annexin-V dodatnie/PI ujemne komórki apoptotyczne, i annexin-V/PI podwójnie dodatnie wtórne komórki nekrotyczne
(rysunek 5).
Eksternalizacja fosfatydyloseryny jest dynamicznym, odwracalnym procesem do czasu, gdy komórka jest zaangażowana w apoptozę po MOMP. Przy użyciu koniugatów aneksyny-V niemożliwe jest odróżnienie wczesnych, odwracalnych etapów apoptozy od późniejszych etapów apoptozy, kiedy komórka jest zaangażowana w śmierć. Sondy pSIVA (Polarity-sensitive indicator of viability and apoptosis) są biosensorami, które odwracalnie wiążą PS i w ten sposób włączają się i wyłączają, gdy PS przechodzi z błony zewnętrznej do wewnętrznej (Rysunek 6). Kolejną zaletą testu pSIVA jest to, że w przeciwieństwie do koniugatów aneksyny-V, sondy pSIVA mogą być dodawane bezpośrednio do komórek bez konieczności przeprowadzania etapów płukania. Test ten można odczytywać za pomocą immunocytochemii i mikroskopii immunofluorescencyjnej, w tym obrazowania żywych komórek, co pozwala na łatwe porównanie różnic w szybkości apoptozy w odpowiedzi na różne zabiegi eksperymentalne w czasie rzeczywistym. Ponieważ apoptoza jest monitorowana w czasie rzeczywistym, test ten nie jest kompatybilny z komórkami utrwalonymi.
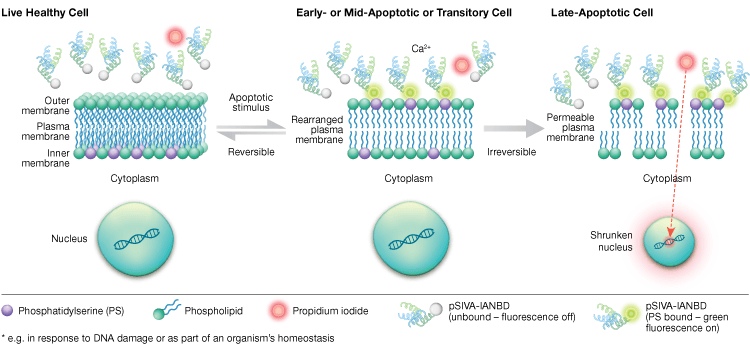
Fig. 6. Test pSIVA Assay może rozróżnić żywe, wczesne apoptotyczne i późne apoptotyczne komórki poprzez monitorowanie eksternalizacji i internalizacji fosfatydyloseryny w czasie rzeczywistym.
5. Fragmentacja DNA
Fragmentacja DNA jest jednym z późniejszych etapów apoptozy i jest powszechnie analizowana poprzez wykrywanie ladderingu DNA przy użyciu elektroforezy opartej na agarozie lub metody znakowania terminalną deoksynukleotydylotransferazą dUTP nick end labeling (TUNEL).
Definiującą cechą apoptozy jest fragmentacja DNA na fragmenty ~180 bp przez endonukleazy aktywowane przez kaspazę. Ekstrahowany genomowy DNA na żelu agarozowym będzie zatem wykazywał charakterystyczne drabinkowanie DNA, którego nie obserwuje się w komórkach umierających w wyniku innych mechanizmów, takich jak nekroza.
Metoda TUNEL jest innym sposobem wykrywania tworzenia oligonukleosomów przez endonukleazę aktywowaną przez kaspazę. W wyniku rozszczepienia DNA powstają grupy hydroksylowe 3′ (grupy 3′-OH). Test TUNEL wykorzystuje enzym terminalną deoksynukleotydylotransferazę (TdT), aby dodać BrdU do tych grup 3′-OH. Wbudowany BrdU może być następnie wykryty przy użyciu przeciwciał anty-BrdU znakowanych biotyną lub fluoroforem. To badanie jest kompatybilne z cytometrią przepływową, jak również immunohistochemią i immunofluorescencją i może być przekształcone w odczyt radioznacznika przez użycie -TdR zamiast BrdU. Komórki muszą być utrwalone po inkorporacji BrdU przed barwieniem.
Fragmentacja DNA może być również mierzona za pomocą cytometrii przepływowej przy użyciu testu sub-G1. Małe, ~180 bp, fragmenty DNA powstające podczas apoptozy wydostają się z komórek, zmniejszając całkowitą zawartość DNA w komórkach apoptotycznych. Barwiąc DNA za pomocą PI, hipodiploidalne komórki apoptotyczne można policzyć w piku sub-G1 histogramu PI.
6. Panele multipleksowych markerów apoptozy
Wreszcie, wielu sprzedawców sprzedaje panele do multipleksowej analizy immunologicznej populacji komórek. Panele te mogą oznaczać wiele markerów apoptozy jednocześnie.
Niezależnie od metody stosowanej do wykrywania apoptozy, należy dołączyć odpowiednie kontrole, ponieważ warunki doświadczalne i typ komórek mogą zmienić wyniki niektórych oznaczeń. Zawsze dołączaj kontrole pozytywne i negatywne. Należy dołączyć kontrole traktowane nośnikiem w celu uwzględnienia wpływu rozpuszczalników, kontrole specyficzne dla zastosowania w celu kontroli czynników takich jak autofluorescencja w eksperymentach immunofluorescencyjnych oraz kontrole ładowania dla western blotting.
Tabela 2. Podsumowanie testów do wykrywania cech charakterystycznych apoptozy.
| Faza apoptozy | Odczynniki umożliwiające wykrywanie | Zastosowanie |
| PS flipping | koniugatów aneksyny-V, sondy pSIVA | Cytometria przepływowa, mikroskopia |
| Inicjowanie kaskad sygnałowych | FLICA, przeciwciała kaspazowe | Cytometria przepływowa, mikroskopia, western blot |
| MOMP | TMRM, TMRE, JC-1 | Cytometria przepływowa, mikroskopia, czytnik mikropłytek |
| Kurczenie się komórek | Cytometria przepływowa, mikroskopia | |
| Membrane blebbing | hematoxylin + eosin | Mikroskopia |
| Kondensacja jądrowa | DAPI, Hoechst, PI, 7-AAD | Mikroskopia |
| Fragmentacja DNA | TUNEL, Sub-G1 assay, DNA laddering | Żel agarozowy, cytometria przepływowa, mikroskopia |
| Fagocytoza ciał apoptotycznych | Pomarańcza akrydynowa, hematoksylina + eozyna | Cytometria przepływowa, mikroskopia świetlna i elektronowa |
.