Struktura Lewisa jonu szczawianowego jest rysowana w tym poradniku krok po kroku. Całkowita koncepcja elektronów walencyjnych jest używana do rysowania struktury Lewisa dla C2O42-. Po zakończeniu rysowania struktury Lewisa dla C2O42-, powinien istnieć ładunek -2 i stabilność. O tych rzeczach dowiesz się w tym przewodniku.
Jon oksalatowy | C2O42-
Jon węglanowy ma ładunek -2. W jonie szczawianowym znajdują się dwa atomy węgla.
C2O42- struktura Lewisa
Dwa atomy węgla są połączone z jednym atomem węgla. Tak samo pozostałe dwa atomy tlenu są połączone z innymi atomami węgla. W strukturze lewisa jonu C2O42-, jon jest symetryczny wokół wiązania C-C.
Kroki rysowania struktury lewisa C2O42-
Następujące kroki są wymagane do narysowania struktury lewisa C2O42- i są one szczegółowo wyjaśnione w tym samouczku.
- Znajdujemy całkowitą liczbę elektronów w powłokach walencyjnych atomów węgla i tlenu. Jest to używane do określenia liczby wiązań, samotnych par wokół atomów.
- Totalna liczba par elektronów wokół atomów
- Wybór atomu centralnego zgodnie z maksymalną walencyjnością
- Załóż samotne pary na atomy
- Sprawdź stabilność i zminimalizuj ładunki na atomach, aby zbudować najbardziej stabilną strukturę poprzez zamianę samotnych par na wiązania.
Podobnie jak te kroki, następujące fakty są ważne do rysowania struktury Lewisa.
Tlen powinien posiadać ujemne ładunki w strukturze lewisa, ponieważ tlen lubi zatrzymywać elektrony niż atom węgla.
Elektronegatywność tlenu jest wyższa niż węgla.
Narysowanie prawidłowej struktury lewisa jest ważne dla prawidłowego narysowania struktur rezonansowych CO32-.
Całkowita liczba elektronów powłok walencyjnych C2O42-
Węgiel znajduje się w grupie 4 w układzie okresowym. Tak więc, węgiel ma cztery elektrony w jego powłoki walencyjnej. Tlen znajduje się na 6 grupy. Ma sześć elektronów w powłoce walencyjnej.
- Total valence electrons given by carbon atom = 4 * 2 = 8
There are four oxygen atoms in C2O42- ion, Therefore
- Total valence electrons given by oxygen atoms = 6 *4 = 24
There are -2 charge on C2O42- ion. Dlatego są dwa elektrony więcej, które przyczyniają się do elektronów walencyjnych.
- Całkowita liczba elektronów walencyjnych = 8 + 24 + 2 = 34
Całkowite pary elektronów walencyjnych
Całkowite pary elektronów walencyjnych = σ wiązania + π wiązania + samotne pary na powłokach walencyjnych
Całkowite pary elektronów są określone przez podzielenie liczby całkowitej elektronów walencyjnych przez dwa. Dla jonu C2O42-, całkowita liczba par elektronów wynosi 17.
Centralny atom jonu C2O42-
Aby być centralnym atomem, ważna jest zdolność posiadania wyższej wartościowości. Węgiel ma większe szanse na bycie atomem centrum (patrz rysunek), ponieważ węgiel może wykazać walencyjność 4. Najwyższa walencyjność tlenu wynosi 2. Tak więc, teraz możemy zbudować szkic jonu C2O42-.
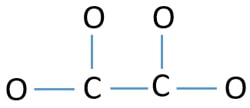
Samotne pary na atomach
- W powyższym szkicu są cztery wiązania C-O i jedno wiązanie C-C, co daje pięć wiązań. Dlatego tylko dwanaście (17-5 = 12) par elektronów walencyjnych pozostaje.
- Po pierwsze, zaznacz te dwanaście par elektronów walencyjnych jako samotne pary w zewnętrznych atomach (na atomach tlenu). Jeden atom tlenu weźmie trzy samotne pary zgodnie z regułą oktalową (atom tlenu nie może zachować więcej niż osiem elektronów w swojej powłoce walencyjnej).
- Dla czterech atomów tlenu, dwanaście par elektronów jest spędzony. Teraz, nie ma więcej samotnych par do oznaczenia na atomach węgla po oznaczeniu samotnych par na atomach tlenu (poza atomami).
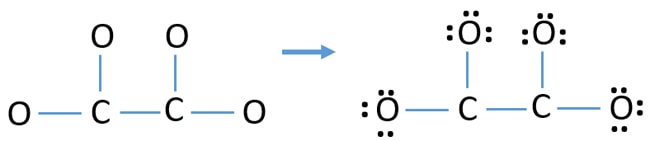
Ładunki na atomach
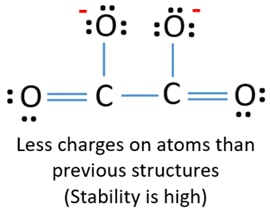
Po oznaczeniu par elektronowych na atomach (w tym przypadku tylko na atomach tlenu), powinniśmy oznaczyć ładunki każdego atomu, jeśli istnieje ładunek. Zaznaczanie ładunków jest o tyle istotne, że służy do wyznaczenia najlepszej struktury lewisa dla danego jonu. Po zaznaczeniu ładunków zobaczymy, że każdy atom tlenu dostanie ładunek -1, a oba atomy węgla dostaną ładunek +1.
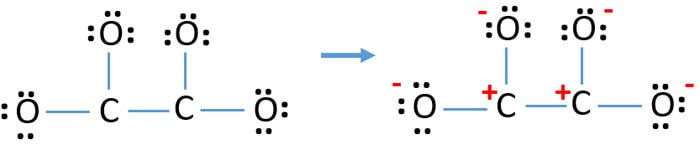
Ta struktura jest bardzo niestabilna, ponieważ wszędzie w jonie są ładunki.
Sprawdź stabilność i zminimalizuj ładunki na atomach zamieniając samotne pary na wiązania
- Atomy tlenu powinny posiadać ładunki ujemne, ponieważ elektronegatywność atomu tlenu jest większa niż atomu węgla. Inaczej możemy powiedzieć, że zdolność do utrzymywania ładunków ujemnych jest większa w atomach tlenu niż atomach węgla.
- Narysowana struktura nie jest stabilna, ponieważ wszystkie atomy mają ładunek (struktura Lewisa powinna być stabilna z mniejszą ilością ładunków).
- Teraz powinniśmy spróbować zminimalizować ładunki poprzez konwersję samotnej pary lub par do wiązań. Więc przekształcić jedną samotną parę jednego atomu tlenu, aby wiązanie C-O.
- Teraz jest podwójne wiązanie pomiędzy jednym atomem węgla i jednym atomem tlenu (jedno wiązanie C=O). Teraz istnieją trzy pojedyncze wiązania pomiędzy atomem węgla i innymi trzema atomami tlenu (dwa wiązania C-O).
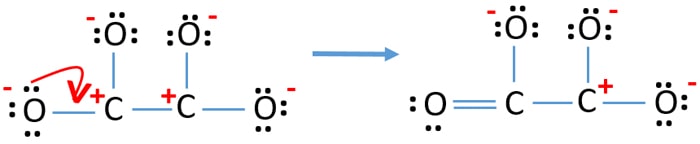
W nowej strukturze, ładunki atomów są zmniejszone niż w poprzedniej strukturze. Teraz nie ma ładunków na jednym atomie tlenu i jednym atomie węgla. Ale nadal istnieją ładunki na trzech atomach tlenu (mają -1 ładunek ujemny) i na drugim atomie węgla. Teraz rozumiesz, że ta struktura C2O42- jest bardziej stabilna niż poprzednia struktura. Ale, staramy się zmniejszyć ładunki tak bardzo, jak to możliwe.
Zmniejsz ładunki ponadto
Możesz przekształcić samotną parę innego atomu tlenu do wiązania C-O, jak poniżej.
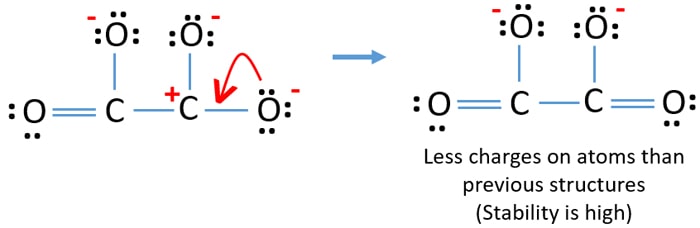
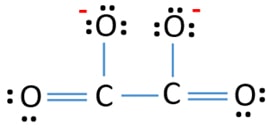
Struktura Lewisa jonu C2O42- (węglanowego)
Pytania
Zadawaj pytania z chemii i znajdź odpowiedzi
Powiązane poradniki
.