Abstract
Celem tej pracy, skupiającej się na niewielkiej liczbie przypadków, jest zajęcie się angiosarcoma piersi, stanowiącym mniej niż 1% wszystkich nowotworów tkanek miękkich piersi, i ostateczne podzielenie się naszym doświadczeniem. W następstwie leczenia oszczędzającego pierś (breast-conserving therapy – BCT), które jest obecnie standardem leczenia, zwrócono uwagę na nowy typ angiosarcoma: Radiation-Induced Angiosarcoma (RIAS).
Here is reported a retrospective analysis of RIAS patients’ characteristic features, together with an account of the integrated treatment and the outcome of six cases of RIAS treated in our institution from 2013 to 2018.
Mięsak naczynioruchowy piersi jako konsekwencja operacji i radioterapii był rzadko odnotowywany, ale jest udokumentowanym powikłaniem radioterapii raka piersi, z wysokim odsetkiem nawrotów i złymi wynikami.
Pozostaje wyzwaniem klinicznie, radiologicznie i histologicznie, a zatem wymagany jest wysoki indeks podejrzeń u podatnych pacjentów. Podstawową metodą leczenia jest prosta mastektomia, jednak coraz więcej badań koncentruje się na zastosowaniu radioterapii i chemioterapii, z których każda charakteryzuje się różnym stopniem skuteczności. Ponowne napromienianie może być brane pod uwagę w celu zwiększenia kontroli miejscowej, natomiast chemioterapia może być rozważana w przypadkach w bardziej zaawansowanym stadium.
Skróty
RIAS: Radiation-Induced Angiosarcoma; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: Magnetic Resonance Imaging; IMRT: Intensity-Modulated Radiotherapy
Keywords
Breast angiosarcoma (AS), Radiation-induced angiosarcoma (RIAS), Radical mastectomy (RM), Radiation-induced tumors, Adjuvant radiotherapy, Intensity-Modulated Radiotherapy (IMRT)
Wprowadzenie
W niniejszej pracy omówiono diagnostykę, postępowanie i wyniki leczenia RIAS u niewielkiej liczby chorych na raka piersi.
Jako bardzo rzadki nowotwór naczyniowy, mięsak gruczołu piersiowego (AS) może być podzielony na pierwotny, jeśli powstaje bez znanego prekursora, lub wtórny, jeśli pojawia się w miejscu wcześniej napromienianej skóry, w którym to przypadku jest znany jako mięsak gruczołu piersiowego indukowany promieniowaniem (RIAS). Jednak nadal nie istnieją oparte na dowodach naukowych wytyczne dotyczące idealnego leczenia mięsaków naczynioruchowych.
W przypadku pacjentek poddanych operacji oszczędzającej pierś z radioterapią adiuwantową szacowana częstość występowania RIAS waha się między 0,05 a 0,3%, stanowiąc mniej niż 1% guzów piersi i około 3% wszystkich mięsaków tkanek miękkich.
Wydaje się, że częstość występowania RIAS wzrasta, być może odzwierciedlając długi okres utajenia dla rozwoju tych nowotworów po powszechnym przyjęciu radioterapii adiuwantowej dla raka piersi.
Diagnoza RIAS piersi jest często opóźniona z powodu łagodnego wyglądu i trudności w odróżnieniu go od niespecyficznych zmian skórnych wywołanych wcześniejszym napromienianiem lub inną chorobą. Wyniki badań radiologicznych są również często niespecyficzne. Chociaż RIAS rozwija się zwykle 10 lat po radioterapii z powodu raka piersi, okres utajenia może wynosić od 6 miesięcy do 20 lat, co skłania niektórych autorów do przypuszczeń, że prawdopodobnie jest on niedostatecznie zgłaszany, a zatem rzeczywiste wskaźniki zachorowalności są wyższe. Wraz ze wzrostem zachorowalności na raka piersi, stosowanie chirurgii oszczędzającej pierś, a następnie radioterapii zastępuje radykalną mastektomię jako standardowe leczenie. Częstość występowania RIAS również wzrasta, a szacowana skumulowana częstość występowania wynosi 0,9-3,2 na 1000 przypadków raka piersi. W dużym populacyjnym badaniu kohortowym, historia wcześniejszej radioterapii jako leczenia raka piersi była związana z 26-krotnym wzrostem ryzyka rozwoju angiosarcoma w porównaniu z nienapromienianą grupą kontrolną. Rokowanie dla pacjentów z RIAS pozostaje złe, a 5-letnie przeżycie całkowite waha się od 27 do 48%. Pomimo, że RIAS został po raz pierwszy opisany na początku lat 20-tych XX wieku, jego biologia molekularna jest nadal kontrowersyjna i dlatego nie ma dostępnej terapii celowanej.
Obecnie agresywna resekcja chirurgiczna jest powszechnie zalecana jako leczenie z wyboru. Brakuje danych potwierdzających skuteczność chemioterapii adjuwantowej.
Chirurgia, w postaci szerokiego wycięcia lub mastektomii, jest głównym sposobem postępowania w chorobie miejscowej. Niektóre badania wykazały związek między marginesami R0 a poprawą przeżywalności, chociaż nie wykazano, aby był on niezależny od innych czynników biologicznych, takich jak wielkość guza. Istnieją pewne dowody na to, że chemioterapia neoadjuwantowa może poprawić wyniki leczenia angiosarcoma, którego rzadkość ogranicza naszą wiedzę do opisów przypadków lub małych retrospektywnych serii przypadków.
W celu scharakteryzowania populacji pacjentów z RIAS, leczonych w naszym szpitalu przez okres 5 lat, przeprowadziliśmy retrospektywne badanie analizujące przydatność mammografii, ultrasonografii i rezonansu magnetycznego (MRI) dla naszej diagnozy .
Nasza praca została zgłoszona zgodnie z kryteriami SCARE .
Materiały i metody
Nasza seria przypadków dotyczy pacjentów z histologicznie potwierdzonym angiosarcoma piersi, rozwiniętym po radioterapii z powodu raka piersi, w latach 2013-2018, i analizuje strategie leczenia z podejściem multidyscyplinarnym.
Pacjenci dotknięci chorobą, sześć kobiet z angiosarcoma piersi wywołanym promieniowaniem, zostali zidentyfikowani poprzez kompleksowe wyszukiwanie we wspomnianym okresie rejestru nowotworów naszej instytucji, w Szpitalu Uniwersyteckim w Katanii. Średnia wieku wynosiła 70 lat, zakres: 59-79 lat. Pacjenci mieli wykonane poprzednie postępowanie diagnostyczne i terapeutyczne w różnych instytucjach, tak że nie wszystkie informacje są dostępne. Opis charakterystyki chorych oraz procedur leczniczych wykonanych po rozpoznaniu RIAS przedstawiono w tabeli 1. Wszystkie chore w chwili rozpoznania przeszły leczenie oszczędzające pierś, a radioterapię adiuwantową stosowano metodą konwencjonalnej trójwymiarowej radioterapii konformalnej do dawki całkowitej 50 Gy, z dziennym frakcjonowaniem 2 Gy, z lub bez boostu loży po guzie w wysokości 10 Gy. U 3 chorych guzy były prawostronne, a u pozostałych 3 – lewostronne. Podczas leczenia adiuwantowego pięć z sześciu pacjentek otrzymało systemową chemioterapię opartą na antracyklinach, zgodnie z wytycznymi instytucjonalnymi, a wszystkie pacjentki otrzymały adiuwantową terapię hormonalną tamoksyfenem/inhibitorem aromatazy. Żaden pacjent nie miał HER2-dodatniego raka w momencie rozpoznania.
W trakcie obserwacji, po medianie 7,6 lat (zakres: 5-11 lat), przeprowadzono diagnostykę ipsilateral breast angiosarcoma: najczęstszymi objawami występującymi u pacjentek w momencie rozpoznania były guzki skórne o czerwono-fioletowym zabarwieniu, zlokalizowane w kontekście pól napromieniania, o umiarkowanie zmiennym tempie wzrostu od kilku tygodni do 4-6 miesięcy. U wszystkich chorych uzyskano histologiczne potwierdzenie wtórnego angiosarcoma i we wszystkich przypadkach wykonano radykalną mastektomię. W celu rozpoznania RIAS zastosowano kryteria Cahana i Arlena: mięsak powstający w obrębie uprzednio napromienianego pola; co najmniej 3-letni okres utajenia pomiędzy radioterapią a rozwojem mięsaka; histologiczne rozróżnienie pomiędzy wtórnym mięsakiem a pierwotnym nowotworem. Wszystkie sześć pacjentek otrzymało kompletne badanie radiologiczne z mammografią, USG i MR (u 4/6 pacjentek) w celu potwierdzenia klinicznego podejrzenia RIAS, ale nie zidentyfikowano cech patognomonicznych. Rosnące zainteresowanie literatury naukowej identyfikacją specyficznych cech „sygnatury radiacyjnej” nie przyniosło jeszcze skonsolidowanych danych. Trzech z sześciu pacjentów wyróżnionych w naszej serii przypadków było przedmiotem badania immunohistochemicznego w celu oceny ekspresji MYC, które wykazało wysoką ekspresję u tych chorych. Tabela 1 zawiera również charakterystykę histologiczną guza. Data rozpoznania RIAS została zdefiniowana jako dzień, w którym postawiono rozpoznanie histologiczne. Okres latencji zdefiniowano jako czas od pierwszej sesji radioterapii do daty rozpoznania RIAS. Tylko u jednej pacjentki stwierdzono synchroniczne przerzuty (w płucach) w momencie rozpoznania RIAS, podczas gdy u pozostałych pięciu pacjentek stwierdzono jedynie chorobę piersi.
Tabela 1: Charakterystyka pacjentek i procedury leczenia. View Table 1
Wszyscy pacjenci poddawani operacji w naszym szpitalu byli omawiani na wielodyscyplinarnym spotkaniu dotyczącym mięsaków w fazie przedoperacyjnej. Pacjenci byli klasyfikowani jako posiadający chorobę resekcyjną, jeśli ocena przedoperacyjna wskazywała, że 2 cm lub większy ujemny margines może być osiągnięty przez operację z lub bez plastycznej rekonstrukcji chirurgicznej w postaci pojedynczego pediklowanego lub wolnego płata mięśniowo-skórnego. Jeśli pożądane ujemne marginesy wymagałyby bardziej rozległej rekonstrukcji, takiej jak rozległa resurfacing przez duży przeszczep skóry, pacjent byłby sklasyfikowany jako z chorobą nieresekcyjną.
Szybko postępująca choroba, w przypadku której objętość choroby zwiększała się w ciągu 2-3 tygodni od momentu, gdy nadawała się do wykonania samej mastektomii lub w połączeniu z płatem szypułkowym do momentu, gdy wymagała bardziej rozległej rekonstrukcji, była również uznawana za nieresekcyjną pod względem onkologicznym.
Przedoperacyjne biopsje wykonywano w celu potwierdzenia obecności ZZSK i wykluczenia innych chorób.
Makroskopowo całkowita resekcja była uznawana przez operującego chirurga. Histologicznie resekcja była klasyfikowana jako R0 (mikroskopowo negatywna), jeśli negatywne marginesy były większe niż 1 cm obwodowo lub R1 (mikroskopowo pozytywna), jeśli guz rozciągał się do lub w obrębie mniej niż 1 cm od marginesu resekcji.
Czterech chorych zostało zrekrutowanych do natychmiastowego ponownego napromieniania, natomiast jedna chora była leczona po 13 miesiącach, gdy wystąpił nawrót w okolicy ciemieniowej (odmówiła natychmiastowego ponownego napromieniania), ostatnia chora została wykluczona z ponownego napromieniania, ponieważ w poprzednim leczeniu osiągnęła limity dawek dla serca. Decyzję o podaniu chemioterapii adjuwantowej podejmowano indywidualnie, na podstawie dostępnych danych dotyczących wcześniejszego leczenia i stanu sprawności chorych. Jedna chora otrzymała cztery cykle chemioterapii epirubicyna-ifosfamid, jedna samą epirubicynę przez sześć cykli, trzy zostały wykluczone z powodów medycznych (wiek, choroby współistniejące lub osiągnięta już wcześniej tolerancja dawki antracyklin). Jedna chora otrzymała tygodniowy paklitaksel przez 12 cykli z powodu synchronicznych przerzutów do płuc.
Radioterapia była podawana z uwzględnieniem dawek otrzymanych od zdrowych tkanek w poprzednim napromienianiu i wcześniejszym podawaniu antracyklin. Z tych powodów zdecydowaliśmy się na przeprowadzenie ponownego napromieniania za pomocą radioterapii z modulacją intensywności (IMRT, patrz Rycina 1), stosując technikę step-and-shoot, zgodnie z naszymi procedurami instytucjonalnymi . Zastosowana dawka promieniowania i schemat frakcjonowania były różne: dwie pacjentki otrzymały konwencjonalne frakcjonowanie do 50 Gy, dwie pacjentki otrzymały 40 Gy (ponieważ czas, jaki upłynął od poprzedniego napromieniania był krótki, a nowotwór był zlokalizowany w lewej piersi), jedna pacjentka 35 Gy we frakcji 5 Gy raz w tygodniu (z powodu zmniejszonej zgodności klinicznej).
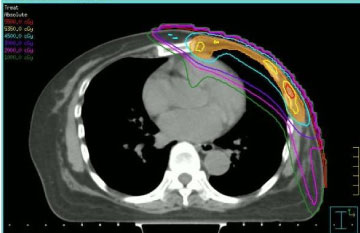 Ryc. 1: Poprzeczny obraz TK z krokowym rozkładem dawki z modulacją intensywności (step-and-shot). View Figure 1
Ryc. 1: Poprzeczny obraz TK z krokowym rozkładem dawki z modulacją intensywności (step-and-shot). View Figure 1
Wyniki
Nie odnotowano dodatnich marginesów u pacjentek, u których wykonano radykalną mastektomię przez ten sam zespół chirurgiczny.
Po radykalnej mastektomii pacjentki otrzymywały leczenie zgodnie z planem, bez żadnych przerw, zarówno w przypadku chemioterapii, jak i radioterapii. Przy medianie czasu obserwacji wynoszącej 22 lata (zakres: 1,5-4 lata), trzy pacjentki żyją, bez dowodów na nawrót lub postęp choroby. Jeden chory z synchronicznymi przerzutami do płuc w chwili rozpoznania jest nadal aktywnie leczony onkologicznie. U jednej pacjentki wystąpiły przerzuty do płuc i kości, ale w chwili składania pracy nadal żyje. U dwóch ostatnich chorych rozwinęły się przerzuty do płuc, z których jeden związany był z nawrotem miejscowym, i zmarli po 8-10 miesiącach (rozkład charakterystyki chorych w odniesieniu do obrazu choroby i otrzymanego leczenia przedstawiono w tabeli 1). Całkowite przeżycie wolne od choroby wyniosło 14 miesięcy dla pięciu pacjentów bez choroby układowej w momencie rozpoznania RIAS, podczas gdy przeżycie wolne od progresji choroby dla pacjenta z synchronicznymi przerzutami w momencie rozpoznania wynosiło 12 miesięcy.
Jak można się spodziewać, gorsze wyniki przeżycia, opisywane w literaturze, odnotowano u pacjentów prezentujących miejscowo zaawansowaną chorobę nieodpowiednią do leczenia chirurgicznego w porównaniu z przypadkami z naszej serii. Czynniki te podkreślają znaczenie wczesnej diagnostyki u pacjentów z RIAS. Angiosarcomas often present themselves insidiously with purple or red skin changes and may be easily mistaken for siniaki or benign skin changes leading to delayed investigation and diagnosis. Early detection and prompt referral may potentially reduce the number of patients showing irresectable disease and improve both local and distant disease control.
Discussion
Radiation-induced tumors typically arise in the context or at the edge of the irradiation field where the dose is not uniform and may result lower than that necessary to induce cell destruction, or cause mutations that may lead to the carcinogenesis process. Efektem działania promieniowania jonizującego są modyfikacje chemiczne i biochemiczne indukowane w organizmach żywych, które powodują zmiany funkcjonalne i morfologiczne komórek, prowadzące do ich biologicznego uszkodzenia. Każda komórka, zdolna do replikacji, może stać się potencjalnie nowotworowa; jeżeli komórki prezentujące modyfikacje chromosomalne wymykają się normalnej kontroli komórkowej, może dojść do kancerogenezy.
Prawdopodobieństwo rozwoju nowotworów u chorych poddanych radioterapii w leczeniu raka piersi jest bardzo małe i nie może ograniczać stosowania radioterapii, gdy jest ona wskazana. Dawki promieniowania powyżej 50 Gy indukują śmierć komórek, a niższe dawki (
Numeryczne badania sugerują korelację pomiędzy wystąpieniem mięsaków tkanek miękkich a zabiegami radioterapii wykonywanymi w celu leczenia guzów piersi. Radioterapia zwiększa ryzyko rozwoju mięsaków tkanek miękkich, a w szczególności rozwoju angiosarcoma . RIAS stanowi, w przybliżeniu, mniej niż 1% guzów piersi. Mięsak naczynioruchowy indukowany radioterapią ma wiele objawów klinicznych: Pacjentki często wykazują bezobjawowe zmiany skórne, które trudno odróżnić od typowych zmian aktynowych występujących po radioterapii w obrębie piersi. Pacjentki często wykazują wyczuwalny obrzęk, purpurowo-czerwony obszar podobny do krwiaka. Angiosarcomas mogą być mylone z łagodnymi objawami, takimi jak naczyniaki lub atypowe teleangiektazje. Mogą również wystąpić purpurowe grudki lub guzki rumieniowe.
Pomimo wszelkich wysiłków terapeutycznych, wskaźnik pięcioletniego przeżycia waha się od 27% do 62,8% (2-3). Chociaż RIAS rozwija się zwykle 10 lat po radioterapii z powodu raka piersi, okres utajenia może wynosić od 6 miesięcy do 20 lat. Radioindukowany angiosarcoma jest nieodróżnialny od spontanicznego angiosarcoma, ale można ocenić pewne różnice: Lae, i wsp. porównali amplifikację c-myc na chromosomie 8q24.21 w 32 próbkach RASB i 15 próbkach sporadycznych angiosarcoma .
W naszej serii, pacjenci doświadczali niespecyficznych objawów choroby, ale diagnoza została postawiona szybko w większości przypadków. Okres latencji był zgodny z tym opisanym w literaturze, z medianą czasu wynoszącą 76 lat.
RIAS jest znany z wysokiego wskaźnika nawrotów. W większości (96%) przypadków RIAS stwierdza się wznowę miejscową, zarówno w łożu guza, jak i wzdłuż blizny pooperacyjnej. Jest to prawdopodobnie spowodowane wieloogniskowym wzrostem RIAS lub pozostałościami złośliwej tkanki po operacji, nawet przy ujemnych marginesach chirurgicznych. Choroba przerzutowa, najczęściej do płuc i wątroby, może występować jednocześnie lub w krótkim czasie po wznowie miejscowej. Abbott, i wsp. dokonali retrospektywnego przeglądu wszystkich przypadków RIAS opublikowanych od 2017 roku i podsumowali dane . Autorzy stwierdzili, że odsetek nawrotów miejscowych wynosił 59%, a mediana czasu do nawrotu wynosiła 6 miesięcy (zakres, 1-78 miesięcy). Stwierdzili również, że choroba przerzutowa była zwykle poprzedzona co najmniej jednym nawrotem miejscowym i że najczęstszymi lokalizacjami były płuca, pierś kontralateralna i szkielet. Ponadto, przegląd histologiczny 42 przypadków sugeruje, że słabo zróżnicowany RIAS wiąże się z wysokim ryzykiem przerzutów, podczas gdy dobrze zróżnicowane guzy wiążą się z większym ryzykiem nawrotu miejscowego niż przerzutów odległych.
Mięsak indukowany napromienianiem jest rzadkim, ale bardzo agresywnym nowotworem. Jego leczenie jest kwestią dyskusyjną, ponieważ nie istnieją żadne wytyczne dotyczące leczenia, rokowanie jest złe, a 5-letnie przeżycie jest bardzo zróżnicowane, o czym donoszono już wcześniej. Niemniej jednak, agresywna resekcja chirurgiczna jest powszechnie zalecana jako leczenie z wyboru.
Operacja, w postaci mastektomii z lub bez rekonstrukcji plastycznej, jest leczeniem z wyboru u chorych z chorobą zlokalizowaną. W serii leczonych chorych możliwe jest uzyskanie mikroskopowo całkowitych (R0) marginesów resekcji u ponad 80%. RIAS typowo prezentują się jako zmiany wieloogniskowe. Tendencja tej patologii do tworzenia złogów mikrosatelitarnych może przyczyniać się do trudności w uzyskaniu kontroli miejscowej.
Wagę wykonania pełnej patologicznej resekcji podkreślano w literaturze, choć nie opublikowano standardowych wytycznych dotyczących zalecanej odległości wycięcia. W obecnej serii u chorych, u których doszło do wznowy miejscowej, stwierdzono bliższe marginesy niż u chorych, u których nie doszło do wznowy. Nie stwierdzono jednak, aby stan marginesów był niezależnym czynnikiem prognostycznym wyników onkologicznych w tej serii. Sugerowałoby to, że zdolność do uzyskania większych marginesów zależy od innych czynników biologicznych guza, które również decydują o wyniku, takich jak rozmiar. Jest prawdopodobne, że biologia guza jest głównie odpowiedzialna za wyniki w RIAS, chociaż początkowa operacja powinna mieć na celu makroskopowe usunięcie guza, należy ostrzec, że osiągnięcie większych ujemnych marginesów niekoniecznie jest równoznaczne z lepszymi wynikami chorych.
Pomimo rosnącej liczby badań skupiających się na chemioterapii i radioterapii, zarówno neoadjuwantowej, jak i adjuwantowej, ich rola pozostaje niejasna. Brakuje danych potwierdzających skuteczność chemioterapii adiuwantowej, natomiast ostatnie dane sugerują, że radioterapia może być przydatna w zapobieganiu nawrotom. Radioterapia adjuwantowa po operacji, według Johnstone’a i wsp. pozwala na lepszą kontrolę miejscową. Rola IMRT w leczeniu ściany klatki piersiowej jest obecnie oceniana, ponieważ może ona zmniejszyć częstość występowania toksyczności popromiennej poprzez zmniejszenie napromieniania narządów zagrożonych (OARs). W badaniu porównawczym dozymetrii autorzy donoszą, że plan IMRT na ścianę klatki piersiowej i cel, w porównaniu z konwencjonalnym leczeniem, pozwala na obniżenie dawki maksymalnej, zwiększenie dawki minimalnej, co skutkuje lepszą zgodnością i jednorodnością objętości docelowej.
Rola i skuteczność chemioterapii nie została ustalona, ponieważ dostępne dane pochodzą z grup o małej liczebności, z których nie można wyciągnąć jednoznacznych wniosków, ale prawdopodobnie pacjenci z wyższym stopniem złośliwości, G3 i z nawrotami, mogliby odnieść największe korzyści z chemioterapii neo lub adiuwantowej.
Stwierdzono również, że stosowanie chemioterapii neo/adjuwantowej było związane z poprawą kontroli miejscowej choroby w dużej retrospektywnej serii pacjentów z mięsakami popromiennymi wszystkich lokalizacji, chociaż nie było związane z poprawą wskaźników nawrotu ogólnoustrojowego lub przeżycia. Nie stwierdzono, aby chemioterapia adiuwantowa przyniosła korzyść w zakresie kontroli miejscowej lub całkowitego przeżycia w badaniu mięsaków tkanek miękkich wysokiego ryzyka leczonych chirurgicznie i radioterapią. W związku z tym, istnieją ograniczone dowody sugerujące, że neo/adjuwantowa chemioterapia przynosi korzyść w zakresie przeżycia w RIAS, chociaż z pewnością może być przydatna jako terapia indukcyjna przed operacją u osób z miejscowo zaawansowaną chorobą i może zaoferować pacjentom skuteczną paliatywność. Terapie celowane mogą stanowić alternatywę leczenia u chorych z progresją choroby.
W naszej serii, w związku z dużą tendencją do nawrotów miejscowych tego nowotworu, zdecydowaliśmy się zaproponować wszystkim chorym powtórne napromienianie, z wyjątkiem jednego z nich z powodu wspomnianych wyżej problemów dozymetrycznych. Jeden chory odmówił natychmiastowego ponownego napromieniania i leczenie przeprowadzono w momencie nawrotu choroby. Zaprogramowanie jednorodnego leczenia napromienianiem dla wszystkich chorych nie było możliwe ze względu na niejednorodność próby pod względem stosowanych wcześniej dawek napromieniania, słabą zgodność kliniczną w jednym przypadku, a przede wszystkim brak jednoznacznych wskazań w literaturze i wytycznych. W każdym przypadku zdecydowaliśmy się na przeprowadzenie leczenia techniką modulacji intensywności, aby umożliwić odpowiedni rozkład dawki, zmniejszenie ekspozycji na dawkę otaczających zdrowych tkanek, zwłaszcza leżącego u podstawy miąższu płucnego i serca.
Wnioski
Radioterapia w leczeniu raka piersi wiąże się ze zwiększonym ryzykiem wystąpienia późniejszego mięsaka, ale odsetek ryzyka jest bardzo niski.
RIAS jest rzadką, agresywną zmianą tkanek miękkich z ograniczonymi możliwościami leczenia i wysokim odsetkiem nawrotów zarówno miejscowych, jak i systemowych.
Wymagana jest uważna obserwacja po radioterapii adiuwantowej. Standardowe leczenie obejmuje operację z prostą mastektomią i radioterapię adjuwantową. Chemioterapia może mieć znaczenie w zmniejszeniu zaawansowania miejscowego choroby, choć nie ma udowodnionego wpływu na przeżycie.
Angiosarcoma występuje znacznie częściej w przypadkach leczonych radioterapią, pojawiając się zwłaszcza w polu napromieniania lub w jego sąsiedztwie. Niewielka różnica w ryzyku późniejszego wystąpienia mięsaka u chorych na raka piersi otrzymujących radioterapię nie przekreśla korzyści płynących z radioterapii.
Nasza seria jest jednak zbyt mała, aby wyciągnąć ostateczne wnioski i jest to ograniczenie badania. Konieczna jest dalsza ocena, również poprzez większą liczbę opisów przypadków, w celu uzyskania lepszej klasyfikacji patologii i umożliwienia dokładniejszego wielodyscyplinarnego postępowania.
Konflikty interesów
Żaden z Autorów nie ma konfliktu interesów do ujawnienia.
Sources of Funding
None.
Ethical Approval
Approval has been given by the University of Catania ethics committee.
Informed Consent
Pisemna świadoma zgoda została uzyskana od pacjenta na publikację tego opisu przypadku i towarzyszących mu obrazów. Kopia pisemnej zgody jest dostępna do wglądu dla Redaktora Naczelnego tego czasopisma na żądanie.
Wkład Autorów
Trovato Agata: Reviewing and editing the article.
Registration of Research Studies
None.
Disclosure
None of the authors have anything to disclose.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Primary and secondary angiosarcoma of the breast. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Long-term outcomes in patients with radiation-associated angiosarcomas of the breast following surgery and radiotherapy for breast cancer. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma: a large-scale single-institution review. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Cutaneous radiation-associated angiosarcoma of the breast: poor prognosis in a rare secondary malignancy. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Clinical management of secondary angiosarcoma after breast conservation therapy. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Radiation-induced sarcoma of the breast: a systematic review. Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Increased risk of soft tissue sarcoma after radiotherapy in women with breast carcinoma. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Radiation-associated angiosarcoma after breast cancer: high recurrence rate and poor survival despite surgical treatment with R0 resection. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Surgical management of radiation-induced angiosarcoma after breast conservation therapy. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Localised angiosarcomas: the identification of prognostic factors and analysis of treatment impact. A retrospective analysis from the French Sarcoma Group (GSF/GETO) Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Thalidomide combined with neoadjuvant chemotherapy in angiosarcoma of the breast with complete pathologic response: case report and review of literature. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Neoadjuvant chemotherapy for primary cutaneous/soft tissue angiosarcoma: determining tumor behavior prior to surgical resection. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Contralateral lymph node metastasis in a woman with new primary breast cancer: Systemic desease or locoregional diffusion? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement: Consensus-based surgical case report guidelines. Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Secondary sarcomas after radiotherapy for breast cancer: sustained risk and poor survival. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) Can c-myc amplification reliably discriminate postradiation from primary angiosarcoma of the breast? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiosarcoma of the breast following surgery and radiotherapy for breast cancer. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarcoma after breast-conserving therapy. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Dosimetric evaluation of integrated IMRT treatment of the chest wall and supraclavicular region for breast cancer after modified radical mastectomy. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstim for resected soft-tissue sarcoma (EORTC 62931): a multicentre randomised controlled trial. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Breast tuberculosis cases rising in Sicily. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Role, timing and technique of radiotherapy in pediatric pleuropulmonary synovial sarcoma. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Intensity-modulated radiotherapy for relapsed malignant pleural mesothelioma. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Single-institution experience of intensity-modulated radiotherapy for malignant pleural mesothelioma at University of Catania. Future Oncol 14: 17-21.
Citation
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) A Single Institution Study Experience of Secondary Breast Angiosarcoma after Breast Conserving Treatment: Multidisciplinary Management. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114
.