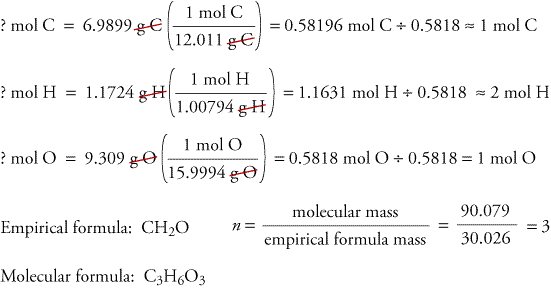Obtendo Fórmulas Empíricas e Moleculares a partir de Dados de Combustão
Fórmulas empíricas e moleculares para compostos que contêm apenas carbono e hidrogênio (CaHb) ou carbono, hidrogênio e oxigênio (CaHbOc) podem ser determinadas com um processo chamado análise de combustão. Os passos para este procedimento são
Pesar uma amostra do composto a ser analisado e colocá-la no aparelho mostrado na imagem abaixo.
Queimar completamente o composto. Os únicos produtos da combustão de um composto que contém apenas carbono e hidrogênio (CaHb) ou carbono, hidrogênio e oxigênio (CaHbOc) são dióxido de carbono e água.
O H2O e CO2 são aspirados através de dois tubos. Um tubo contém uma substância que absorve água, e o outro contém uma substância que absorve dióxido de carbono. Pese cada um destes tubos antes e depois da combustão. O aumento de massa no primeiro tubo é a massa de H2O que se formou na combustão, e o aumento de massa para o segundo tubo é a massa de CO2 formada.
Partir do princípio que todo o carbono no composto foi convertido em CO2 e retido no segundo tubo. Calcule a massa de carbono no composto a partir da massa de carbono na massa medida de CO2 formado.
Calcule que todo o hidrogênio no composto foi convertido para H2O e aprisionado no primeiro tubo. Calcular a massa de hidrogênio no composto a partir da massa de hidrogênio na massa de água medida.
Se o composto contém oxigênio, bem como carbono e hidrogênio, calcular a massa do oxigênio subtraindo a massa de carbono e hidrogênio da massa total da amostra original do composto.
Utilizar estes dados para determinar as fórmulas empíricas e moleculares da forma usual.
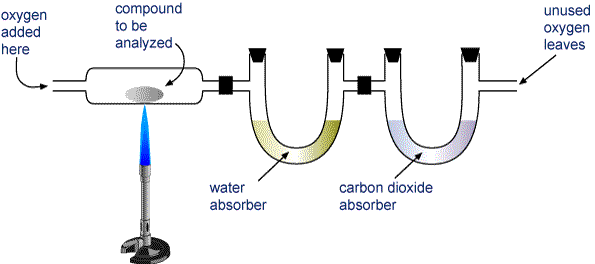
Aparatus for Combustion Analysis Um composto contendo carbono e hidrogênio (CaHb) ou carbono, hidrogênio e oxigênio (CaHbOc) é queimado completamente para formar H2O e CO2. Os produtos são aspirados através de dois tubos. O primeiro tubo absorve água, e o segundo tubo absorve dióxido de carbono.
Para ilustrar como as fórmulas empíricas e moleculares podem ser determinadas a partir de dados derivados da análise de combustão, vamos considerar como uma substância chamada trioxano. O formaldeído, CH2O, é instável como gás puro, formando facilmente uma mistura de uma substância chamada trioxano e um paraformaldeído polimercaldeído. É por isso que o formaldeído é dissolvido em um solvente, como a água, antes de ser vendido e utilizado. A fórmula molecular do trioxano, que contém carbono, hidrogênio e oxigênio, pode ser determinada usando os dados de experimentos com dois diferentes tipos de substâncias. No primeiro experimento, 17,471 g de trioxano são queimados no aparelho mostrado acima, e 10,477 g H2O e 25,612 gCO2 são formados. No segundo experimento, a massa molecular do trioxano é de 90,079.
Podemos obter a fórmula molecular de um composto a partir da sua fórmula empírica e da sua massa molecular. (Veja o texto para um lembrete de como isto é feito.) Para obter a fórmula empírica, precisamos determinar a massa em gramas de carbono, hidrogênio e oxigênio em 17.471 g de trioxano. Assim, precisamos toperformar estes passos gerais.
Primeiro, converta a partir dos dados fornecidos para gramas de carbono, hidrogênio e oxigênio.
Segundo, determine a fórmula empírica a partir das gramas de carbono, hidrogênio e oxigênio.
Terceiro, determine a fórmula molecular a partir da fórmula empírica e a massa molecular dada.
Porque assumimos que todo o carbono em trioxano reagiu na forma de CO2, podemos encontrar a massa de carbono em 17,471 g de trioxano calculando a massa de carbono em 25,612 g de CO2.

Porque assumimos que todo o hidrogênio em trioxano reagiu para formar H2O,podemos encontrar a massa de hidrogênio em 17.471 g de trioxano calculando a massa de hidrogênio em 10.477 g H2O.

Porque o trioxano contém apenas carbono, hidrogénio e oxigénio, podemos calcular a massa de oxigénio subtraindo as massas de carbono e hidrogénio da massa total de trioxano.
? g O = 17,471 g de trioxano – 6,9899 g C – 1,1724 g H = 9.309 g O
Agora calculamos a fórmula empírica, a massa da fórmula empírica e a fórmula molecular.
>
Folha de Estudo de Amostra: Cálculo das Fórmulas Moleculares a partir dos Dados de Combustão
Tip-off- Você quer calcular a fórmula molecular de um composto contendo apenas carbono e hidrogênio (CaHb) ou carbono, hidrogênio e oxigênio (CaHbOc), e você recebe sua massa molecular e as massas de CO2 e H2Oformadas na combustão de uma determinada massa do composto.
Procedimento Geral
Calcular o número de gramas de carbono no composto calculando o número de gramas de carbono na quantidade dada de CO2.

Calcular o número de gramas de hidrogênio no composto calculando o número de gramas de hidrogênio na quantidade dada de H2O.

Se o composto contém oxigênio, calcule o número de gramas de oxigênio no mesmo, subtraindo as massas de carbono e hidrogênio da massa total do composto dado.
? g O = (dado) g total – (calculado) g C – (calculado) g H
Calcular a fórmula empírica do composto a partir das gramas de carbono, hidrogênio e oxigênio.
Calcular a massa da fórmula empírica e dividir a massa molecular dada pela massa da fórmula empírica para obter n.
Multiplicar cada um dos subscritos da fórmula empírica por n para obter a fórmula molecular.
EXEMPLO – Obtendo uma Fórmula Molecular a partir de Dados de Combustão:
Dianabol é um dos esteróides anabolizantes que tem sido usado por algunsathletes para aumentar o tamanho e força dos seus músculos. É semelhante à hormona masculina testosterona. Alguns estudos indicam que os efeitos desejados da droga são mínimos, e os efeitos colaterais, que incluem esterilidade e risco aumentado de câncer de fígado e doenças cardíacas, impedem a maioria das pessoas de usá-la. A fórmula molecular do Dianabol, que consiste em carbono, hidrogénio e oxigénio, pode ser determinada utilizando os dados de duas experiências diferentes. No primeiro experimento, 14,765 g de Dianabol são queimados e 43,257 g de CO2 e 12,395 g de H2O são formados. No segundo experimento, a massa molecular do Dianabol é encontrada em 300,44. Qual é a fórmula molecular do Dianabol?
Solução: