Introdução
Segundo a Organização Mundial da Saúde, o câncer é a segunda principal causa de morte no mundo.1 Os avanços consideráveis e contínuos no tratamento aumentaram a sobrevida dos pacientes com câncer, mas os efeitos adversos da quimioterapia, particularmente no coração, são uma causa significativa de mortalidade e morbidade. A mortalidade entre pacientes com câncer que desenvolvem cardiomiopatia induzida por antraciclina é alta (mais de 60% aos dois anos),2 mas o prognóstico pode ser melhorado pela detecção precoce e prevenção.
As antraciclinas como doxorrubicina, daunorubicina, epirubicina, mitoxantrona e idarubicina são os medicamentos quimioterápicos mais utilizados no câncer. São uma causa conhecida de cardiotoxicidade (Tabela 1), com efeitos agudos e/ou subagudos que se podem manifestar como alterações eletrocardiográficas, arritmias ventriculares e supraventriculares, distúrbios de condução cardíaca (bloqueio atrioventricular ou de ramos), disfunção ventricular, aumento do peptídeo natriurético tipo cérebro (BNP, um marcador de aumento de pré-carga e insuficiência cardíaca ), miocardite e pericardite, e que pode ocorrer a qualquer momento entre o início do tratamento e duas semanas após o final do tratamento. Estes efeitos são relativamente incomuns e a maioria reverte uma semana após a interrupção do tratamento. A cardiomiopatia crônica é definida como precoce se começar dentro de um ano após o término da quimioterapia e tardia após esse período. Em ambos os casos, são observadas disfunções sistólicas ou diastólicas (Tabela 2) que podem evoluir para cardiomiopatia grave e até mesmo levar à morte.3 Embora alguns estudos tenham sugerido que o risco de desenvolver disfunção ventricular e sua gravidade podem ser previstos com base na lesão miocárdica aguda4, a relação entre toxicidade aguda e crônica não é totalmente compreendida. O diagnóstico de disfunção cardíaca induzida pela terapia do câncer tem sido objeto de vários estudos3,5, um dos quais5 é considerado a publicação de referência sobre o assunto, sendo baseado em sintomas de IC, exame físico e parâmetros de função ventricular esquerda.
Cardiotoxicidade, farmacocinética e uso terapêutico de antraciclinas.
>
>
| Mecanismos de acção | Mecanismos de cardiotoxicidade | Antiraciclina | Uso terapêutico | Cardiotoxicidade |
|---|---|---|---|---|
| A formação de um complexo de ADN pela conjugação de anéis planos com nucleótidos inibe a síntese de ADN e RNA e proteínas. Isto desencadeia a clivagem do DNA por topoisomerase II, resultando em citotoxicidade. As antraciclinas inibem a helicase, impedindo a clivagem enzimática da dupla cadeia de DNA e assim interferindo na replicação e transcrição. Produzem reações redox através da formação de radicais livres citotóxicos. |
Mecanismos principais: – danos do DNA mediados pela beta- topoisomerase II – peroxidação lipídica – stress oxidativo – apoptose e necrose das células cardíacas Síntese deficiente do DNA, RNA e proteínas e dos factores de transcrição envolvidos na regulação dos genes específicos do coração. Balanço negativo das proteínas sarcoméricas nas células cardíacas causado pela redução da expressão protéica e aumento da degradação do miofilamento. A terapia combinada exacerba a perda do miofilamento. Lesão do DNA mitocondrial e alterações na bioenergética mitocondrial. Disrupção da regulação dinâmica da função cardíaca, alterando a atividade adrenérgica e adenilíclica da ciclase e homeostase do cálcio. |
Doxorubicina | Câncer de estômago avançado Câncer de bexiga Câncer de peito Câncer de ovário Câncer de pulmão de pequenas células Câncer de tiróide Doença de Hodgkin Leucemia aguda Não…Linfoma de Hodgkin Neuroblastoma Sarcoma Tumor de Wilms |
Acuro: Hipotensão Arritmias Tachycardia Tromboembolismo Subagudo: Pericardite Miocardite Crónica: Cardiomiopatia dilatada Disfunção contrátil Insuficiência cardíaca congestiva |
| Daunorubicina | Leucemia linfoblástica aguda Leucemia mielóide aguda |
Acute: Tachycardia sinusal Tachyarrhythmias Extrasístoles ventriculares Bloco AV Crônicas: Insuficiência cardíaca congestiva |
||
| Epirubicina | Câncer de ovário avançado Câncer de estômago Câncer de peito Câncer de pulmão |
Câncer agudo:Taquicardia ventricular Bloqueio ventricular Bloqueio ventricular Bloqueio de ramos Bradicardia Tromboembolismo Crônico: Insuficiência cardíaca congestiva |
||
| Idarubicina | Leucemia linfocítica aguda Leucemia mielóide aguda |
Acute: Arritmias Fibrilação atrial Infarto do miocárdio Tromboembolismo Crônico: Insuficiência cardíaca congestiva |
||
| Mitoxantrona | Câncer de mama avançado Leucemia mielóide aguda em adultos Linfoma não-Hodgkiniano |
Aguda: Arritmias Miocardite Hipertensão Isquémia miocárdica Crônicas Ciocardiopatia dilatada Disfunção contrátil Insuficiência cardíaca congestiva |
AV: atrioventricular.
Adaptado de 24,58,59.
Critérios para confirmar ou rever um diagnóstico preliminar de disfunção cardíaca induzida por quimioterapia, de acordo com o Comitê de Revisão e Avaliação Cardíaca.
Um dos critérios é suficiente para confirmar o diagnóstico de disfunção cardíaca.
Cardiomiopatia caracterizada por uma diminuição da FEVE cardíaca que é global ou mais grave no septo
Sintomas de ICC
Detecção de galope S3, taquicardia, ou ambos;
Diminuição da FEVE de pelo menos 5% a menos de 55% com sinais ou sintomas de ICC, ou uma diminuição da FEVE de pelo menos 10% a menos de 55% sem sinais ou sintomas de ICC.
ICC: insuficiência cardíaca congestiva; FEVE: fração de ejeção ventricular esquerda.
Adaptado de 3,60.
Uma classificação proposta divide a cardiomiopatia induzida por quimioterapia em dois tipos: tipo I, causada por antraciclinas, que induzem lesão cardíaca dose-dependente irreversível; e tipo II, causada por trastuzumabe, que não está relacionada com a dose cumulativa e é freqüentemente reversível após a interrupção do tratamento.6 O segundo tipo não será discutido neste artigo de revisão.
Nesta revisão os autores discutem estratégias em pacientes em tratamento com antraciclinas, a fim de prevenir ou mitigar seus principais efeitos adversos sobre o coração.
Avaliação inicial
Tendo em vista a cardiotoxicidade das antraciclinas, todos os pacientes encaminhados para quimioterapia devem ser submetidos a uma avaliação cardíaca para estabelecer suas características cardiovasculares basais, que podem então ser utilizadas durante o regime de tratamento para fins de comparação. Esta avaliação deve incluir história clínica e exame físico, eletrocardiografia para determinar o ritmo cardíaco e detectar sinais de isquemia, e ecocardiografia cardíaca, geralmente ecocardiografia transtorácica com estudo Doppler completo (Tabelas 3 e 4). Quando o ecocardiograma fornece informações insuficientes, recomenda-se a ressonância magnética cardíaca (RMC). Os níveis de troponina de linha de base também devem ser medidos para futuras comparações.5
Protocolo de ecocardiograma cardio-oncológico recomendado.
Ecocardiograma padrão transtorácico
– De acordo com as diretrizes ASE/EAE e IAC-Echo
Aquisição de imagens de deformação 2D
– Apical 3-, 4-, e 2-vistas de câmara
– Adquira ≥3 ciclos cardíacos
– Imagens obtidas simultaneamente mantendo a mesma taxa de quadros 2D e profundidade de imagem
> Taxa de quadros entre 40 e 90 quadros/s ou ≥3% de HR
– Aortic VTI (aortic tempo de ejeção)
Análise de imagem de deformação 2D
– Quantificar a deformação longitudinal segmentar e global
– Exibir as curvas de deformação segmentar a partir de vistas apicais em formato quadriculado
– Exibir a deformação global em um touro…trama ocular
2D strain imaging pitfalls
– Ectopy
– Breathing translation
>
Aquisição de imagens 3D
>
– Apical 4-volume total da câmara para avaliar os volumes do VE e calcular a FEVE
– Batimentos simples e múltiplos otimizando a resolução espacial e temporal
– Relatos
– Tempo de ecocardiografia em relação à infusão intravenosa (número de dias antes ou depois)
>
– Sinais vitais (PA, HR)
– Método 3D LVEF/2D biplano Simpson
– GLS (máquina de ecocardiografia, software e versão utilizada)
– Na ausência de GLS, medição de medial e lateral s′ e MAPSE
– RV: TAPSE
Adaptado de 5.
2D: bidimensional; 3D: tridimensional; ASE/EAE: American Society of Echocardiography/European Association of Echocardiography; BP: pressão arterial; GLS: tensão longitudinal global; FC: frequência cardíaca; IAC-Echo: Comissão Intersocietal de Acreditação Ecocardiografia; IV: intravenoso; VE: ventrículo esquerdo; FEVE: fração de ejeção ventricular esquerda; MAPSE: excursão sistólica do plano anular mitral; VD: ventrículo direito; TAPSE: excursão sistólica do plano anular tricúspide; VTI: integral velocidade-tempo.
Avaliação ecocardiográfica da função sistólica e diastólica no paciente com câncer.
Função sistólica do VE
– A ecocardiografia é o método de escolha para a avaliação dos pacientes antes, durante e após a terapia oncológica.
– O cálculo exato da FEVE deve ser feito com o melhor método disponível no laboratório de ecocardiografia (idealmente 3DE).
– Quando se utiliza 2DE, a técnica modificada do biplano Simpson é o método de escolha.
– A FEVE deve ser combinada com o cálculo do índice de movimento da parede.
– Na ausência de GLS por ETEs, recomenda-se a quantificação da função longitudinal do VE com MAPSE e/ou velocidade sistólica de pico (s′) do anel mitral por TDI de onda pulsada.
– A FEVE avaliada pela 2DE frequentemente não detecta pequenas alterações na contratilidade do VE.
Função diastólica
– Embora os parâmetros diastólicos não tenham sido encontrados como prognósticos de cardiomiopatia induzida por antraciclina, uma avaliação convencional da função diastólica do VE, incluindo graduação da função diastólica e estimativa não invasiva das pressões de enchimento do VE, deve ser adicionado à avaliação da função sistólica do VE, de acordo com as recomendações da ASE/EAE para a avaliação da função diastólica do VE com ecocardiografia.
Adaptado de 5,
2DE: ecocardiografia bidimensional; 3DE: ecocardiografia tridimensional; ASE/EAE: Sociedade Americana de Ecocardiografia/Asociação Européia de Ecocardiografia; GLS: tensão longitudinal global; VE: ventrículo esquerdo; FEVE: fração de ejeção do ventrículo esquerdo; ETEs: ecocardiografia de rastreamento de manchas; Doppler tecidual.
Monitorização durante a terapia
É importante monitorizar os sinais e sintomas de cardiotoxicidade durante a quimioterapia (Tabela 5). O eletrocardiograma de 12 derivações pode ser usado rotineiramente para triagem de arritmias devido à cardiotoxicidade relacionada à antraciclina, enquanto a monitorização de Holter 24 horas ou um registrador de eventos pode ser útil para investigar a etiologia da síncope presumivelmente resultante de arritmia ou bloqueio atrioventricular avançado.7 A função cardíaca deve ser monitorizada por ecocardiografia em pacientes sob terapia com antraciclina. A tensão longitudinal global (SLV), avaliada pelo rastreamento bidimensional de manchas, é um preditor mais sensível de IC do que a fração de ejeção do ventrículo esquerdo (FEVE)8, uma vez que, durante a terapia antraciclínica, as alterações na SLV precedem a redução da FEVE.5 Entretanto, na prática clínica, o encurtamento fracionário e a FEVE têm sido os parâmetros mais utilizados9, embora o encurtamento fracionário esteja se mostrando menos confiável nesse contexto. Esses parâmetros, sendo dependentes da pré e pós-carga, são menos sensíveis para a detecção precoce de doença cardíaca pré-clínica. Vários estudos têm sugerido que a avaliação da função diastólica pelo ecodopplercardiograma pode permitir a detecção precoce da cardiomiopatia induzida por antraciclina.10,11 Se a FEVE estiver na Tabela 6), e/ou troponinas estiverem elevadas, uma consulta de cardiologia deve ser considerada, com discussão entre o cardiologista e o oncologista sobre a relação risco/benefício da quimioterapia.5 Uma queda na FEVE durante a terapia antraciclínica está associada ao aumento do risco de eventos cardíacos e, embora uma redução na FEVE de 15% possa indicar cardiotoxicidade.5 O estudo deve ser repetido duas a três semanas após o estudo de base para confirmar o diagnóstico. A RMC pode detectar alterações sutis no miocárdio e aumentos no volume extracelular, o que sugere edema ou fibrose difusa. Embora seja altamente sensível e reprodutível para avaliação da função cardíaca e caracterização do tecido miocárdico, a RMC tem as desvantagens da disponibilidade limitada e do alto custo.12 A angiorressonância radiológica é reprodutível e mais facilmente disponível, mas expõe os pacientes à radiação ionizante, aumentando sua dose cumulativa, especialmente quando estudos seriados são necessários, e fornece apenas informações limitadas sobre a função diastólica e morfologia valvar, pelo que não deve ser o método de escolha.12 A biópsia endomiocárdica tem maior sensibilidade e especificidade para detecção e monitorização dos efeitos adversos das antraciclinas5, permitindo a visualização da perda de miofibrilas, vacuolização do citoplasma, dilatação do retículo sarcoplasmático, aumento do número de lisossomos e edema mitocondrial.12 Entretanto, a natureza invasiva do procedimento limita seu uso na prática clínica. Os biomarcadores foram validados em vários estudos; eles são específicos não apenas na detecção de lesão cardiovascular, mas também na determinação de sua extensão e reversibilidade. Enquanto a troponina T e I são indicadores de lesão cardiomiocitária, o BNP e a porção N-terminal do pró-BNP (NT-proBNP) refletem o aumento do estresse miocárdico.13,14 Segundo a literatura, a elevação das troponinas é um indicador precoce de cardiotoxicidade, enquanto o BNP é menos consistente.
Vantagens e desvantagens dos exames diagnósticos na avaliação da cardiotoxicidade induzida pela antraciclina.
>
>
| Exame de diagnóstico | Vantagens | Desvantagens |
|---|---|---|
| Electrocardiografia | Não-invasiva Baixo custo Medidas intervalo QT, prolongamento do qual é um marcador conhecido de cardiotoxicidade |
Não mede FEVE Variabilidade intra e interobservador na medida do intervalo QT |
| Ecocardiografia doppler | Não-invasiva Baixo custo Avaliação da diastólica funcional e morfológica (fluxo venoso pulmonar, relação E/A), tempo de relaxamento isovolumico) e sistólico (espessamento da parede durante a sístole, FEVE, encurtamento fracionário) parâmetros, estrutura das válvulas e pericárdio |
Intra- e intervariabilidade do observador Medição da FEVE sujeita à variabilidade e dependente da qualidade da imagem Duvido valor preditivo para detecção precoce de lesões subclínicas |
| Doppler do tecido imagens | Resolução temporal excelente Detecção precoce de lesões subclínicas (em combinação com marcadores de inflamação e stress oxidativo) Avaliação funcional das pressões de enchimento (relação E/e′), Velocidades, tensão e taxa de deformação das paredes ventriculares em sístole e diástole Detecção de disfunção diastólica isolada |
Mais tempoanálise de consumo |
| 2D strain/speckle tracking e GLS | Superior à FEVE para prever a mortalidade cardiovascular na população geral Melhor estratificação de risco em pacientes com IC Able reconhecer disfunção precoce do VE em pacientes submetidos a terapia cardiotóxica Reproduzível quando realizado por um operador experiente |
Independentemente da qualidade de imagem da ecocardiografia 2D Falta deensaios clínicos a termo avaliando a capacidade do SLV de prever quedas persistentes na FEVE ou insuficiência cardíaca sintomática |
| Equocardiografia de estresse | Avaliação da reserva contrátil miocárdica | Semi-invasivo Dados controversos e limitados sobre a detecção precoce de cardiotoxicidade |
| Angiologia de radionuclídeos | Alta reprodutibilidade Baixo intra e intervariabilidade do observador Valorizado para medição da FEVE |
Radiação ionizante Baixa resolução espacial e temporal Subestima os volumes ventriculares Subestima a FEVE em ventrículos pequenos (mulheres e crianças) Não avalia a função da válvula Informação mínima sobre função diastólica Valor preditivo limitado para detecção precoce de lesões subclínicas e alterações na FEVE |
| Ressonância magnética | Reproduzível Sem radiação ionizante Avaliação da perfusão e função miocárdica e pericárdio, e detecção de massas miocárdicas Utilizado em pacientes com má qualidade de imagem ecocardiográfica Padrão de ouro para cálculo de volumes de VE e de sequências de FEVE T2: detecta alterações segmentares ou globais no conteúdo de água miocárdica resultante de inflamação ou lesão microvascular ou miocitária Seqüências T1: fornece informações sobre lesões miocárdicas e fibrose; com contraste gadolínico, detecta alterações histopatológicas, incluindo vacuolização intracelular, permitindo prever a subsequente diminuição da FEVE Aprimoramento tardio: detecção de fibrose miocárdica associada a mau prognóstico em pacientes com DAC, cardiomiopatia hipertrófica e doença infiltrativa |
Custo elevado Disponibilidade limitada Contraindicada em pacientes com dispositivos incompatíveis com a ressonância magnética (marcapassos, dispositivos de ressincronização cardíaca e cardioversores-desfibriladores implantáveis) Risco de nefrotoxicidade de contraste em pacientes com insuficiência renal (TFG |
| Tomografia computadorizada | Alto…resolução imagem Identifica a calcificação ou espessamento pericárdico em pacientes submetidos a radioterapia ou cirurgia Visualiza e avalia a calcificação das artérias coronárias |
Ionização da radiação Calcificação coronária documentada antes da terapia anticancerígena não é preditivo de risco de CV em pacientes submetidos à quimioterapia antraciclínica Ligualmente usado para detecção e monitorização de alterações subclínicas na função cardíaca |
| Scintigrafia | Não-invasivo Avaliação funcional e estrutural |
Radiação ionizante Disponibilidade limitada Baixa resolução temporal Dados limitados |
| Biomarcadores | Não-invasivo Baixa resolução intervariabilidade do observador Avaliação da função do CV e sinais potenciais de lesão cardíaca Promissas para detecção precoce de lesão miocárdica |
Valor preditivo indeterminado |
| Biópsia endomiocárdica | Detectar evidência histológica de lesão cardíaca, incluindo perda de miofibrilas, vacuolização do citoplasma, dilatação do retículo sarcoplásmico, aumento do número de lisossomas e inchaço mitocondrial | Invasivo Interpretação histológica requer conhecimentos especializados Sem informação funcional Resultados limitados pela quantidade e qualidade da amostra da biópsia |
| Avaliação dos danos endoteliais | Parâmetros de cardiotoxicidade alterados, tais como citocinas, moléculas de adesão e espessura da íntima-média da artéria carótida | Valor preditivo indeterminado |
| Análise genética | Invasivo minimamente invasivo Avalia a susceptibilidade individual à cardiotoxicidade |
Valor preditivo indeterminado. |
Adaptado de 5,12,61.
2D: bidimensional; DAC: doença arterial coronária; CV: cardiovascular; ECG: electrocardiografia; TFG: taxa de filtração glomerular; SLG: tensão longitudinal global; IC: insuficiência cardíaca; VE: ventrículo esquerdo; FEVE: fração de ejeção ventricular esquerda.
Valores normais de tensão longitudinal global por fornecedor de scanner, sexo e idade.
| Idade (anos) | |||||||
|---|---|---|---|---|---|---|---|
| 0-19 | 20-29 | 30-39 | 40-49 | 50-59 | ≥65 | p | |
| V1 | |||||||
| Global | -22.1±2,4 | -21,2±1,9 | -21,1±2,1 | -21,4±2,0 | -21,0±2,2 | -20,3±1,9 | 0,0218 |
| Macho | -21,7±3.1 | -20.9±1.9 | -20.6±1.9 | -20.9±1.8 | -21.0±1.9 | -19.7±1.4 | 0.1982 |
| Feminino | -22.4±1.6 | -22.4±1.63±1,6 | -22,8±1,8 | -22,6±2,1 | -23,3±1,9 | -20,9±2,1 | 0,0348 |
| p (macho vs. fêmea) | 0,4292 | 0.0316 | 0.0178 | 0.0029 | 0.1381 | ||
| V2 | |||||||
| Global | -19.9±2,5 | -19,0±2,1 | -19,5±2,2 | -18,2±2,5 | -17,6±2,5 | -16,7±2,1 | |
| Masculino | -19,4±2,7 | -18.8±2,0 | -19,1±2,3 | -17,9±2,8 | -16,9±2,3 | -15,8±1,4 | 0,0019 |
| Feminino | -20,5±2,2 | -20.6±2,3 | -20,2±2,0 | -19,3±0,9 | -20,4±1,5 | -17,3±2,3 | 0,0002 |
| p (macho vs. fêmea) | 0,1349 | 0.0248 | 0.1083 | 0.4316 | 0.0294 | 0.0928 | |
| V3 | |||||||
| >Global | -21.4±1,7 | -20,2±2,1 | -20,4±2,3 | -19,4±2,2 | -18,5±2,6 | -17,8±2,8 | |
| Macho | -21.6±2,0 | -20,2±2,0 | -20,4±2,2 | -19,8±2,3 | -18,7±2,6 | -16,3±3,1 | |
| Feminino | -21.2±1,5 | -20,2±2,4 | -20,4±2,8 | -18,7±1,8 | -18,3±2,8 | -18,6±2,3 | 0,0141 |
| p (macho vs. feminino) | 0.6076 | 0.9787 | 0.9201 | 0.1415 | 0.7374 | 0.0668 | |
V1: Vivid 7 ou Vivid E9 (GE Healthcare); V2: iE33 (Philips Medical Systems); V3: Artida ou Apilo (Toshiba Medical Systems).
Adaptado de 62.
Se a dose de antraciclinas exceder 240 mg/m2, a avaliação cardíaca deve ser repetida antes de administrar outros ciclos (Figura 1).
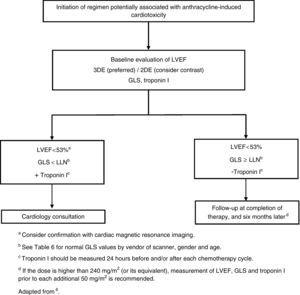
>
Iniciação de um regime potencialmente associado à cardiotoxicidade induzida por antraciclina. 2DE: ecocardiografia bidimensional; 3DE: ecocardiografia tridimensional; GLS: tensão longitudinal global; LLN: limite inferior do normal; FEVE: fração de ejeção ventricular esquerda.
>
Prevenção da cardiotoxicidade
Prevenção da cardiotoxicidade induzida por antraciclina, mantendo a eficácia terapêutica dos fármacos, pode ser alcançada por meios farmacológicos e não-farmacológicos.
Prevenção não-farmacológica
Os fatores de risco cardiovascular devem ser identificados e tratados adequadamente assim que o câncer for diagnosticado. Os pacientes devem ser encorajados a adotar um estilo de vida saudável, incluindo uma dieta pobre em gordura saturada e um máximo de 2,5 g de sódio por dia, evitar substâncias tóxicas, como álcool e tabaco, e manter o índice de massa corporal próximo a 25 kg/m2. O exercício, seja de baixa ou alta intensidade, durante a terapia antraciclínica aumenta a reserva cardiovascular15 e estudos em modelos animais têm indicado que pode reduzir os efeitos cardiotóxicos desses agentes.16 Embora o exercício tenha se mostrado promissor na melhoria da função cardiopulmonar em sobreviventes de câncer de mama,17,18 não houve ensaios clínicos em humanos que confirmem seu papel cardioprotetor. Outra medida é reduzir ou evitar o uso de drogas que prolonguem o intervalo QT, particularmente antagonistas da 5-hidroxitriptamina 3 (freqüentemente usados para prevenir efeitos adversos da quimioterapia, incluindo náuseas e vômitos) e anti-histamínicos.19,20 Também é importante minimizar a exposição à radiação, corrigir distúrbios eletrolíticos e tratar comorbidades (Tabela 7).21
Factores de risco para cardiotoxicidade induzida por antraciclina.
| Dose cumulativa superior: | Máximo recomendado (mg/m2)a: | |
| Doxorubicina | 400-550 | |
| Daunorubicina | 550-800 | |
| Epirubicina | 900-1000 | |
| Idarubicina | 150-225 | |
| Mitoxantrone | 100-140 | |
| Pré-doença CV existente | Diabetes | |
| Doença das artérias coronárias | ||
| Doença vascular periférica | ||
| Hipertensão | ||
| Predisposição genética: sexo feminino, raça negra | ||
| Radiação mediastinal anterior ou concomitante | ||
| Administração de bolo intravenoso | ||
| Combinação com outros agentes, incluindo ciclofosfamida, trastuzumab ou paclitaxel | ||
| Período de tempo desde o final da quimioterapia | ||
| Perturbações eletrolíticas: hipocalcemia, hipomagnesemia | ||
| Hemocromatose (mutação C282Y) | ||
| Hipertermia | ||
| Doença hepática | ||
CV: cardiovascular.
Patientes com mais de 65 anos e crianças podem desenvolver cardiotoxicidade com doses cumulativas mais baixas.
Adaptado de 12,24.
Diminuir a dose de antraciclinas é outra forma de reduzir a incidência de disfunção sistólica do ventrículo esquerdo (DSVE), como mostra um estudo de pacientes tomando 400, 500 ou 550 mg/m2 de doxorubicina, no qual a incidência de IC congestiva foi de 5%, 16% e 26% respectivamente.22 Embora as antraciclinas pareçam ser cardiotóxicas independentemente da dose administrada, vários estudos têm demonstrado que a infusão contínua de doses menores entre 24 e 92 horas23 pode reduzir a gravidade da lesão cardíaca e tem sido descrita como uma forma eficaz de fazê-lo.24 O prolongamento do tempo de infusão reduz a cardiotoxicidade sem comprometer a eficácia da quimioterapia,25 mas a infusão com duração superior a 96 horas está associada a uma alta incidência de estomatite. O único caso em que a infusão contínua de doxorubicina parece não ter efeito cardioprotetor em comparação à infusão rápida é em crianças com leucemia linfoblástica aguda (ALL).26 Outros ensaios clínicos usando biópsia endomiocárdica para avaliar lesão cardíaca induzida por antraciclina em diferentes regimes medicamentosos concluíram que a perfusão contínua leva a danos muito menos significativos do que a administração intravenosa rápida.27 Esses ensaios também mostraram que os pacientes que recebiam infusão contínua tinham maior tolerância a maiores doses cumulativas de doxorubicina. Embora estudos com animais tenham demonstrado que os níveis de antraciclina no tecido tumoral eram os mesmos, embora as drogas fossem administradas (infusão contínua ou rápida), isto não foi verdade para o tecido cardíaco, no qual a infusão rápida levou a concentrações mais elevadas e, portanto, a uma maior toxicidade.28
Prevenção farmacológicaAntioxidantes
Embora os antioxidantes neutralizem os radicais livres formados pela terapia com antraciclina e assim teoricamente reduzam ou previnam a cardiotoxicidade, ensaios clínicos de N-acetilcisteína, coenzima Q, L-carnitina, fenetilaminas, amifostina e uma combinação de vitaminas E e C e N-acetilcisteína não mostraram um efeito cardioprotetor.29 Eritropoietina e iloprost30 demonstraram proteção contra os efeitos cardiotóxicos da doxorubicina in vitro, sem afetar sua eficácia anticancerígena, mas sua capacidade cardioprotetora terá que ser demonstrada in vivo.
Formulações lipossômicas
Uma forma de combater os efeitos cardíacos adversos das antraciclinas é mudar a formulação dos fármacos, como encapsulá-los em lipossomos.31 Estudos comparando doxorubicina não encapsulada e lipossome-encapsulada não encontraram diferença na taxa de resposta antitumoral, sobrevida global ou sobrevida livre de progressão, mas a incidência de IC e DSVE foi menor em pacientes tratados com a formulação lipossômica, e este grupo também teve menor incidência de outros efeitos adversos, incluindo neutropenia, náusea, vômitos e diarréia.32 Devido ao seu elevado custo, estas formulações não são amplamente utilizadas e a US Food and Drug Administration (FDA) aprovou a sua utilização apenas para o cancro dos ovários, o sarcoma de Kaposi relacionado com a SIDA e doentes com mieloma múltiplo que não responderam a um ano de tratamento com outros medicamentos.33
Dexrazoxano
A administração de dexrazoxano concomitantemente com regimes anticancerígenos pode ter um efeito cardioprotetor, prevenindo a elevação de troponinas e reduzindo a incidência de IC.34 Alguns autores atribuem o efeito cardioprotetor deste quelante de ferro à sua redução da quantidade de ferro intracelular, o que pode diminuir a geração de radicais livres induzida pela doxorubicina.34 No entanto, estudos sobre outros quelantes de ferro não demonstraram cardioproteção.35,36 Também tem sido sugerido que o efeito cardioprotetor do dexrazoxano se deve não só à sua formação antagônica do complexo de clivagem da topoisomerase II, mas também à sua indução de rápida degradação da topoisomerase II beta, o que sugere que esta enzima está envolvida na cardiotoxicidade induzida pela anitraciclina.37 Um estudo do dexrazoxano em mais de 200 crianças com TODAS mostrou que ele reduziu a elevação da troponina T em ambos os sexos,38 e limitou a redução do encurtamento fracionário e manteve a relação espessamento ventricular esquerdo em cinco anos, mas somente em meninas.39 Recentemente, três casos foram relatados de adultos submetidos à quimioterapia combinada com dexrazoxano para câncer de mama que desenvolveram leucemia mielóide aguda. Entretanto, dois estudos comparando o dexrazoxano com placebo em crianças com TODAS seguidas por cinco e 10 anos não mostraram diferença na incidência de malignidade secundária.40,41 No entanto, em vista dos seus efeitos adversos conhecidos, a FDA e a Agência Europeia de Medicamentos restringiram o uso de dexrazoxano a pacientes adultos com câncer de mama avançado ou metastático que já receberam uma dose cumulativa de doxorubicina superior a 300 mg/m2 e que se beneficiarão de terapia antraciclínica adicional.42
Beta-bloqueadores
A cardioproteção proporcionada pelos beta-bloqueadores (BBs) parece derivar das suas propriedades antioxidantes e anti-apoptóticas. Um BB, o carvedilol, mostrou particular promessa na redução da incidência de cardiomiopatia induzida por antraciclina e na preservação da função sistólica e diastólica.43 Em crianças, o carvedilol limitou a elevação da troponina I e melhorou tanto o encurtamento fracionário quanto o pico da tensão sistólica global.44 De acordo com alguns estudos, os BBs e inibidores da enzima conversora da angiotensina (ACE) (ver abaixo) podem prevenir a remodelação associada à IC, reduzindo a resposta adrenérgica.45,46 Entretanto, nenhum efeito cardioprotetor foi observado com metoprolol ou enalapril.47
Inibidores de enzimas conversoras de angiotensina e bloqueadores dos receptores de angiotensina
Inibidores de ECA e bloqueadores dos receptores de angiotensina (BRA) mostram propriedades cardioprotetoras, possivelmente pela redução do estresse oxidativo, remodelação ventricular esquerda e apoptose.48 Quando administrado por pelo menos dois anos após a descontinuação da quimioterapia em crianças com CIV induzida por antraciclina, o enalapril não mostrou benefício em termos de redução do estresse da parede sistólica final do ventrículo esquerdo ou preservação do encurtamento fracionário.49 Em contraste, em adultos tratados com antirraciclinas de alta dose, o enalapril preveniu a IC e a piora dos parâmetros de função cardíaca, como a FEVE.50 Estudos em ratos knockout receptores tipo I da angiotensina II mostraram que a doxorubicina não teve efeito cardiotóxico nesses animais e que a administração de BRA pode prevenir cardiomiopatia induzida por daunorobucina.48 Apesar de sabermos que houve apenas dois ensaios aleatórios sobre as BRA em pacientes quimioterápicos, o valsartan demonstrou prevenir o prolongamento agudo do QT corrigido, a dilatação diastólica do ventrículo esquerdo e a elevação do BNP durante uma semana de quimioterapia, embora sem efeito sobre a FEVE,51 e o telmisartan tenha prevenido a redução da taxa de pico de tensão durante a terapia com antraciclina em altas doses.52 Estudos adicionais são necessários com acompanhamento mais prolongado para confirmar esses efeitos.
Estatinas
Estatinas possuem propriedades antioxidantes e antiinflamatórias.53 Estudos em modelos animais demonstram que a fluvastatina mitiga a cardiotoxicidade induzida pela antraciclina, reduzindo o estresse oxidativo e aumentando a expressão da enzima antioxidante mitocondrial superóxido dismutase 2, resultando na redução da inflamação cardíaca.53 Em um estudo clínico avaliando o efeito do tratamento contínuo com estatina em pacientes com câncer de mama que receberam quimioterapia à base de antraciclina, pacientes que receberam estatinas tiveram uma incidência menor de IC.54 Em outro estudo em pacientes com FEVE previamente normal submetidas à quimioterapia com antraciclina, a FEVE permaneceu inalterada aos seis meses naquelas tratadas com atorvastatina, em comparação com uma queda de 8% no grupo controle.55
Finalmente, deve ser enfatizado que ainda não há evidências sólidas para a eficácia da prevenção farmacológica da cardiomiopatia induzida por antraciclina e, portanto, a principal estratégia preventiva continua sendo a avaliação cardiovascular prévia completa dos pacientes e a adequada monitorização, seleção e ajuste das dosagens quimioterápicas.
Tratamento da insuficiência cardíaca
Após o desenvolvimento de sinais ou sintomas de IC ou redução da FEVE devido à cardiotoxicidade relacionada à quimioterapia, o tratamento deve ser baseado nas diretrizes atuais.56 Embora a seleção da melhor terapia seja obviamente importante, um estudo demonstrou que o principal fator determinante para o sucesso do tratamento é o tempo entre o final da quimioterapia e o início da terapia de IC, pois se este for superior a seis meses, é improvável que a FEVE se recupere completamente.57
Prospectivas para o futuro
Estudos clínicos transversais estão atualmente em andamento com o objetivo de avaliar várias estratégias terapêuticas, farmacológicas e não-farmacológicas, para a prevenção da cardiomiopatia induzida por antraciclina (Tabela 8). Passarão alguns anos até que os resultados sejam conhecidos, havendo ainda uma necessidade premente de diretrizes baseadas em evidências para a avaliação e acompanhamento clínico desses pacientes.
Testes clínicos sobre prevenção da cardiomiopatia induzida por antraciclina.
>
| Autor principal e ClinicalTrials.gov.no. | Tipo de ensaio | Condição | Fornecedor(es) de quimioterapia | Intervenção | Não. de pacientes | Seguimento | Medida de desfecho primário | Conclusão do estudo planejado |
|---|---|---|---|---|---|---|---|---|
| Mavrudis D NCT01120171 |
Randomizado, fase 2 | Câncer de peito | Antiraciclinas | Ciclofosfamida vs. Ciclofosfamida doxorubicina encapsulada em lipossoma | >48 | 4 anos | Ressonância magnética | Maio de 2015 |
| Campbell K NCT02006979 |
Cegueira única, fase 2 | Câncer de peito | Anthracyclines | Exercício agudo realizado 24 horas antes de cada infusão de anthracycline | 24 | 1 ano | GLS | Dezembro de 2015 |
| Cipolla C NCT01968200 |
Randomizado, fase 3 | Cancer | Anthracyclines | Enalapril após aparecimento de lesão cardíaca vs. enalapril concomitantemente à quimioterapia | 268 | Subir para um ano após a conclusão da quimioterapia | Níveis de troponina cardíaca | Julho de 2016 |
| Virani S NCT01708798 |
Dupla cegueira, fase 2, 3 | Câncer de peito | Anthracyclines | Eplerenona vs. placebo | >78 | 6 meses | Mudança no LVDF | Maio 2015 |
| Bocchi E NCT01724450 |
Dupla ocultação, fase 3 | Câncer de peito | Anthracyclines | Carvedilol vs. placebo | 200 | 2 anos | LVSD (10% de redução no LVEF) | Outubro 2016 |
| Livi L NCT02236806 |
Cega única, fase 3 | Câncer de peito | Anthracyclines and trastuzumab | Bisoprolol vs. ramipril, bisoprolol vs. placebo, ramipril vs. placebo | 480 | 1 ano | LVEF | Novembro 2017 |
| Smith K NCT02096588 |
Randomizado, fase 2 | Câncer de peito | Anthracyclines | Simvastatina | 90 | 5 anos | GLS | Abril 2021 |
CT: tomografia computadorizada; GLS: tensão longitudinal global; LVDF: função diastólica do ventrículo esquerdo; FEVE: fração de ejeção do ventrículo esquerdo; DSVE: disfunção sistólica do ventrículo esquerdo; RM: ressonância magnética.
Conclusão
A maior sobrevida dos pacientes submetidos à terapia anticancerígena e o conseqüente aumento da incidência de cardiomiopatia induzida por antraciclopatias significa que é necessário investigar e determinar os mecanismos precisos que levam a efeitos cardíacos adversos, a fim de preveni-los. Novas pesquisas permitirão estabelecer planos de prevenção específicos e validados.
Conflitos de interesse
Os autores não têm conflitos de interesse a declarar.