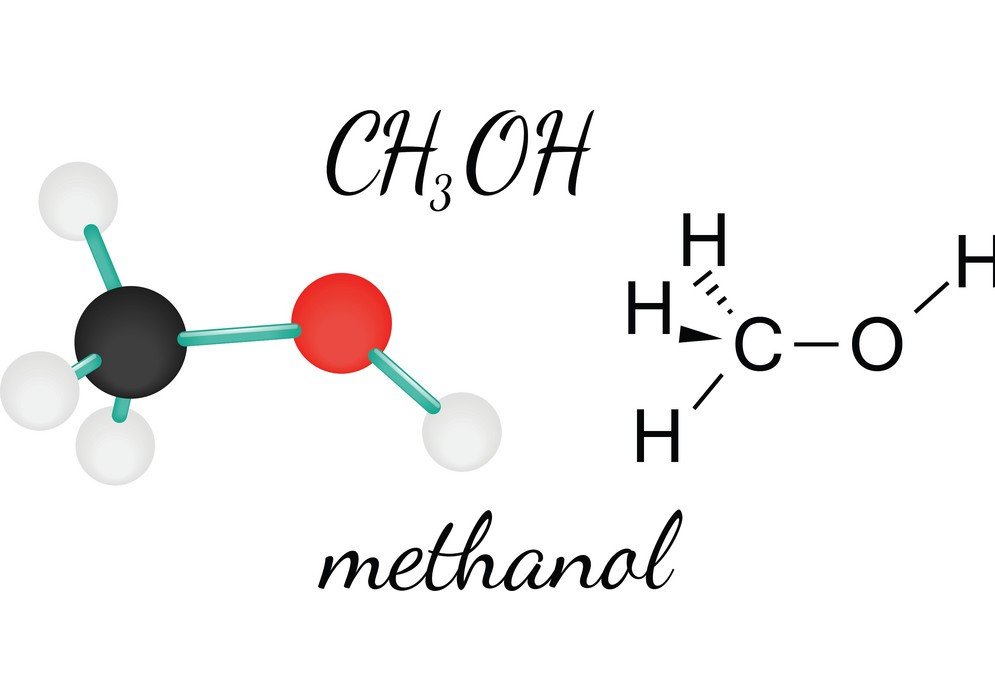
CH3OH ou Metanol é um líquido inflamável, incolor e volátil que tem um odor alcoólico distinto. Ao estudar o Metanol, pode-se conhecer a forma molecular, ângulo de ligação e polaridade da molécula. A polaridade do CH3OH é uma das características vitais, pois ajuda a conhecer as outras propriedades do composto, tais como sua solubilidade, cargas elétricas e muito mais. Para compreender a polaridade do Metanol, vejamos primeiro os ângulos de ligação e a disposição dos átomos na molécula CH3OH.

CH3OH Ângulos de ligação
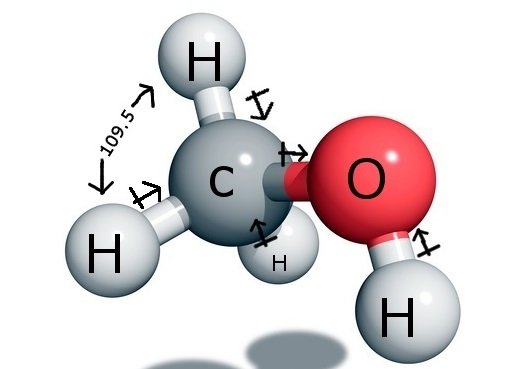
O átomo central de carbono forma quatro ligações no composto, três com o átomo de Hidrogénio e uma com o grupo hidroxilo ( OH). E como este átomo de carbono tem uma hibridação sp3 e forma um tetraedro, ele tem os ângulos de ligação de 109,5 graus com seus átomos de ligação.
Em contraste, o oxigênio forma uma ligação sigma, mas tem dois pares solitários, então há uma dobra em seu ângulo de ligação devido às forças de repulsão de pares solitários ligados. Isto diminui o ângulo de ligação para 104,5 graus.
Assim o Carbono tem um ângulo de ligação de 109,5 graus com os três átomos de Hidrogénio e um ângulo de ligação de 104,5 graus com o grupo hidroxila.
Is CH3OH Polar?
A polaridade de qualquer composto depende do momento dipolo líquido do composto. Este momento dipolo líquido pode ser conhecido notando as cargas elétricas nos átomos da molécula. Aqui ambos os átomos de carbono e oxigênio (que são considerados como centros geométricos para este composto) no Metanol são átomos eletro-negativos. Mas o Oxigénio é mais electronegativo do que o Carbono ou hidrogénio no composto.
CH3OH não pode ser não-polar porque existe uma diferença nas cargas eléctricas entre os átomos da molécula de metanol. O oxigênio tem mais densidade de elétrons devido aos seus dois pares solitários de elétrons. Isto provoca um dipolo líquido apontando para o átomo de Oxigénio, tornando o CH3OH polar.
Parte das cargas eléctricas, a molécula de CH3OH é assimétrica, o que anula a possibilidade de não polaridade. Uma molécula não polar tem uma estrutura simétrica, já que o momento dipolo-dipolo é cancelado. Mas como há uma dobra na forma de Metanol, ela leva à formação de uma estrutura assimétrica, resultando na extremidade negativa do momento dipolo elétrico líquido em direção ao átomo de Oxigênio. Assim o CH3OH é uma molécula polar.
Agora conhecemos a polaridade da molécula CH3OH, passemos por algumas das suas propriedades físicas:
- O ponto de ebulição do Metanol ( CH3OH) é 64,7 °C.
- O ponto de fusão do Metanol é -97,6 °C.
- O peso molecular do Metanol é 32,04 g/mol.
- É um solvente polar e é também conhecido como álcool de madeira porque foi produzido pela destilação da madeira.
- O cheiro deste composto é mais doce em comparação com o do etanol.
Usos de CH3OH
- O metanol também é usado para a produção de hidrocarbonetos e para a síntese de outros químicos, como o formaldeído.
- É usado como anticongelante em tubulações.
- OCH3OH também é usado como aditivo da gasolina em vários países, devido ao seu baixo ponto de fusão.
- O composto também é usado como combustível na combustão interna do motor.
- Muitas empresas farmacêuticas usam Metanol puro para a síntese de outros compostos.
Espero que este artigo ajude a entender a polaridade da molécula e suas propriedades físicas e usos. CH3OH é uma molécula polar, pois o momento dipolo-dipolo não é cancelado devido à sua forma assimétrica.