Introdução
Os locais ativos de uma enzima são geralmente compostos por resíduos de aminoácidos; dependendo de quais resíduos de aminoácidos estão presentes, a especificidade do substrato pode variar muito. Dependendo do nível de pH, as propriedades físicas (principalmente a carga elétrica) de uma enzima podem mudar. Uma alteração na carga eléctrica pode alterar a interacção entre os resíduos de aminoácidos do local activo e o substrato receptor. Dito isto, o substrato pode ligar-se ao local activo através da ligação de hidrogénio ou das forças de van der Waals. Quando o substrato se liga ao local activo, forma um complexo enzimático-substrato que está envolvido em outras reacções químicas.
Para que uma enzima seja ativa e energeticamente favorável para permitir que uma reação química avance, um substrato deve se ligar ao “local ativo” de uma enzima. Um local ativo pode ser pensado como uma fechadura e o substrato como uma chave; isto é conhecido como o modelo de fechadura e chave. Uma chave (substrato) deve ser inserida e girada (reacção química), depois a fechadura (enzima) abre-se (produção de produtos). Note que uma enzima pode ter mais do que um local ativo. Outra teoria sobre a relação site-substrato ativo é a teoria do encaixe induzido, que é bastante oposta à teoria da fechadura e da chave (onde o site ativo é aparentemente inflexível). Na teoria do ajuste induzido, o local ativo da enzima é muito flexível, e só muda sua conformação quando o substrato se liga a ela.
Enzimas funcionam como um catalisador ao baixar a energia livre de Gibbs de ativação do complexo enzima-substrato. Abaixo estão duas figuras mostrando uma reação enzimática básica com e sem catalisador:
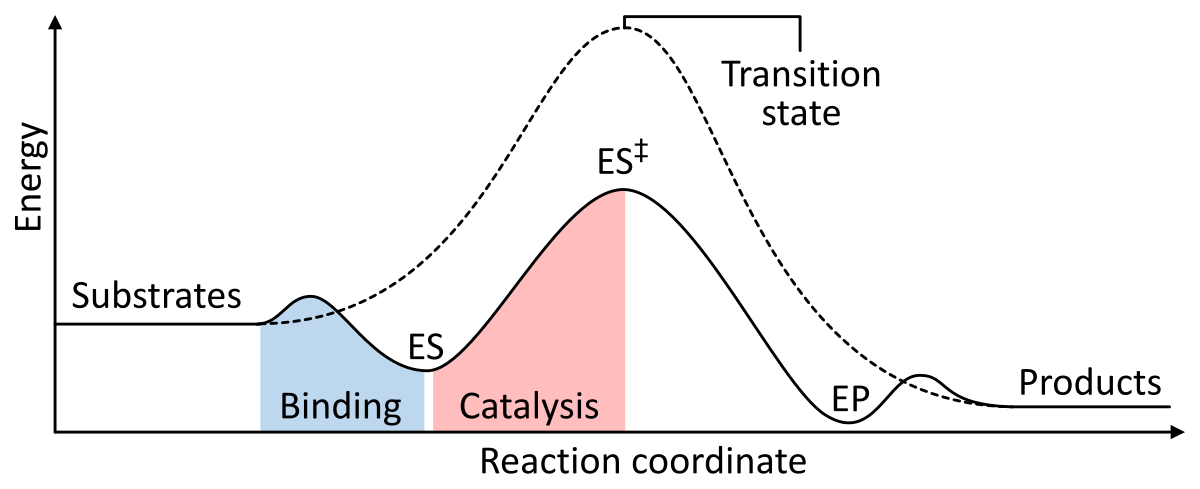
Figure 1: As energias das etapas de uma reação química. Não catalisados (linha tracejada), os substratos precisam de muita energia de ativação para alcançar um estado de transição, que depois se decompõe em produtos de baixo consumo de energia. Quando catalisada (linha sólida), a enzima liga os substratos (ES), então estabiliza o estado de transição (ES‡) para reduzir a energia de ativação necessária para produzir produtos (EP) que são finalmente liberados. da Wikipedia.
A eficiência da enzima pode ser determinada da seguinte forma: considere uma reação enzimática simples:
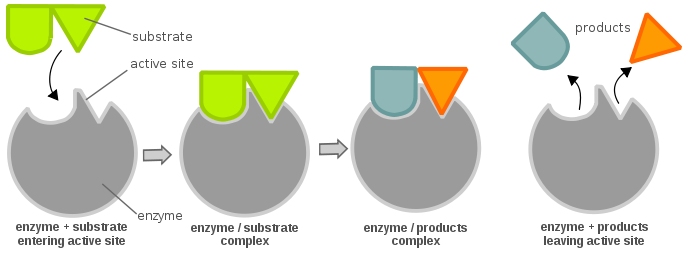
Bioquímica alemã Leonor Michaelis e a bioquímica canadiana Maud Menten derivaram uma equação que descreve este sistema, mais tarde conhecida como a “Equação de Michaelis-Menten”, mostrada abaixo:
\}{K_M + } \Esta equação dá a taxa da reacção a uma dada concentração do substrato, assumindo um Vmax conhecido, que é a taxa máxima a que a reacção pode prosseguir, e KM, a constante de Michaelis. Entretanto, em uma aplicação prática do Michaelis-Menten, V0 é freqüentemente medido, e Vmax é observado como saturação ou platô em um gráfico de dados. Como a concentração do substrato é conhecida, KM é geralmente o valor de interesse calculado.
Para \(K_M\), assumir \(V_0= \dfrac{V_{max}}{2}}:
\}{K_M + } \Etiqueta (2)]
) \{V_{max}}{2} = V_{max} \{3}]
} = {V_{max}}{V_{V_{max}}{2}} \Etiqueta (4) \A constante Michaelis pode ser pensada como a taxa na qual o substrato se torna desvinculado da enzima, o que pode ocorrer ou nos eventos do complexo substrato-enzimático se tornar o produto, ou o substrato se torna desvinculado da enzima. KM pode ser mostrado como uma equação.
\
Onde k-1 é a constante de taxa na qual o substrato se torna desvinculado da enzima, resultando na dissociação do complexo enzimático-substrato, k2 é a constante de taxa na qual o complexo enzimático-substrato desaparece e se transforma em produto, e K1 é a constante de taxa para a formação do complexo enzimático-substrato. Portanto, KM pode ser visto como a taxa de desaparecimento do complexo enzimático do substrato dividido pela taxa de formação do complexo enzimático do substrato, que é o nível em que metade do substrato está ligado à enzima. O KM é um indicador útil para a presença de um inibidor porque podemos procurar mudanças no KM e comparar com o nosso controle (sistemas biológicos que sabemos que têm zero de presença de inibidor). KM é uma variável dependente, e seu valor pode mudar devido a muitas razões, incluindo o nível de pH do sistema, temperatura, ou qualquer outra condição que possa afetar uma reação química. Um pequeno KM indica que o substrato tem uma alta afinidade com a enzima.
A equação de Michaelis-Menten é mais útil para medir a eficiência da enzima se a v0 for plotada contra, como segue:
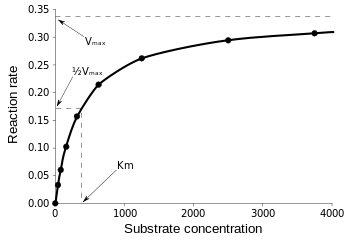
Figure 3: Diagrama da velocidade de reação e constante de Michaelis-Menten. da Wikipedia.
Vmax é a taxa máxima na qual a reação pode correr, independentemente de , o que significa que mesmo se você adicionar mais substrato, a reação não pode ir mais rápido. Isto porque em Vmax todos os sites ativos da enzima estão ocupados. Depois de todas as explicações sobre várias formas de equações cinéticas enzimáticas, chegamos à nossa conclusão de eficiência catalítica. Voltando à Fig 3, temos:
\_o}{\dfrac{k_{-1} + k_2}{k_1} + (k_2) descreve uma reacção irreversível em oposição a uma expressão de equilíbrio, quando comparada com k-1 e k1. k2 aqui também é conhecida como kcat, a eficiência catalítica da enzima. Da discussão anterior, v0 é a taxa de reacção medida, que é a formação do produto ao longo do tempo, pelo que se pode concluir que uma equação pareceria a seguinte:
\}{dt} = k_2_0 \tag{9}]
Onde 0 é a concentração total da enzima.
Também se sabe que o VMax é observado quando todo o complexo enzimático-substrato desaparece e se transforma em produtos, por isso podemos fazer a seguinte suposição:
\_0 {10} {dt} = k_2_0
e após rearranjo, temos esta equação:
\_0} \Esta é a equação para o cálculo da eficiência catalítica, a ser usada após a obtenção de dados de experimentos e após o uso da equação de Michaelis-Menten. Com um kcat maior , a enzima é eficiente porque é necessária menos enzima.