
Anteriormente, a ciência por trás da vida baseada em silício foi determinada como sendo ficção científica. Os compostos de silício são limitados a arranjos cristalinos invariáveis, enquanto que os compostos de carbono, nomeadamente os orgânicos, podem formar uma grande variedade de moléculas de tal forma que qualquer arranjo molecular estável poderia ser formado espontaneamente e que a selecção natural favoreceria aquelas moléculas que suportam a vida. Na competição prebiótica entre o silício e as bases de carbono para a vida, o carbono muito provavelmente dominaria. Mas considere a alternativa onde a água foi substituída por um químico muito familiar, mas improvável. Poderia existir vida num mundo dominado por oceanos, lagos e rios de amoníaco?
A decomposição
Amoníaco é uma substância tóxica para os humanos, insectos e até mesmo bactérias. É o ingrediente principal em alguns solventes industriais e soluções de limpeza e é perigoso para o meio ambiente. A amônia é até mesmo uma parte essencial de uma receita usada para fazer explosivos de alto rendimento. Como poderia algo tão letal como o amoníaco permitir o surgimento e a evolução de organismos vivos? Acredite ou não, o amoníaco tem muitas das mesmas propriedades moleculares que outro composto familiar que é essencial para a vida: a água. Alguns astrobiólogos propõem que a vida pode evoluir num meio amoniacal da mesma forma que a vida na Terra cresceu num meio hidratado. Imagine: a mesma substância que é conhecida por dissolver metais, queimar pele, poluir o ambiente e explodir se misturada impropriamente pode muito bem ser a “Água da Vida” em alguns mundos extraterrestres (e não estou falando de Duna).
Vamos primeiro considerar porque a amônia é um candidato potencial. A amônia e a água são ambas moléculas polares. As electronegatividades dos átomos de oxigénio e azoto são maiores do que a electronegatividade dos seus homólogos de hidrogénio. A diferença de eletronegatividade entre o átomo central (seja nitrogênio ou oxigênio) e os átomos de hidrogênio faz com que as moléculas se tornem polares. O átomo central adota uma carga ligeiramente negativa e os hidrogênios tornam-se ligeiramente positivos. Isto torna o amoníaco e a água solventes poderosos, pois pode dissolver sais e pequenas moléculas polares.
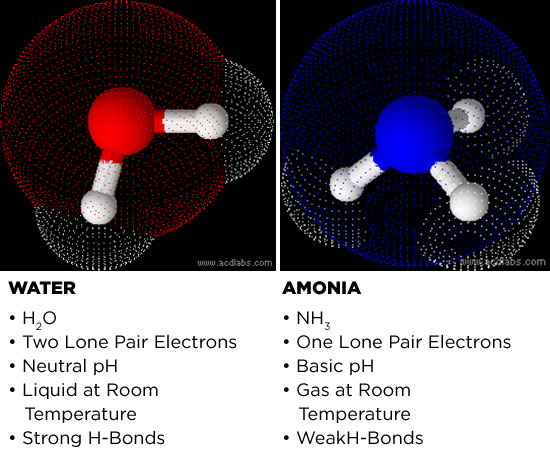
Several das propriedades físicas na água também são compartilhadas pelo amoníaco. Ambos os meios podem conduzir electricidade, embora fraca, e a coordenação de hidrogénios com carga positiva com partes carregadas negativamente em moléculas próximas forma uma das forças intermoleculares mais fortes conhecidas na química: a ligação de hidrogénio. Isto é análogo a tomar um objeto com carga positiva em uma extremidade e ligá-lo eletrostaticamente a uma carga negativa em outro objeto. Em termos de Layman, as ligações de hidrogênio permitem que as moléculas polares adiram muito bem umas às outras, daí a razão pela qual a água tem uma tensão superficial e um ponto de ebulição tão elevados.
Nessa medida, a água é um solvente versátil: ela pode dissolver quase “qualquer coisa”, e a solubilidade é essencial sob condições prebióticas. Ela pode dissolver muitos sais e pequenas moléculas orgânicas polares, como açúcares e aminoácidos. A solubilidade de compostos orgânicos e sais é muito importante para a vida porque amortece as misturas de reação para resistir a mudanças no pH, salinidade e até mesmo estados de oxidação. Um ambiente que melhor suporta a vida é aquele com concentrações estáveis de biomoléculas essenciais.
Outra característica muito importante das propriedades físicas da água é o efeito hidrofóbico de compostos grandes, não polares. As substâncias não polares e polares não se misturam muito bem em solução, razão pela qual as moléculas não polares tendem a conglomerar-se numa solução de moléculas polares. Em outras palavras: moléculas não polares colam-se muito mais umas às outras quando rodeadas por moléculas polares.
O efeito hidrofóbico é crucial no processo de abiogênese porque impulsiona a formação de micelas e proteínas. Sem o efeito hidrofóbico, os lipídios não poderiam recoagular para formar membranas celulares, e os polímeros de aminoácidos não poderiam dobrar para formar proteínas e enzimas funcionais.
Embora o amoníaco possa ter a capacidade de formar ligações de hidrogênio, a sua polaridade palha em comparação com a da água. A amônia é menos capaz de formar ligações de hidrogênio e por conseqüência o efeito hidrofóbico e solubilidade das moléculas orgânicas também são mais fracos.
Isto apresenta problemas de abiogênese. Pequenas moléculas bio-orgânicas não se dissolveriam muito bem em amônia. Proteínas e membranas podem ser instáveis em uma solução de amônia porque elas podem não dobrar corretamente. Membranas e lipídios tornam-se um problema ainda maior; se as membranas celulares não se agruparem o suficiente, então as células podem se romper mesmo em mudanças ambientais leves. A vida seria menos adaptável num ambiente de amônia do que num ambiente de água.
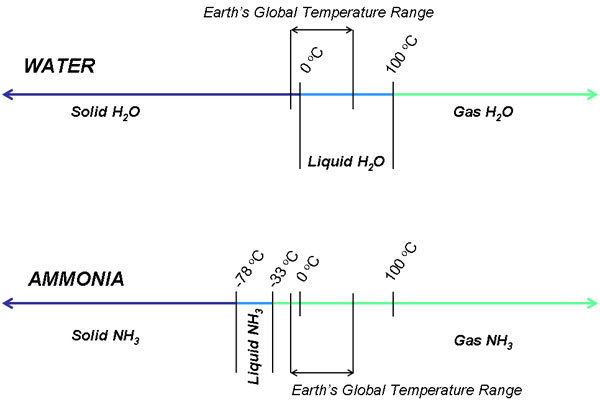
A estabilidade da amônia líquida em si garante preocupação. Teoricamente, a vida só pode ser suportada num líquido, e não num gás ou sólido. Se fervida muito rapidamente ou muito facilmente, os organismos podem achar mais difícil a adaptação ao ambiente. A amônia existe como um gás à temperatura ambiente, enquanto que a água é estável como um líquido a partir de uma faixa de temperatura de 0 a 100 graus Celsius. Isto é devido à força da ligação de hidrogênio: quanto mais fortes as ligações de hidrogênio, mais provável é que as moléculas fiquem juntas o tempo suficiente para se condensarem em um líquido. A amônia tem fraca ligação de hidrogênio, por isso a temperatura deve ser drasticamente reduzida sob pressão atmosférica normal para estabilizar a amônia no estado líquido; estamos falando de um mundo que deve passar por uma Idade do Gelo de 4 bilhões de anos. Um planeta frio e morto dificilmente é um candidato ideal para suportar vida.

Superfície de Andoria.
O ponto de ebulição da amônia é de -33 graus Celsius sob 14,7 psi de pressão, o que significa que a amônia líquida só é estável abaixo dessa temperatura à pressão atmosférica da Terra. Supondo por um momento que a dobra, conglomeração e solubilidade das moléculas orgânicas fossem termodinamicamente prováveis, uma temperatura global teria que ser mantida a partir de -78 graus Celsius e -33 graus a 14.7 psi. Esta é uma faixa muito estreita para que os organismos prosperem; qualquer flutuação climática leve pode na verdade ameaçar a sobrevivência da vida baseada na amônia. O metabolismo dos nutrientes e a replicação dos organismos seria perturbado por períodos de extremos baixos e altos.
A única solução alternativa para este problema é a condensação de um gás usando uma pressão atmosférica mais alta em vez de uma temperatura mais baixa. O gás pode ser condensado a um líquido sob pressões extremas e a temperatura pode ser mantida bem acima do seu ponto de ebulição normal (o que é uma boa notícia para um clima amoniatizado no qual a vida requer calor para prosperar). A amônia condensa-se a um líquido sob uma pressão equivalente a 12,1 mil atmosferas terrestres a cerca de 37 graus Celsius. Infelizmente, ainda temos que descobrir ou colocar a hipótese de que um planeta possa abrigar uma atmosfera tão densa. Vênus, um planeta terrestre com a atmosfera mais densa conhecida atualmente, tem um valor de pressão de 93 bar na superfície; isto dificilmente atende à demanda atmosférica de 12.000 bar. Júpiter, a próxima melhor escolha, tem apenas uma pressão máxima de cerca de 1000 bares no centro do planeta; novamente, dificilmente é ideal para os nossos propósitos. Planetas similares provavelmente não terão pressões atmosféricas suficientemente altas para condensar amônia em um líquido, embora isso não signifique que a vida à base de amônia não possa emergir por algum outro meio.
O Veredicto Final
A vida baseada na amônia não é um tema importante do Star Trek, e eu sempre me perguntei por que nunca foi incluído nos programas. Infelizmente, é pouco provável que seja um Facto Científico. É importante notar que muitas coisas inicialmente consideradas impossíveis na ciência foram eventualmente provadas pela ciência, ou pelo menos em certa medida. Como sempre sublinho nos meus artigos: só porque algo parece altamente improvável, isso não significa que não possa acontecer. Ainda não descobrimos a vida baseada no amoníaco, ou qualquer outra vida em outro lugar, antes que alguém, até mesmo eu, possa dizer que alienígenas amoníacos podem ou não existir. Na ausência de evidência absoluta, a especulação é o melhor que podemos esperar.
Aquela nota, eu gostaria de concluir com este incrível trecho editado do Cosmos de Carl Sagan, no qual ele faz hipóteses de um provável cenário no qual a vida poderia evoluir num mundo como Júpiter.
Apenas porque algo parece improvável de ocorrer, nós sempre ficamos espantados na ciência ao descobrir que às vezes, não importa quão improvável, o o oposto é verdadeiro. Mesmo que organismos baseados no amoníaco possam não existir pelos nossos padrões terrestres, isso não implica de forma alguma que não possa acontecer de outra forma.
Tom Caldwell é Bacharel em Bioquímica pela UCLA. Atualmente ele está trabalhando para um Ph.D. em biologia molecular.