CD44 Introduction
CD44 é uma glicoproteína transmembrana também referida como P-glycoprotein 1. Ela é codificada por um único gene no locus cromossômico 11p13 (Underhill, 1992; Iczkowski, 2010). A CD44 é ubíquamente expressa em todo o corpo e tem um peso molecular de 85-200 kDa (Basakran, 2015). O CD44 padrão (sCD44) é a forma conservada com um peso molecular de cerca de 85-90 kDa de proteína que é feita de transcrição de exons 1-5 e 16-20 que são unidos (Rall e Rustgi, 1995; Rudzki e Jothy, 1997). Os domínios primários do CD44 são o domínio extracelular (ou ectodomain), o domínio transmembrana, e o domínio intracelular / domínio citoplasmático (Iczkowski, 2010). O domínio extracelular interage com o microambiente externo e sente estímulos no microambiente externo (Underhill, 1992). O domínio transmembrana fornece uma via para interagir com co-fatores e proteínas adaptadoras, bem como para direcionar a localização de linfócitos (Underhill, 1992; Williams et al., 2013). O domínio intracelular CD44 (CD44-ICD) tem uma configuração de cauda curta e cauda longa com funções de localização nuclear e mediação de transcrição (Okamoto et al., 2001; Williams et al., 2013). Nosso entendimento atual do duplo papel do CD44 na progressão do câncer está resumido na Figura 1 abaixo.
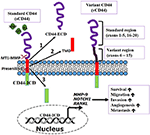
Figura 1. Função do receptor transmembrana CD44. CD44, um receptor multifuncional pode controlar as funções biológicas envolvidas na disseminação e metástase de células cancerosas. O CD44 pode ser clivado sequencialmente por membrana tipo 1 metaloprotease de matriz (MT1-MMP) e depois pré-senilina-1/γ secretase induzida por ligandos de ligação. A clivagem produz (1) fragmento de domínio extracelular (ECD). (2) CD44β como peptídeo ou domínio transmembrana (TMD), e (3) CD44 fragmento de domínio intracelular (ICD). O CD44-ICD transloca para o núcleo para ativar a transcrição de genes importantes na metástase e sobrevivência celular. Adaptado de Thorne et al., 2004.
Isoformas de CD44
Isoformas múltiplas de CD44 podem ser geradas devido à inserção de exões alternativos em locais específicos dentro do domínio extracelular (Cichy e Puré, 2003). A variante isoformas do CD44 (CD44v) compreende de exon 6-15 emendadas em vários sites entre exons 5 e 16 da isoforma padrão (Goodison et al., 1999; Zeilstra et al., 2014). A expressão de isoformas CD44 distintas parece ser necessária para a progressão de tumores humanos (Günthert et al., 1995; Wang et al., 2009). Uma ou várias variantes de emendas e CD44 padrão podem ser expressas em células cancerígenas. Há uma chance maior de expressar isoformas maiores como a do CD44v8-10 em cânceres pancreáticos (Rall e Rustgi, 1995) e CD44v6 em câncer colorretal (Yamane et al., 1999). A expressão do CD44v6 é conhecida como um marcador útil da progressão e prognóstico do tumor no câncer colorretal (Yamane et al., 1999). Em sobrenadantes cultivados de linhas celulares de câncer de próstata derivados de metástase óssea (PC3), CD44 solúvel e variante 6 isoforma (v6) foi identificado, porém não foi identificado na linha celular metastática do câncer de próstata (LNCaP, Stevens et al., 1996; Desai et al., 2009; Gupta et al., 2012). A mudança do padrão CD44 para CD44v6 melhorou a sobrevivência e adesão nas células do câncer de próstata (PC3) (Gupta et al., 2013b). A expressão do CD44v6 no câncer colorretal é aumentada pela expressão das células-tronco cancerosas (Todaro et al., 2014).
CD44 Expressão em células normais e tumorais
A molécula transmembrana de superfície celular ubíqua CD44 é amplamente distribuída nos tecidos normais do adulto e do feto. A isoforma CD44 padrão foi originalmente isolada das células hematopoiéticas, mas agora é encontrada em uma variedade de tecidos, por exemplo, sistema nervoso central, pulmão e epiderme. Em comparação, a distribuição das isoformas da variante CD44 é restrita e expressa em uma seleção de células epiteliais (Sneath e Mangham, 1998). As isoformas com distribuição restrita e seqüência exon podem ter funções diferentes em comparação com a isoforma padrão do CD44. Queratinócitos, macrófagos e células epiteliais selecionadas expressam a variante das isoformas CD44 (CD44v) e estão presentes nos tecidos em vários estágios de desenvolvimento (Sneath e Mangham, 1998). Em tecidos normais, a importância do CD44 é vital na regulação do metabolismo hialurônico, ativação de linfócitos e liberação de citocinas. No entanto, o alvo do CD44 resultando na sua perda leva à interrupção do metabolismo hialurônico, cicatrização de feridas e proliferação de queratinócitos (Yu e Stamenkovic, 1999). Entre muitas das funções do CD44, uma é fazer com que as linhas celulares que não sãoetastáticas se tornem mais metastáticas (Heider et al., 1993). Os detalhes que conferem o potencial metastático do CD44 em malignidades humanas é o tema de uma maior elucidação. As células da próstata que são benignas expressam isoformas CD44 variante 5 (CD44v5), enquanto as células neoplásicas da próstata expressam níveis mais elevados de CD44 (Dhir et al., 1997; Desai et al., 2009; Gupta et al., 2013a). Várias células cancerígenas da mama mostram expressão anormal de CD44 incluindo a expressão heterogênea de isoformas CD44 (Basakran, 2015).
CD44 Interação receptor-ligante
CD44 é conhecida por interagir com vários ligandos e esta interação é crucial para suas muitas funções celulares (Goodison et al., 1999). Existem vários ligandos conhecidos de CD44 incluindo ácido hialurônico (HA), osteopontino (OPN), colágenos e metaloproteinases de matriz (MMPs) (Goodison et al., 1999). Os efeitos do CD44 na migração e crescimento celular dependem da sua especificidade aos ligandos (Weber et al., 1996).
Hyaluronan (HA)
HA é um glicosaminoglicano que é um componente ubíquo da membrana extracelular. É considerado o ligante principal para CD44 e pode ligar isoformas CD44v que são ubíquamente expressas. Através da ligação do CD44, o HA pode ativar citoesqueleto e metaloproteinases de matriz (MMPs) sinalizando a progressão tumoral (Bourguignon et al., 2014). Múltiplas regiões do domínio citoplasmático do CD44 podem promover o aumento da ligação de HA, entretanto, o papel do domínio citoplasmático na mediação da ligação não requer uma sequência específica de aminoácidos nas células do linfoma T (Perschl et al., 1995). HA pode existir em forma de alto peso molecular ou baixo peso molecular devido à clivagem em tamanhos variados. Nas linhas celulares do câncer de mama, o HA de alto peso molecular está envolvido em respostas tumorigênicas, antiangiogênicas e antiinflamatórias. No entanto, o HA de baixo peso molecular tem demonstrado promover a motilidade celular, clivagem CD44 e angiogênese. Portanto, o tamanho do ligante de HA é importante para a função biológica (Louderbough e Schroeder, 2011).
Osteopontin (OPN)
Estudos transversais têm demonstrado uma expressão elevada de OPN em cânceres humanos metastáticos altamente invasivos (Tuck et al., 2007). Integrin αvβ3 e CD44 são receptores para OPN e podem interagir com αvβ3 através de sua sequência funcional de ligação celular arginininina-glicina-ácido asártico (RGD) (Thalmann et al., 1999; Desai et al., 2007). O crescimento e progressão do câncer de próstata é mediado pela sinalização parácrina e autócrina de OPN (Thalmann et al., 1999). A interação CD44-OPN induz a migração das células para fora da corrente sanguínea para locais de inflamação. A migração de células e subsequente invasão em locais distantes envolve uma sequência complexa de eventos (Weber et al., 1996). A variante CD44 isoformas ligam-se à OPN independentemente das sequências de RGD presentes no domínio N-terminal do CD44 (Katagiri et al., 1999). A ligação de OPN às variantes CD44/beta1 contendo integrina promove propagação celular, motilidade e comportamento quimiotáxico no carcinoma pancreático de ratos (Katagiri et al., 1999). A OPN aumenta a expressão superficial do CD44 padrão (sCD44) nos osteoclastos e tanto o sCD44 como as isoformas variantes no melanoma humano e células PC3 (Chellaiah et al., 2003; Samanna et al., 2006; Desai et al., 2007). Foi observada regulação da expressão superficial de osteopontino de CD44v6 e sCD44 em células cancerosas de mama e hepatocelulares (Gao et al., 2003; Khan et al., 2005).
Matrix Metalloproteases (MMPs)
Matrix metalloproteinases (MMPs) são importantes proteínas de matriz extracelular que estão envolvidas na degradação da matriz extracelular. Elas também são importantes durante o desenvolvimento, cicatrização de feridas, reabsorção óssea e angiogênese (Paiva e Granjeiro, 2014). Há evidências sugerindo que o MMP-9 e o CD44 se associam em células tumorais de camundongos e humanos resultando na localização da atividade do MMP9 na superfície celular (Yu e Stamenkovic, 1999; Gupta et al., 2013a). A interação do CD44 e a forma proteolítica do MMP-9 está particularmente envolvida na invasão de células cancerosas da próstata (PC3) derivadas de metástases ósseas (Desai et al., 2007). Portanto, a capacidade do CD44 de localizar MMP-9 proteolítico ativo na superfície celular tumoral é importante para a invasão tumoral (Yu e Stamenkovic, 1999).
CD44 Papel na Migração/Invasão, Angiogênese e Metástase Óssea
Migração e Invasão
Receptor CD44 tem o potencial de integrar atividades adesivas e de sinalização para modular os processos de migração/invasão durante a progressão do câncer (Lokeshwar et al, 1995). Os mecanismos pelos quais os receptores CD44 medeiam a migração, proliferação, sobrevivência das células tumorais através da sinalização mediada por HA têm sido amplamente estudados (Bourguignon et al., 1998, 2001, 2004; Kuniyasu et al., 2001; Wang e Bourguignon, 2006a,b; Wang et al., 2009). Alterações na forma celular e formação de estruturas adesivas são reguladas pela regulação dinâmica do citoesqueleto actínico. A regulação dinâmica do citoesqueleto de actina e as estruturas especializadas envolvidas na migração são reguladas pela localização temporal e espacial das proteínas de ligação à actina (Chellaiah et al., 2000; Linder e Aepfelbacher, 2003; Desai et al., 2008). A expressão superficial da CD44 juntamente com sua interação com a metaloproteinase matriz 9 (MMP9) na superfície da célula resulta na secreção da MMP9 ativa, migração e invasão das células PC3 (Desai et al., 2007, 2008; Gupta et al., 2013a). A interrupção da interação CD44/MMP9 na superfície da célula reduz a migração e invasão das células PC3. Quando o MMP9 é derrubado, a expressão CD44 muda para a variante 6 (v6) isoforma. Isto resulta em um fenótipo menos invasivo devido à falta de expressão do sCD44 e incapacidade de formar invadopódios (Gupta et al., 2013a). A expressão CD44v6 está inversamente correlacionada com o estágio patológico e a progressão da doença e positivamente correlacionada com a sobrevida livre de PSA no câncer de próstata (Ekici et al., 2002). Entretanto, a expressão do CD44v6 em células não-metastáticas do carcinoma de rato demonstrou convertê-las em células metastáticas e promover a progressão tumoral (Günthert et al., 1991; Seiter et al., 1993). Além disso, foi demonstrado que o CD44v3 upregula a função do citoesqueleto através da anquilina para ativar o complexo actomiostático contrátil, a fim de mediar a migração celular na linha celular do carcinoma escamoso da cabeça e pescoço. A transferência do cDNA v3 para linhas celulares não-expressoras também resultou em um aumento significativo na migração celular, mas não na proliferação (Franzmann et al., 2001; Wang et al., 2007). As variantes CD44 também demonstraram funcionar como um co-receptor para a ativação de tirosinases receptoras tumorais promotoras de crescimento (Orian-Rousseau et al., 2002, 2007).
Angiogênese
A formação de novos vasos sanguíneos (angiogênese) é necessária para que a célula tumoral se dissemine e migre para órgãos distantes. Estudos anteriores identificaram a expressão CD44 em células endoteliais (Liesveld et al., 1994; Xu et al., 1994) e isto controla a formação de vasos sanguíneos (Trochon et al., 1996; Savani et al., 2001). A inibição do CD44 resulta, portanto, na formação deficiente de redes semelhantes a vasos (Savani et al., 2001; Cao et al., 2006). Células endoteliais foram encontradas em maior número nos tecidos com câncer de próstata em relação aos tecidos normais (Wang et al., 2013). Quando foram usados ratos CD44-null para estudar respostas angiogénicas in vivo, a cicatrização e vascularização da ferida foram ambas prejudicadas nos implantes matrigel. Portanto, a formação de metástases também está ligada à expressão vascular CD44 (Cao et al., 2006). A adesão das células cancerígenas à vasculatura e a expressão aumentada do CD44 (CD44s e/ou CD44v) por fatores angiogênicos (por exemplo, VEGF) produzidos por células tumorais pode levar a extravasamento facilitado via angiogênese. Além disso, o papel do CD44 na angiogênese tumoral é reforçado pela sua ligação com HA imobilizada (Griffioen et al., 1997). As variantes CD44 têm domínios de ligação para vários fatores de crescimento, incluindo fator de crescimento endotelial vascular (VEGF), fator de crescimento fibroblasto básico de ligação à heparina e fator de crescimento epidérmico de ligação à heparina (Bourguignon et al., 1998, 1999; Kalish et al., 1999). A análise do microarray tecidual e lisados de células tumorais da próstata mostrou que a expressão OPN e VEGF foi mais pronunciada no câncer de próstata do que nos tecidos benignos ou normais da próstata. Foi sugerido que um aumento no número de microvasos e expressão de CD44 poderia ser útil como marcadores diagnósticos de metástase do câncer de mama (Ozer et al., 1997).
Metástase óssea
A capacidade das células cancerosas da próstata e da mama de metástase óssea baseia-se na sua capacidade de parar, aderir e extravasar através do endotélio da medula óssea na matriz óssea subjacente (Draffin et al., 2003). Nas células cancerosas da próstata, a adesão seletiva dessas células ao epitélio da medula óssea baseia-se no papel das propriedades adesivas dos receptores de integrina. As células do câncer de próstata têm estado envolvidas em forte interação com as células endoteliais da medula óssea (Draffin et al., 2004). Existe atualmente uma dissensão entre dados clínicos e experimentais na literatura sobre a importância do sCD44 na progressão da doença do câncer de mama. Um estudo recente sugere que modelos de câncer de mama mostram a expressão de isoformas padrão e variantes do CD44 que aumentam a progressão da doença e o comportamento metastático (McFarlane et al., 2015). HA e CD44 co-localizam no epitélio sinusoidal da medula óssea, que é um local de metástase do câncer de mama. Isto sugere a contribuição do HA-CD44 para a eficiência da metástase distante no osso das células cancerosas da mama (McFarlane et al., 2015). As células que produzem baixos níveis de CD44 têm menor capacidade de formar esfera tumoral in vitro. Além disso, o CD44 é um marcador para células-tronco cancerígenas (Jaggupilli e Elkord, 2012; Cho et al., 2015; Stivarou e Patsavoudi, 2015) e o CD44 expressando células-tronco cancerígenas aumenta a probabilidade de metástases ósseas através de sua interação com HA. Portanto, a interação CD44-HA poderia ser um alvo potencial para a redução das metástases ósseas. A sinalização de CD44 nas células cancerosas da próstata também tem demonstrado regular as proteínas-chave (ou seja, RANKL e MMP9) envolvidas na diferenciação dos osteoclastos e metástases tumorais (Gupta et al., 2012). Runx2 é um fator mestre de transcrição com papéis importantes na diferenciação dos osteoblastos. A transcrição de muitos fatores relacionados à osteoblasto e formação óssea como OPN, osteocalcina e colágeno tipo I são regulados por Runx2 (Akech et al., 2010).
Role of CD44 as a Transcriptional Factor
Clivagem proteolítica que ocorre no domínio extracelular liberando o CD44 solúvel há muito tempo tem sido reconhecida. Entretanto, estudos recentes têm mostrado que o CD44 pode sofrer um processamento proteolítico seqüencial adicional por metaloproteases de matriz de membrana tipo 1 (MT1-MMP) e presenilina-1/y-secretase para produzir os fragmentos de domínio extracelular e de domínio intracelular (CDI). A clivagem pré-senilina-1/y-secretase ocorre no sítio intramembrana liberando dois produtos de clivagem de ~25 e ~16 kDa. O CDI de 12 kDa transloca para o núcleo para ativar a transcrição de várias proteínas incluindo o próprio CD44 (Okamoto et al., 2001; Nagano e Saya, 2004; Thorne et al., 2004). Consequentemente, se esta clivagem pode ser inibida através de inibidores de metaloprotease, ela pode servir como uma forma terapêutica de prevenir a progressão tumoral e metástase (Nagano e Saya, 2004). A translocação do CD44-ICD para o núcleo inicia o processo de regulação transcripcional através da sua ligação a um novo elemento promotor de resposta, regulando a transcrição de vários genes que estão envolvidos na sobrevivência celular durante o estresse, inflamação, glicólise oxidativa, invasão tumoral (Okamoto et al., 2001; Miletti-González et al., 2012). Isto sugere um mecanismo para o papel multifuncional do CD44 na metástase e metabolismo das células cancerosas (Miletti-González et al., 2012). A translocação nuclear do domínio intracelular também mostrou interagir com fatores de estenose (Cho et al., 2015). O CD44-ICD está ligado à regulação do gene MMP-9 nas células cancerosas da próstata e mama através de sua interação com o fator transcripcional RUNX2 (Miletti-González et al., 2012).
Conclusões
A glicoproteína multifuncional CD44 pode sofrer eventos alternativos de emenda para produzir isoformas da variante CD44 que são mais restritas em sua distribuição em comparação com as isoformas CD44 padrão (Rall e Rustgi, 1995). A proteína de superfície celular expressa ubíquamente está envolvida principalmente na agregação, migração e ativação das células, estas funções são mediadas através das propriedades adesivas do CD44 (Heider et al., 1993). Inicialmente descrita para células estaminais hematopoiéticas, desde então tem sido confirmada como um marcador de células estaminais cancerosas (Bourguignon et al., 1998). O CD44 interage com uma variedade de ligandos e pode sofrer um processamento proteolítico sequencial resultando na geração de CD44-ICD. Sabe-se que o CD44-ICD é translocado para o núcleo para ativar a transcrição do gene (Okamoto et al., 1999). Embora as informações aqui fornecidas forneçam uma revisão abrangente da literatura até o momento, existe algum discurso sobre o efeito do CDI como o principal modulador de eventos metastáticos em cânceres. Para substanciar ainda mais o efeito do CD44 na metástase, será necessário completar a pesquisa sobre as especificidades para abordar este assunto.
Contribuições dos autores
LS e MC redigiram o manuscrito e contribuíram igualmente na edição e reescrita do conteúdo final.
Fundação
Este trabalho foi apoiado por uma bolsa de pesquisa para MC do Instituto Nacional de Saúde – Instituto Nacional de Artrite e Doenças Musculoesqueléticas e Cutâneas (5R01AR066044).
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Akech, J., Wixted, J. J., Bedard, K., van der Deen, M., Hussain, S., Guise, T. A., et al. (2010). Runx2 association with progression of prostate cancer in patients: mechanisms mediating bone osteolysis and osteoblastic lesions metastatic lesions. Oncogene 29, 811-821. doi: 10.1038/onc.2009.389
PubMed Abstract | CrossRef Full Text | Google Scholar
Basakran, N. S. (2015). CD44 como um potencial marcador diagnóstico do tumor. Saudi Med. J. 36, 273-279. doi: 10.15537/smj.2015.3.9622
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Gunja-Smith, Z., Iida, N., Zhu, H. B., Young, L. J., Muller, W. J., et al. (1998). O CD44v(3,8-10) está envolvido na migração de células tumorais mediadas por citoesqueleto e associação de metaloproteinase matricial (MMP-9) em células metastáticas de câncer de mama. J. Célula. Physiol. 176, 206-215. doi: 10.1002/(SICI)1097-4652(199807)176:1<206::AID-JCP22>3.0.CO;2-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Shiina, M., and Li, J. J. (2014). A interação Hyaluronan-CD44 promove sinalização oncogênica, funções de microRNA, quimiorresistência e resistência à radiação em células-tronco cancerígenas levando à progressão do tumor. Adv. Cancer Res. 123, 255-275. doi: 10.1016/B978-0-12-800092-2.00010-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Singleton, P. A., Diedrich, F., Stern, R., and Gilad, E. (2004). A interação CD44 com o trocador Na+-H+ (NHE1) cria microambientes ácidos que levam à ativação de hialuronidase-2 e catepsina B e invasão de células tumorais mamárias. J. Biol. Quimio. 279, 26991-27007. doi: 10.1074/jbc.M311838200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Zhu, H., Shao, L., and Chen, Y. W. (2001). A interação CD44 com c-Src kinase promove a função do citoesqueleto mediado pela cortactina e a migração de células tumorais ovarianas dependentes de ácido hialurônico. J. Biol. Chem. 276, 7327-7336. doi: 10.1074/jbc.M006498200
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourguignon, L. Y., Zhu, H., Shao, L., Zhu, D., and Chen, Y. W. (1999). Rho-kinase (ROK) promove a interação CD44v(3,8-10)-ankyrin e a migração de células tumorais em células metastáticas do câncer de mama. Células Motil. Cytoskeleton 43, 269-287. doi: 10.1002/(SICI)1097-0169(1999)43:4<269::AID-CM1>3.0.CO;2-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Cao, G., Savani, R. C., Fehrenbach, M., Lyons, C., Zhang, L., Coukos, G., et al. (2006). Envolvimento do CD44 endotelial durante a angiogênese in vivo. Am. J. Pathol. 169, 325-336. doi: 10.2353/ajpath.2006.060206
PubMed Abstract | CrossRef Full Text | Google Scholar
Chellaiah, M. A., Kizer, N., Biswas, R., Alvarez, U., Strauss-Schoenberger, J., Rifas, L., et al. (2003). A deficiência de osteopontino produz disfunção osteoclasta devido à redução da expressão superficial CD44. Mol. Biol. Cell 14, 173-189. doi: 10.1091/mbc.E02-06-0354
PubMed Abstract | CrossRef Full Text | Google Scholar
Chellaiah, M., Kizer, N., Silva, M., Alvarez, U., Kwiatkowski, D., and Hruska, K. A. (2000). A deficiência de Gelsolin bloqueia a montagem do podossoma e produz aumento de massa óssea e força. J. Cell Biol. 148, 665-678. doi: 10.1083/jcb.148.4.665
PubMed Abstract | CrossRef Full Text | Google Scholar
Cho, Y., Lee, H. W., Kang, H. G., Kim, H. Y., Kim, S. J., e Chun, K. H. (2015). O domínio intracelular CD44 clivado suporta a ativação de fatores de estaminais e promove a tumorigenese do câncer de mama. Oncotarget 6, 8709-8721. doi: 10.18632/oncotarget.3325
PubMed Abstract | CrossRef Full Text | Google Scholar
Cichy, J., and Puré, E. (2003). A libertação do CD44. J. Cell Biol. 161, 839-843. doi: 10.1083/jcb.200302098
PubMed Abstract | CrossRef Full Text | Google Scholar
Desai, B., Ma, T., and Chellaiah, M. A. (2008). Invadopodia e degradação da matriz, uma nova propriedade das células cancerosas da próstata durante a migração e invasão. J. Biol. Chem. 283, 13856-13866. doi: 10.1074/jbc.M709401200
PubMed Abstract | CrossRef Full Text | Google Scholar
Desai, B., Ma, T., Zhu, J., e Chellaiah, M. A. (2009). Characterization of the expression of variant and standard CD44 in prostate cancer cells: identification of the possible molecular mechanism of CD44/MMP9 complex formation on the cell surface. J. Célula. Biochem. 108, 272-284. doi: 10.1002/jcb.22248
PubMed Abstract | CrossRef Full Text | Google Scholar
Desai, B., Rogers, M. J., e Chellaiah, M. A. (2007). Mecanismos de osteopontino e CD44 como princípios metastáticos em células cancerosas da próstata. Mol. Cancer 6:18. doi: 10.1186/1476-4598-6-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Dhir, R., Gau, J. T., Krill, D., Bastacky, S., Bahnson, R. R., Cooper, D. L., et al. (1997). CD44 expressão em próteses humanas benignas e neoplásicas. Mol. Diagnóstico. 2, 197-204. doi: 10.1016/S1084-8592(97)80029-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Draffin, J. E., Hill, A., Johnston, P. G., and Waugh, D. J. (2003). CD44 Expressão nas células cancerosas da próstata correlacionada com a adesão às células endoteliais da medula óssea. Clin. Cancer Res. 9, 6181S-6181S.
Google Scholar
Draffin, J. E., McFarlane, S., Hill, A., Johnston, P. G., and Waugh, D. J. (2004). CD44 potencializa a aderência de células metastáticas da próstata e câncer de mama às células endoteliais da medula óssea. Cancer Res. 64, 5702-5711. doi: 10.1158/0008-5472.CAN-04-0389
PubMed Abstract | CrossRef Full Text | Google Scholar
Ekici, S., Ayhan, A., Kendi, S., e Ozen, H. (2002). Determination of prognosis in patients with prostate cancer treated with radical prostatectomy: prognostic value of CD44v6 score. J. Urol. 167, 2037-2041. doi: 10.1016/S0022-5347(05)65078-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Franzmann, E. J., Weed, D. T., Civantos, F. J., Goodwin, W. J., e Bourguignon, L. Y. (2001). Um novo CD44 v3 isoforma está envolvido na progressão do carcinoma espinocelular de cabeça e pescoço. Otorrinolaringol. Head Neck Surg. 124, 426-432. doi: 10.1067/mhn.2001.114674
PubMed Abstract | CrossRef Full Text | Google Scholar
Gao, C., Guo, H., Downey, L., Marroquin, C., Wei, J., e Kuo, P. C. (2003). Expressão CD44v6 dependente de osteopontino e adesão celular em células HepG2. Carcinogênese 24, 1871-1878. doi: 10.1093/carcin/bgg139
PubMed Abstract | CrossRef Full Text | Google Scholar
Goodison, S., Urquidi, V., e Tarin, D. (1999). CD44 moléculas de aderência celular. Mol. Pathol. 52, 189-196. doi: 10.1136/mp.52.4.189
PubMed Abstract | CrossRef Full Text | Google Scholar
Griffioen, A. W., Coenenen, M. J., Damen, C. A., Hellwig, S. M., van Weering, D. H., Vooys, W., et al. (1997). CD44 está envolvido na angiogênese tumoral; um antígeno de ativação em células endoteliais humanas. Blood 90, 1150-1159.
PubMed Abstract | Google Scholar
Günthert, U., Hofmann, M., Rudy, W., Reber, S., Zöller, M., Haussmann, I., et al. (1991). Uma nova variante da glicoproteína CD44 confere um potencial metastático às células cancerígenas de ratos. Cell 65, 13-24. doi: 10.1016/0092-8674(91)90403-L
PubMed Abstract | CrossRef Full Text | Google Scholar
Günthert, U., Stauder, R., Mayer, B., Terpe, H. J., Finke, L., and Friedrichs, K. (1995). As isoformas da variante CD44 estão envolvidas na progressão do tumor humano? Sobreversão do cancro. 24, 19-42.
PubMed Abstract | Google Scholar
Gupta, A., Cao, W., e Chellaiah, M. A. (2012). Integrar αvβ3 e vias CD44 nas células metastáticas do câncer de próstata suportam a osteoclastogênese por meio de um eixo de sinalização ligando Runx2/Smad 5/receptor ativador de NF-κB. Mol. Cancer 11:66. doi: 10.1186/1476-4598-11-66
PubMed Abstract | CrossRef Full Text | Google Scholar
Gupta, A., Cao, W., Sadashivaiah, K., Chen, W., Schneider, A., e Chellaiah, M. A. (2013a). Fenótipo celular não invasivo promissor em células cancerosas da próstata, knockdown da metaloproteinase matriz 9. ScientificWorldJournal 2013:493689. doi: 10.1155/2013/493689
PubMed Abstract | CrossRef Full Text | Google Scholar
Gupta, A., Zhou, C. Q., e Chellaiah, M. A. (2013b). Osteopontin e MMP9: associações com expressão/Secreção VEGF e angiogênese em células PC3 do câncer de próstata. Cancers 5, 617-638. doi: 10.3390/cancers5020617
PubMed Abstract | CrossRef Full Text | Google Scholar
Heider, K. H., Hofmann, M., Hors, E., van den Berg, F., Ponta, H., Herrlich, P., et al. (1993). Um homólogo humano da variante CD44 associada à metástase de rato é expresso em carcinomas colorrectais e pólipos adenomatosos. J. Cell Biol. 120, 227-233. doi: 10.1083/jcb.120.1.227
PubMed Abstract | CrossRef Full Text | Google Scholar
Iczkowski, K. A. (2010). A molécula de adesão celular CD44: seus papéis funcionais no câncer de próstata. Am. J. Transl. Res. 3, 1-7.
PubMed Abstract | Google Scholar
Jaggupilli, A., e Elkord, E. (2012). Significância do CD44 e CD24 como marcadores de células-tronco cancerígenas: uma ambiguidade duradoura. Clin. Dev. Immunol. 2012:708036. doi: 10.1155/2012/708036
PubMed Abstract | CrossRef Full Text | Google Scholar
Kalish, E. D., Iida, N., Moffat, F. L., e Bourguignon, L. Y. (1999). Uma nova isoforma contendo CD44V3 está envolvida no crescimento e migração de células tumorais durante a progressão do carcinoma da mama humana. Frente. Biosci. 4, A1-A8. doi: 10.2741/Kalish
PubMed Abstract | CrossRef Full Text | Google Scholar
Katagiri, Y. U., Sleeman, J., Fujii, H., Herrlich, P., Hotta, H., Tanaka, K., et al. (1999). As variantes CD44, mas não as CD44 cooperam com integrinas beta1 para permitir que as células se liguem à osteopontino independentemente do ácido argino-glicino-aspártico, estimulando assim a motilidade celular e a quimiotaxia. Cancer Res. 59, 219-226.
Google Scholar
Khan, S. A., Cook, A. C., Kappil, M., Günthert, U., Chambers, A. F., Tuck, A. B., et al. (2005). A expressão da superfície celular melhorada da variante CD44 (v6, v9) por osteopontino nas células epiteliais do cancro da mama facilita a migração das células tumorais: novo regulamento pós-tradicional, pós-tradicional. Clin. Exp. Metastasis 22, 663-673. doi: 10.1007/s10585-006-9007-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuniyasu, H., Oue, N., Tsutsumi, M., Tahara, E., e Yasui, W. (2001). O sulfato de heparafato aumenta a invasão pelas linhas celulares do carcinoma do cólon humano através da expressão da variante CD44 exon 3. Clin. Cancer Res. 7, 4067-4072.
PubMed Abstract | Google Scholar
Liesveld, J. L., Frediani, K. E., Harbol, A. W., DiPersio, J. F., e Abboud, C. N. (1994). Caracterização da aderência de células CD34+ normais e leucêmicas a monocamadas endoteliais. Leucemia 8, 2111-2117.
PubMed Abstract | Google Scholar
Linder, S., e Aepfelbacher, M. (2003). Podossomas: pontos quentes de adesão de células invasivas. Trends Cell Biol. 13, 376-385. doi: 10.1016/S0962-8924(03)00128-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lokeshwar, B. L., Lokeshwar, V. B., e Block, N. L. (1995). Expressão do CD44 em células cancerosas da próstata: associação com proliferação celular e potencial invasivo. Anticancer Res. 15, 1191-1198.
PubMed Abstract | Google Scholar
Louderbough, J. M., e Schroeder, J. A. (2011). Entendendo a natureza dual do CD44 na progressão do câncer de mama. Mol. Cancer Res. 9, 1573-1586. doi: 10.1158/1541-7786.MCR-11-0156
PubMed Abstract | CrossRef Full Text | Google Scholar
McFarlane, S., Coulter, J. A., Tibbits, P., O’Grady, A., McFarlane, C., Montgomery, N., et al. (2015). CD44 aumenta a eficiência da metástase distante do câncer de mama. Oncotarget 6, 11465-11476. doi: 10.18632/oncotarget.3410
PubMed Abstract | CrossRef Full Text | Google Scholar
Miletti-González, K. E., Murphy, K., Kumaran, M. N., Ravindranath, A. K., Wernyj, R. P., Kaur, S., et al. (2012). Identificação da função do domínio intracitoplasmático CD44 (CD44-ICD): modulação da transcrição da metaloproteinase matriz 9 (MMP-9) através de um novo elemento de resposta do promotor. J. Biol. Quimio. 287, 18995-19007. doi: 10.1074/jbc.M111.318774
PubMed Abstract | CrossRef Full Text | Google Scholar
Nagano, O., e Saya, H. (2004). Mecanismo e significado biológico da clivagem CD44. Cancer Sci. 95, 930-935. doi: 10.1111/j.1349-7006.2004.tb03179.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Okamoto, I., Kawano, Y., Murakami, D., Sasayama, T., Araki, N., Miki, T., et al. (2001). Lançamento proteolítico do domínio intracelular CD44 e seu papel no caminho de sinalização do CD44. J. Cell Biol. 155, 755-762. doi: 10.1083/jcb.200108159
PubMed Abstract | CrossRef Full Text | Google Scholar
Okamoto, I., Kawano, Y., Tsuiki, H., Sasaki, J., Nakao, M., Matsumoto, M., et al. (1999). A clivagem CD44 induzida por uma metaloprotease associada à membrana desempenha um papel crítico na migração das células tumorais. Oncogene 18, 1435-1446. doi: 10.1038/sj.onc.1202447
PubMed Abstract | CrossRef Full Text | Google Scholar
Orian-Rousseau, V., Chen, L., Sleeman, J. P., Herrlich, P., e Ponta, H. (2002). CD44 é necessário para dois passos consecutivos na sinalização HGF/c-Met. Genes Dev. 16, 3074-3086. doi: 10.1101/gad.242602
PubMed Abstract | CrossRef Full Text | Google Scholar
Orian-Rousseau, V., Morrison, H., Matzke, A., Kastilan, T., Pace, G., Herrlich, P., et al. (2007). A ativação de Ras induzida por fator de crescimento de Hepatócitos requer proteínas de ERM ligadas tanto a CD44v6 quanto a F-actin. Mol. Biol. Cell 18, 76-83. doi: 10.1091/mbc.E06-08-0674
PubMed Abstract | CrossRef Full Text | Google Scholar
Ozer, E., Canda, T., e Kurtodlu, B. (1997). O papel da angiogênese, lamina e expressão CD44 no comportamento metastático de carcinomas mamários invasivos de baixo grau em estágio inicial. Câncer de Lett. 121, 119-123. doi: 10.1016/S0304-3835(97)00346-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Paiva, K. B., e Granjeiro, J. M. (2014). Remodelação e desenvolvimento do tecido ósseo: foco nas funções da metaloproteinase matricial. Arco. Biochem. Biofísica. 561, 74-87. doi: 10.1016/j.abb.2014.07.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Perschl, A., Lesley, J., English, N., Trowbridge, I., and Hyman, R. (1995). Papel do domínio citoplasmático CD44 na ligação hialuroniana. Eur. J. Immunol. 25, 495-501. doi: 10.1002/eji.1830250228
PubMed Abstract | CrossRef Full Text | Google Scholar
Rall, C. J., e Rustgi, A. K. (1995). CD44 expressão isoforma em adenocarcinoma pancreático primário e metastático. Cancer Res. 55, 1831-1835.
PubMed Abstract | Google Scholar
Rudzki, Z., e Jothy, S. (1997). CD44 e a aderência de células neoplásicas. Mol. Pathol. 50, 57-71. doi: 10.1136/mp.50.2.57
PubMed Abstract | CrossRef Full Text | Google Scholar
Samanna, V., Wei, H., Ego-Osuala, D., e Chellaiah, M. A. (2006). A sinalização externa dependente de Alfa-V é necessária para a regulação da expressão da superfície CD44, secreção MMP-2 e migração celular por osteopontino em células de melanoma humano. Exp. Cell Res. 312, 2214-2230. doi: 10.1016/j.yexcr.2006.03.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Savani, R. C., Cao, G., Pooler, P. M., Zaman, A., Zhou, Z., e DeLisser, H. M. (2001). Envolvimento diferencial dos receptores hialuronianos (HA) CD44 e receptor para motilidade mediada por HA na função celular endotelial e angiogênese. J. Biol. Chem. 276, 36770-36778. doi: 10.1074/jbc.M102273200
PubMed Abstract | CrossRef Full Text | Google Scholar
Seiter, S., Arch, R., Reber, S., Komitowski, D., Hofmann, M., Ponta, H., et al. (1993). Prevenção da formação de metástases tumorais por anti-variantes CD44. J. Exp. Med. 177, 443-455. doi: 10.1084/jem.177.2.443
PubMed Abstract | CrossRef Full Text | Google Scholar
Sneath, R. J., and Mangham, D. C. (1998). A estrutura e função normal do CD44 e seu papel na neoplasia. Mol. Pathol. 51, 191-200. doi: 10.1136/mp.51.4.191
PubMed Abstract | CrossRef Full Text | Google Scholar
Stevens, J. W., Palechek, P. L., Griebling, T. L., Midura, R. J., Rokhlin, O. W., e Cohen, M. B. (1996). Expressão de isoformas CD44 em linhas de células tumorais da próstata humana. Prostate 28, 153-161. doi: 10.1002/(SICI)1097-0045(199603)28:3<153::AID-PROS2>3.0.CO;2-G
PubMed Abstract | CrossRef Full Text | Google Scholar
Stivarou, T., e Patsavoudi, E. (2015). Moléculas extracelulares envolvidas na invasão das células cancerosas. Cancers 7, 238-265. doi: 10.3390/cancers7010238
PubMed Abstract | CrossRef Full Text | Google Scholar
Thalmann, G. N., Sikes, R. A., Devoll, R. E., Kiefer, J. A., Markwalder, R., Klima, I., et al. (1999). Osteopontin: possível papel na progressão do câncer de próstata. Clin. Cancer Res. 5, 2271-2277.
PubMed Abstract | Google Scholar
Thorne, R. F., Legg, J. W., e Isacke, C. M. (2004). O papel dos domínios transmembrana e citoplasmática CD44 na coordenação de eventos adesivos e de sinalização. J. Cell Sci. 117(Pt 3), 373-380. doi: 10.1242/jcs.00954
PubMed Abstract | CrossRef Full Text | Google Scholar
Todaro, M., Gaggianesi, M., Catalano, V., Benfante, A., Iovino, F., Biffoni, M., et al. (2014). CD44v6 é um marcador de células estaminais cancerosas constitutivas e reprogramadas que conduzem à metástase do cancro do cólon. Cell Stem Cell 14, 342-356. doi: 10.1016/j.stem.2014.01.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Trochon, V., Mabilat, C., Bertrand, P., Legrand, Y., Smadja-Joffe, F., Soria, C., et al. (1996). Evidência de envolvimento do CD44 na proliferação celular endotelial, migração e angiogênese in vitro. Int. J. Cancer 66, 664-668. doi: 10.1002/(SICI)1097-0215(19960529)66:5<664::AID-IJC14>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Tuck, A. B., Chambers, A. F., e Allan, A. L. (2007). Osteopontin overexpression in breast cancer: knowledge gained and possible implications for clinical management. J. Cell. Biochem. 102, 859-868. doi: 10.1002/jcb.21520
PubMed Abstract | CrossRef Full Text | Google Scholar
Underhill, C. (1992). CD44: O receptor hialuronano. J. Cell. Sci. 103(Pt 2), 293-298.
PubMed Abstract | Google Scholar
Wang, S. J., e Bourguignon, L. Y. (2006a). Hyaluronan e a interação entre CD44 e o receptor do fator de crescimento epidérmico na sinalização oncogênica e resistência à quimioterapia no câncer de cabeça e pescoço. Arco. Otorrinolaringol. Head Neck Surg. 132, 771-778. doi: 10.1001/archotol.132.7.771
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, S. J., e Bourguignon, L. Y. (2006b). Hyaluronan-CD44 promove a sinalização fosfolipase C-mediada Ca2+ e a resistência cisplatina no câncer de cabeça e pescoço. Arco. Otorrinolaringol. Head Neck Surg. 132, 19-24. doi: 10.1001/archotol.132.1.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, S. J., Wong, G., de Heer, A. M., Xia, W., e Bourguignon, L. Y. (2009). CD44 variante isoformas na progressão do carcinoma espinocelular de cabeça e pescoço. Laringoscópio 119, 1518-1530. doi: 10.1002/lary.20506
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, S. J., Wreesmann, V. B., e Bourguignon, L. Y. (2007). Associação de isoformas contendo CD44 V3 com crescimento de células tumorais, migração, expressão de metaloproteinase matricial e metástase linfonodal no câncer de cabeça e pescoço. Head Neck 29, 550-558. doi: 10.1002/hed.20544
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, X., Lee, S. O., Xia, S., Jiang, Q., Luo, J., Li, L., et al. (2013). As células endoteliais melhoram a metástase do câncer de próstata via IL-6 → androgen receptor → TGF-β → MMP-9 sinais. Mol. Cancer Ther. 12, 1026-1037. doi: 10.1158/1535-7163.MCT-12-0895
PubMed Abstract | CrossRef Full Text | Google Scholar
Weber, G. F., Ashkar, S., Glimcher, M. J., e Cantor, H. (1996). Interação Receptor-ligante entre CD44 e osteopontino (Eta-1). Science 271, 509-512. doi: 10.1126/science.271.5248.509
PubMed Abstract | CrossRef Full Text | Google Scholar
Williams, K., Motiani, K., Giridhar, P. V., e Kasper, S. (2013). CD44 integra sinalização em células estaminais normais, células estaminais cancerosas e nichos (pré)metastáticos. Exp. Biol. Med. 238, 324-338. doi: 10.1177/1535370213480714
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, Y., Swerlick, R. A., Sepp, N., Bosse, D., Ades, E. W., e Lawley, T. J. (1994). Characterization of expression and modulation of cell adhesion molecules on an immortalized human dermal microvascular endothelial cell line (HMEC-1). J. Invest. Dermatol. 102, 833-837. doi: 10.1111/1523-1747.ep12382086
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamane, N., Tsujitani, S., Makino, M., Maeta, M., e Kaibara, N. (1999). Variante 6 do CD44 solúvel como indicador de prognóstico em pacientes com câncer colorretal. Oncologia 56, 232-238. doi: 10.1159/000011970
PubMed Abstract | CrossRef Full Text | Google Scholar
Yu, Q., e Stamenkovic, I. (1999). A localização da metaloproteinase matriz 9 na superfície celular fornece um mecanismo para a invasão tumoral mediada por CD44. Genes Dev. 13, 35-48. doi: 10.1101/gad.13.1.35
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeilstra, J., Joosten, S. P., van Andel, H., Tolg, C., Berns, A., Snoek, M., et al. (2014). As isoformas CD44v de células-tronco promovem a formação de câncer de intestino em ratos Apc(min) a jusante da sinalização de Wnt. Oncogene 33, 665-670. doi: 10.1038/onc.2012.611
PubMed Abstract | CrossRef Full Text | Google Scholar