Introdução
Antioxidantes naturais constituem uma parte importante das defesas do hospedeiro contra a exposição ambiental a agentes nocivos (Davies, 1995). Os estados pró-oxidantes surgem quando as espécies reativas de oxigênio (ROS) formadas durante o metabolismo excedem a capacidade antioxidante celular (Davies, 1995). Embora as ROS atuem como mediadores da regulação e sinalização homeostática celular (Forman et al., 2010), a produção excessiva de ROS pode contribuir para a patogênese de doenças humanas, incluindo câncer e doenças cardiovasculares (CVD; Dröge, 2002; Valko et al., 2006; Sugamura e Keaney, 2011). As células contêm produtos químicos solúveis em água e lipídios e enzimas antioxidantes que funcionam para limitar as reacções oxidativas prejudiciais e preservar a homeostase dos tecidos (Halliwell e Gutteridge, 1999; Davies, 2000). Além disso, muitas substâncias dietéticas podem ser absorvidas e servir como antioxidantes sistêmicos (Kaliora et al., 2006; García-Lafuente et al., 2009). Assim, muitas pesquisas têm sido direcionadas para a exploração de compostos antioxidantes naturais como terapêutica na prevenção ou tratamento de doenças humanas (Kaliora et al., 2006; García-Lafuente et al., 2009; Sugamura e Keaney, 2011).
Os pigmentos biliverdina (BV) e bilirrubina (BR) originam-se como produtos de degradação heme (Roy-Chowdhury et al., 2008; Figura 1). Estes pigmentos têm sido considerados pela comunidade médica como produtos residuais do metabolismo (Vitek e Ostrow, 2009). Entretanto, BV/BR exibem propriedades antioxidantes em sistemas modelo (Stocker et al., 1987a). O BR circulante atua como um potente antioxidante sérico, e serve como um fator antiaterogênico natural (Stocker et al., 1987b). Estudos clínicos retrospectivos e prospectivos indicam que níveis levemente elevados de BR (hiperbilirrubinemia leve) estão associados a risco reduzido de DCV (Franchini et al., 2010). Os efeitos benéficos dos BR/BV farmacológicos têm sido descritos em modelos pré-clínicos de lesão e doença tecidual, incluindo transplante de órgãos, doença pulmonar e DCV (Ollinger et al., 2007; Ryter et al., 2007). Esses efeitos envolvem mecanismos antioxidantes, anti-inflamatórios, antiapoptóticos e anti-proliferativos (Ollinger et al., 2007; Ryter et al., 2007). Esta revisão discute a aplicação terapêutica do BR/BV na doença, assim como dados clínicos sobre o papel do BR endógeno como fator de risco inverso para DCV.
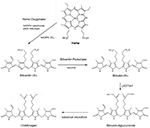
Figura 1. Sequência de formação e degradação do pigmento biliar. Heme Oxygenase (HO) degrada heme a biliverdina-IXα (BV), numa reacção geradora de monóxido de carbono (CO) e ferro ferroso, à custa do NADPH e do oxigénio molecular. O BV é reduzido a bilirrubina-IXα (BR) pelo NAD(P)H biliverdina redutase (BVR). BR é conjugado com ácido glucurônico em suas cadeias laterais de propionil por UDP-glucuroniltransferase-1A1 (UGT1A1) hepática, para formar mono e di-glucuronídeos BR. O BR pode ser ainda metabolizado ao urobilinogênio pela microflora intestinal.
Origina e Metabolic Fate of Bilirubin
Bilirrubina formada in vivo origina-se do turnover da hemoglobina (∼80%) durante a degradação dos eritrócitos por macrófagos reticuloendotelial. O restante da formação de BR resulta do turnover de hemoproteínas nos tecidos sistêmicos. Biliverdina-IXα (BV-IXα), o precursor do BR, é um pigmento solúvel em água que se origina durante a degradação heme catalisada pela atividade heme oxigenase (HO; E.C. 1:14:99:3), representado por isozimas constitutivas (HO-2) e induzíveis (HO-1) (Tenhunen et al, 1969; Maines, 1997).
Atividade heme oxigenase, a etapa limitadora da taxa de degradação heme, requer três moles O2 por heme oxidado, e elétrons da citocromo-p450 redutase NADPH (Yoshida e Kikuchi, 1974; Noguchi et al., 1979; Yoshida et al., 1980). Cada molécula de BV-IXα formada produz uma molécula de monóxido de carbono (CO), derivada do heme α-methene carbon, e ferro ferroso (Tenhunen et al., 1969). BV-IXα é reduzido para bilirrubina-IXα (BR-IXα), um pigmento lipídico solúvel, por biliverdina redutase dependente de NADH/NADPH (BVR; E.C. 1.3.1.24; Tenhunen et al., 1970).
Bilirrubina segue uma seqüência de etapas de transformação e eliminação biológica (Figura 2). BR formado in situ passa para o soro onde circula num complexo com albumina sérica (Roy-Chowdhury et al., 2008; Vitek e Ostrow, 2009). Uma fração do BR sérico não conjugado circula livremente (∼0.01%; Vitek e Ostrow, 2009). O BR não conjugado é absorvido pelo fígado por difusão facilitada, envolvendo transportadores de íons orgânicos (por exemplo, SLCO1B1; Kamisako et al., 2000; Cui et al., 2001). O transporte intracelular hepatocitário de BR é auxiliado pela ligandina, um complexo de subunidades glutathione-S-transferase (GST), e pela proteína-Z (Litwack et al., 1971). O BR é conjugado em hepatócitos por difosfato de uridina (UDP) glucuroniltransferase (UGT1A1; EC: 2.4.1.17; Chowdhury et al., 1979). O BR conjugado (mono e di-glucuronídeos) é bombeado dos hepatócitos através da membrana canalicular pela proteína-2 multirresistente e excretado através da bílis até o intestino (Chowdhury e Chowdhury, 1983; Wang et al., 2006a).
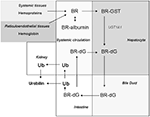
Figure 2. Biodistribuição de BR. BR é gerada em tecidos sistêmicos como produto da degradação da hemoproteína (isto é, hemoglobina). O BR formado nos tecidos passa livremente para a circulação, onde existe principalmente em um complexo com albumina sérica. O BR é absorvido por hepatócitos por difusão facilitada. No hepatócito, o BR é transportado por glutathione-S-transferase (GST), e depois conjugado por UDP-glucuroniltransferase-1A1 (UGT1A1) para formar a di-glucuronida bilirrubina (BR-dG). O BR conjugado (BR-dG) é então bombeado para o duto biliar e chega ao intestino. O BR conjugado pode ser reabsorvido no intestino e reentrar na circulação (Roy-Chowdhury et al., 2008; Vitek e Ostrow, 2009). O metabolismo do BR no intestino por ação bacteriana gera urobilinogênio (UB) e seu produto de oxidação urobilina, este último que é eliminado nas fezes. O urobilinogênio intestinal pode ser reabsorvido pelo intestino e eliminado na urina como urobilina (Chowdhury e Chowdhury, 1983; Wang et al., 2006a).
Antioxidante Efeitos dos pigmentos biliares
O potencial para o uso de pigmentos biliares como terapêutica originou-se com a descoberta de que estas substâncias atuam como antioxidantes naturais. Stocker et al. demonstraram que BV, BR e BR conjugado inibem a peroxidação lipídica em preparações lipossômicas desafiadas com substâncias químicas iniciadoras de radicais livres (Stocker e Ames, 1987; Stocker et al., 1987a; Stocker e Peterhans, 1989a). Nesses sistemas modelo, BR e BV exerceram uma atividade de quebra de cadeia e de aprisionamento de radicais peroxil (Stocker e Ames, 1987; Stocker et al., 1987a). BV e BR conjugados agiram como co-antioxidantes com α-tocopherol, e inibiram o consumo de α-tocopherol (Stocker e Peterhans, 1989a). O BR também evitou danos oxidativos a proteínas, como a albumina sérica exposta a sistemas geradores de ROS (Stocker et al., 1987b; Neuzil and Stocker, 1993). O BR livre e ligado à albumina inibiu a oxidação dos lipídios ligados ao LDL, atuando como co-antioxidantes com o LDL ligado ao α-tocoferol (Neuzil and Stocker, 1994).
Bilirrubina pode reagir com radicais aniônicos superóxidos, ácido hipocloroso e oxigênio molecular mono-t, inibir a foto-oxidação da proteína e inibir a quimiluminescência em macrófagos ativados (Stevens and Small, 1976; Pedersen et al, 1977; Stocker e Peterhans, 1989b). BR também pode reagir com NO ou espécies reativas de nitrogênio (RNS; Kaur et al., 2003; Mancuso et al., 2003). Finalmente, o BR conjugado forma um complexo cúprico que promove a decomposição dos hidroperóxidos, representando uma atividade pró-oxidante na bílis (Stocker e Ames, 1987).
Bilirrubina serve como antioxidante circulante no plasma humano. O tratamento do plasma com agentes oxidantes resultou no esgotamento dos antioxidantes endógenos da ordem ubiquinol-10, ascorbato, e bilirrubina. A adição de BR ao plasma humano após o esgotamento dos antioxidantes naturais resultou na inibição da peroxidação lipídica, e redução do consumo de α-tocoferol (Neuzil and Stocker, 1994). Amostras de soro de pacientes hiperbilirrubinêmicos com síndrome de Gilbert foram resistentes à oxidação e apresentaram maior capacidade antioxidante total do que o soro de indivíduos na faixa de concentração normal do BR (Bulmer et al., 2008).
BR exógeno quando aplicado farmacologicamente em células cultivadas pode proporcionar citoproteção dose-dependente contra o estresse oxidativo (Clark et al., 2000a). Por exemplo, o BR (1-5 μM) protege as células musculares lisas vasculares em cultura contra a citotoxicidade do H2O2 gerado por enzimas (Clark et al., 2000a). BR quando aplicado em concentrações nanomolares protegeu neurônios primários contra a citotoxicidade causada por H2O2 exógeno (Doré et al., 1999).
Embora as evidências sugerissem que o BR extracelular pode atuar como um citoprotetor, o papel do BR como um antioxidante celular permanece pouco claro. O BR produzido in situ é secretado para a circulação, conjugado no fígado e excretado (Roy-Chowdhury, 1996). Entretanto, a fração do BR que é retida nas células para servir a uma função antioxidante da membrana é desconhecida. Um argumento comum contra o papel antioxidante celular do BR é que o meio celular contém compostos antioxidantes endógenos eficientes e abundantes, incluindo quantidades milimolares de glutationa reduzida (GSH; Meister e Anderson, 1983), ascorbato, β-caroteno, e α-tocoferol (Halliwell e Gutteridge, 1999). Dado que o BR é exportado e eliminado, a contribuição relativa do BR para a capacidade antioxidante celular na presença de outros antioxidantes endógenos permanece pouco clara.
A evidência atual do papel do BR como antioxidante celular é baseada em evidências utilizando estudos de siRNA visando o BVR, a enzima responsável pela formação do BR. A derrubada de células sensibilizadas ao BVR para altas concentrações de H2O2 (Baranano et al., 2002), e para apoptose mediada por arsenita (Miralem et al., 2005). Neste último caso, efeitos semelhantes não foram alcançados com a derrubada de HO-1, sugerindo efeitos do BVR independente da geração de BR (Miralem et al., 2005).
Snyder et al. observaram que o BV é formado durante a oxidação do BR (Baranano et al., 2002). Os autores propuseram que o BV formado pela oxidação do BR atuaria como substrato para o BVR, para regenerar o BR, e assim representar um sistema antioxidante auto-perpetuante, “o ciclo antioxidante do BVR”. Evidências a favor e contra essa via têm sido debatidas em outros lugares (Maghzal et al., 2009; Sedlak e Snyder, 2009; Stocker e Maghzal, 2009). Ainda não está claro se o VB regenerado durante a oxidação do BR excederia apenas uma fração menor, e se isto contribuiria significativamente para a capacidade antioxidante celular como proposto.
Toxicidade da Bilirrubina
A acumulação de bilirrubina pode ser prejudicial, especialmente em bebês com hiperbilirrubinemia neonatal. A toxicidade seletiva do BR para o neonato é devida ao estabelecimento incompleto da barreira hemato-encefálica. A hiperbilirrubinemia não conjugada neonatal está associada a efeitos colaterais neurológicos graves, que incluem encefalopatia neurológica e kernicterus (Vitek e Ostrow, 2009). Para evitar o risco de neurotoxicidade, a fototerapia é aplicada para reduzir os níveis de BR não conjugado em recém-nascidos ictéricos (Blanckaert e Fevery, 1990). Os mecanismos de toxicidade do BR no cérebro foram revistos em outros lugares (Brito et al., 2008; Ghersi-Egea et al., 2009; Tell e Gustincich, 2009; Vitek e Ostrow, 2009).
Proteção dos Efeitos dos Pigmentos Bílicos em Modelos Animais de Lesão Tecidual
Excluindo toxicidade neonatal, a hiperbilirrubinemia leve, devido à elevada capacidade sérica antioxidante, pode conferir benefícios ao hospedeiro. Em um modelo de hiperbilirrubinemia em camundongos, ratos Gunn jaundiced apresentaram índices mais baixos de estresse oxidativo no soro do que ratos do tipo selvagem quando desafiados com hiperoxia (Dennery et al., 1995).
Aplicação terapêutica da função miocárdica preservada do BR durante lesão de isquemia/reperfusão (I/R) cardíaca (Clark et al., 2000b). Em um modelo de coração perfurado isolado, o pré-condicionamento heme protegido contra infarto do miocárdio após lesão I/R, associado ao aumento da expressão de HO-1 e formação de BR. A administração de BR em concentrações nanomolares melhorou o desempenho cardíaco e reduziu o tamanho do infarto e a disfunção mitocondrial após lesão I/R (Clark et al., 2000b)
Injeção de BV diminuiu a produção de citocinas pró-inflamatórias (i.e., IL-6), upregulated IL-10 levels, e reduziu a lesão pulmonar inflamatória em ratos desafiados com lipopolissacarídeo (LPS). Assim, a BV protegeu contra inflamação sistêmica e lesão pulmonar após exposição letal ao LPS. Os efeitos protetores da BV contra lesão induzida por LPS foram observados em células endoteliais pulmonares cultivadas e macrófagos (Sarady-Andrews et al., 2005). Efeitos antiinflamatórios adicionais do BR foram relatados na cultura de células. Por exemplo, o BR inibiu a expressão dependente de TNF-α de moléculas de adesão (ou seja, E-selectin, VCAM-1, ICAM-1) em células endoteliais (Mazzone et al., 2009). Recentemente, o aumento da translocação nuclear do BVR tem sido implicado nos efeitos anti-inflamatórios do BV (Wegiel et al., 2011).
A bilirrubina pode atuar como inibidor da proliferação de células musculares lisas (Nakao et al., 2005; Ollinger et al., 2005). A administração de BV exógena inibiu a hiperplasia neointimal associada à lesão vascular em ratos (Nakao et al., 2005; Ollinger et al., 2005). Estes efeitos foram atribuídos à desregulação da JNK e à inibição da apoptose endotelial das células (Nakao et al., 2005). Da mesma forma, animais hiperbilirrubinêmicos foram resistentes à lesão vascular (Ollinger et al., 2005). Os efeitos anti-proliferativos do BV e BR foram demonstrados na cultura de células musculares lisas vasculares. Células exógenas de VB/BR presas na fase G1 após estimulação sérica, associadas à inibição da p38 MAPK e da fosforilação da proteína retinoblastoma (Ollinger et al., 2005).
Hiperbilirrubinemia experimental (3-10 mg/dl) induzida por infusão protegida contra fibrose pulmonar induzida por bleomicina em ratos (Wang et al., 2002). Ratos infusados com BR apresentaram lesão pulmonar reduzida em resposta ao desafio da bleomicina, incluindo redução do conteúdo de hidroxiprolina pulmonar, redução da contagem de linfócitos polimorfonucleares e leucócitos, e redução dos níveis de fator de crescimento transformador-β no lavado broncoalveolar (Wang et al., 2002). Assim, os efeitos anti-fibróticos do BR podem estar relacionados tanto com efeitos antioxidantes quanto anti-proliferativos deste pigmento.
Estudos recentes também implicaram um efeito protetor do BV/BR na diabetes. Aplicação de BV em ratos diabéticos induzidos por estreptozotocina reduziu os isoprostanos urinários, e protegeu contra o sloughing das células endoteliais (Rodella et al., 2006). BR nefropatia diabética melhorada, através da redução da geração de ROS citosólicos e efeitos anti-inflamatórios (Fujii et al., 2010). Ratos hiperbilirrubinêmicos, ou ratos diabéticos tratados com BV, apresentaram albuminúria reduzida, e marcadores urinários de estresse oxidativo em relação aos controles do tipo selvagem ou não tratados, respectivamente. A aplicação de BV ou BR inibiu a produção de ROS em células endoteliais e mesangiológicas induzidas por alta exposição à glicose ou angiotensina-II (Fujii et al, 2010).
Efeitos protetores dos pigmentos biliares no transplante de órgãos
Efeitos terapêuticos dos pigmentos biliares aplicados exogenamente têm sido descritos em modelos animais de transplante de órgãos e rejeição aguda de enxertos, incluindo transplante de fígado (Fondevila et al., 2004), rim (Adin et al., 2005) e coração (Yamashita et al., 2004). No rim perfurado isolado, perfusão com BR protegido contra lesão tecidual induzida por I/R quente e função renal preservada (Adin et al., 2005). BV forneceu proteção tecidual em um modelo ex vivo de lesão hepática I/R fria. Além disso, a inclusão de VB no perfusato aumentou a sobrevivência em ratos submetidos a transplante hepático ortotópico, preservando a função hepática (Fondevila et al., 2004). Esta proteção conferida pela BV foi associada à diminuição da expressão de índices pró-inflamatórios, incluindo influxo de neutrófilos, expressão pró-inflamatória de citocinas e ativação de iNOS (Fondevila et al., 2004). O tratamento com BV melhorou a sobrevivência de aloenxertos cardíacos de ratos, reduzindo a infiltração de leucócitos e inibindo a proliferação de células T (Yamashita et al., 2004). Na lesão transplant-associada a frio I/R de enxertos cardíacos e renais, a aplicação de BV simultaneamente com CO proporcionou uma proteção sinérgica do tecido, enquanto que efeitos menores foram observados apenas com um dos agentes de teste (Nakao et al., 2000). A BV também evitou a rejeição de enxertos pulmonares de doadores com morte cerebral, que são mais propensos à rejeição (Zhou et al., 2011). No transplante alogênico de ilhotas, o tratamento do doador ou do enxerto doador ex vivo com BR melhorou a sobrevida do enxerto de ilhotas. O tratamento do receptor com BR também melhorou a sobrevida dos enxertos de ilhotas (Wang et al., 2006b; Zhu et al., 2010). O BR conferiu tolerância ao transplante de enxertos de ilhotas através da regulação das células T reguladoras (Lee et al., 2007). Os efeitos anti-apoptóticos e antiinflamatórios do BV/BR observados nos modelos de lesão I/R podem contribuir para a proteção durante a lesão I/R associada ao transplante. Estes experimentos também sugerem que o BR farmacológico pode ter funções imunomoduladoras que contribuem para efeitos terapêuticos no estabelecimento da rejeição do enxerto (Ollinger et al., 2007).
Bilirrubina na doença cardiovascular e pulmonar
Estudos clínicos recentes relataram associações inversas entre os níveis séricos de BR e os fatores de risco associados à DCV. Esses estudos sugerem coletivamente que elevações naturais no BR sérico conferem proteção contra DCV, incluindo aterosclerose, doença arterial coronariana (DAC)/ cardiopatia isquêmica (DIC), diabetes e acidente vascular cerebral (Novotný e Vítek, 2003; Franchini et al, 2010).
Em um dos primeiros estudos relatando associações entre BR e DCV, um estudo com 619 homens ajustados para fatores de risco dependentes da idade, o nível sérico de BR foi descrito como um fator de risco inverso para DAC (Schwertner et al., 1994). O BR foi pouco preditivo para DAC em relação aos marcadores lipoproteicos (Levinson, 1997). No entanto, uma forte correlação entre os níveis de BR e os níveis de apolipoproteína B, um fator de risco para aterosclerose, foi relatada (Levinson, 1997). Os níveis séricos de BR representaram um fator de risco inverso para DAC em indivíduos com DAC familiar precoce (Hopkins et al., 1996).
Num estudo prospectivo em larga escala (7.685 homens), indivíduos na gama média da concentração sérica de BR apresentaram risco reduzido de DAC, em relação a indivíduos no quintil mais baixo da distribuição sérica de BR (Breimer et al., 1995). Os indivíduos no quintil mais baixo de BR apresentaram redução do colesterol de lipoproteína de alta densidade (HDL), e redução da função pulmonar. Embora o BR sérico de nível médio estivesse associado a risco reduzido de DCV, os indivíduos hiperbilirrubinêmicos (quintil mais alto) apresentavam risco semelhante de DII como os indivíduos do quintil BR sérico mais baixo (Breimer et al., 1995).
Níveis de BR sérico foram indicados como fator de risco inverso e independente para doença vascular periférica (Breimer et al., 1994). Em estudos transversais em larga escala, os níveis séricos de BR dentro da faixa de normalidade foram inversamente associados com o risco de doença vascular periférica (Perlstein et al., 2008a) e AVC (Perlstein et al., 2008b). Um aumento de 1,71 μM no nível de BR foi associado com redução de 6% nas chances de doença vascular periférica (7.075 participantes; Perlstein et al., 2008a), e redução de 9% nas chances de acidente vascular cerebral (13.214 participantes; Perlstein et al., 2008b).
Em 72 indivíduos saudáveis, os níveis séricos de BR foram inversamente correlacionados com indicadores de aterosclerose (Erdogan et al., 2005). Baixos níveis séricos de BR foram associados com aumento da espessura intimal-medial da artéria carótida e vasodilatação mediada por fluxo prejudicado, indicativo de disfunção endotelial (Erdogan et al., 2005). Além disso, os níveis de BR foram inversamente correlacionados à formação da placa carotídea em 1.774 indivíduos, com uma razão de probabilidade relatada de 0,37 para um aumento de 17,1 μM aumento de BR (Ishizaka et al., 2001).
Em um estudo transversal de 2.307 coreanos, os níveis de BR total e direto foram inversamente correlacionados aos níveis plasmáticos de proteína C reativa (PCR), um indicador de inflamação vascular (Hwang et al., 2011). Associações inversas semelhantes foram relatadas entre BR e níveis de alta sensibilidade (hs)-CRP (Gullu et al., 2005; Yoshino et al., 2011). BR foi inversamente correlacionado com DCV em pacientes com hipercolesterolemia, e elevado em pacientes que receberam estatinas (Nolting et al., 2011).
Um estudo prospectivo (Framingham offspring study, 5.124 participantes) concluiu que uma maior concentração de BR sérico total estava associada a menor risco de DCV em homens, com associação pouco clara para mulheres (Djousse et al., 2001). Este estudo revelou um maior risco de infarto do miocárdio tanto para homens quanto para mulheres associado a baixo BR sérico e baixa albumina sérica (Djoussé et al., 2003).
Níveis de bilirrubina foram examinados como um preditor independente de mortalidade por DCV. Nenhuma associação foi encontrada entre o BR sérico e a mortalidade por DCV de todas as causas em um estudo de 10 anos da população belga, embora o aumento do BR tenha sido associado à redução da mortalidade por câncer em homens (Temme et al., 2001). Entretanto, em um estudo recentemente publicado com 1.279 homens, os níveis de BR e o nível de aptidão cardiopulmonar foram independentemente e negativamente correlacionados com a mortalidade por todas as causas e a mortalidade por DCV (Ajja et al., 2011).
Estudos adicionais analisaram potenciais associações entre os níveis de BR e doenças relacionadas à DCV, como diabetes (Ko et al., 1996; Fukui et al., 2008, 2011; Cheriyath et al., 2010) e síndrome metabólica (Jo et al., 2011; Kwon et al., 2011). Um grande estudo transversal (15.876 sujeitos) relatou uma associação inversa entre BR total e risco de diabetes (Cheriyath et al., 2010). Pacientes com diabetes tipo II em hemodiálise apresentaram um risco aumentado de DCV associado a baixo BR sérico, em relação a pacientes diabéticos não hemodiálicos (Fukui et al., 2011). O BR sérico foi inversamente correlacionado com a albuminúria em pacientes diabéticos tipo II (Fukui et al., 2008). Em uma coorte chinesa (1.508 sujeitos), BR sérico baixo foi associado com aberrações na tolerância à glicose, e aumentos nos fatores de risco de DCV, incluindo triglicerídeos, lipoproteínas de muito baixa densidade e hemoglobina glicosada (Ko et al., 1996).
Estudos adicionais examinaram associações de BR com DCV em hiperbilirrubinemia originada de distúrbios metabólicos do metabolismo de BR. Um polimorfismo de repetição de TA do promotor do gene UTG1A1 (designado UGT1A1*28, ou TA7) resulta em transcrição reduzida do UTG1A e déficit na conjugação e depuração do BR hepático (Schwertner e Vítek, 2008). Os indivíduos homozigotos para UGT1A1*28 (TA7/TA7) apresentam uma hiperbilirrubinemia, referida como síndrome de Gilbert, relativa a sujeitos do tipo selvagem (TA6/TA6) ou heterozigotos. Um estudo com 50 pacientes de Gilbert em relação à população geral (Vítek et al., 2002) relatou uma redução de seis vezes no risco de DSI e colesterol HDL elevado. Nos pacientes de Gilbert, o BR não conjugado foi negativamente correlacionado com o colesterol sd-LDL-C, LDL oxidado e hs-CRP (Tapan et al., 2011).
No estudo Framingham Heart, os homozigotos portadores do alelo UGT1A1*28 com concentrações séricas elevadas de BR apresentaram uma forte associação com menor risco de DCV (Lin et al., 2006). Estas observações foram ainda validadas por estudos de ligação condicional e associação de genomas. Estes estudos concluíram que o UTG1A é um gene importante ligado à DCV, e que o polimorfismo de repetição de TA está fortemente associado com a redução do risco de DCV (Lin et al., 2009). Em um estudo de doença arterial periférica, nenhuma associação de polimorfismos UGT1A1 foi observada, apesar da correlação inversa do risco de DCV com os níveis de BR (Rantner et al., 2008). Recentes estudos post-mortem também relataram que os polimorfismos UGT1A1 não estavam correlacionados com a gravidade da DAC (Papez et al., 2009).
Finalmente, o BR estava inversamente associado com o risco de doença pulmonar. Em um estudo de coorte (504.206 sujeitos) cada aumento de 0,1-mg/dL de BR em homens foi associado com 9%, e 6% de redução no risco de câncer de pulmão, e doença pulmonar obstrutiva crônica, respectivamente (Horsfall et al., 2011).
Conclusão
Biliverdina e BR são substâncias naturais derivadas do catabolismo heme que possuem propriedades antioxidantes. Além disso, os BR circulantes podem contribuir para a capacidade antioxidante do soro. Em estudos pré-clínicos, a aplicação farmacológica do BR confere proteção contra lesão I/R, lesão pulmonar aguda, fibrose pulmonar, lesão renal e rejeição do enxerto. Várias limitações das aplicações terapêuticas dos pigmentos biliares devem ser consideradas. Embora o VB seja solúvel em meio aquoso, o BR é lipofílico e solúvel apenas em solventes orgânicos, o que representa um desafio para a entrega terapêutica.
Bilirrubina é o subproduto da via de degradação heme, podendo assim mediar as propriedades citoprotetoras do HO-1 (Foresti et al., 2004). Abordagens farmacológicas ou de terapia genética envolvendo a expressão orientada de HO-1 estão em desenvolvimento (Abraham et al., 2007). Entretanto, essas abordagens não são específicas para a geração BV/BR, uma vez que a modulação do HO-1 tem efeitos pleiotrópicos que impactam o metabolismo sistêmico do ferro e a geração de CO. Da mesma forma, a expressão orientada de BVR pode afetar as vias de sinalização celular independentemente do seu papel na geração de pigmentos biliares (Kapitulnik e Maines, 2009). Estudos clínicos têm sugerido associações inversas entre o risco sérico BR e CVD. A hiperbilirrubinemia leve pode reduzir o risco de DCV, mas isso aguarda validação adicional. Até o momento, ainda não existem metodologias práticas para induzir a hiperbilirrubinemia para benefício clínico. Apesar do benefício terapêutico em modelos de lesão de tecidos animais, o potencial terapêutico do BR permanece não testado em humanos.
Conflict of Interest Statement
O autor declara que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Abrigações
Dr. Ryter deseja agradecer aos colegas atuais e antigos que contribuíram para alguns dos trabalhos aqui descritos. O Dr. Ryter tem atualmente uma consulta no Brigham and Women’s Hospital (BWH), Boston, e é Cientista Adjunto do Lovelace Respiratory Research Institute (LRRI), Albuquerque, Novo México. Nesta qualidade, o Dr. Ryter recebeu apoio salarial do consórcio LRRI/BWH para pesquisa pulmonar.
Abraham, N. G., Asija, A., Drummond, G., e Peterson, S. (2007). Heme oxygenase-1 gene terapia: avanços recentes e aplicações terapêuticas. Moeda. Gene Ther. 7, 89-108.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Adin, C. A., Croker, B. P., e Agarwal, A. (2005). Efeitos protetores da bilirrubina exógena sobre a lesão de isquemia-reperfusão no rim isolado e perfurado de rato. Am. J. Physiol. Renal Physiol. 288, F778-F784.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ajja, R., Lee, D. C., Sui, X., Church, T. S., e Steven, N. B. (2011). Utilidade da bilirrubina sérica e da aptidão cardiorrespiratória como preditores de mortalidade nos homens. Am. J. Cardiol. 108, 1438-1442.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Baranano, D. E., Rao, M., Ferris, C. D., e Snyder, S. H. (2002). Biliverdin reductase: um importante citoprotector fisiológico. Proc. Natl. Acad. Sci. U.S.A. 99, 16093-16098.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Blanckaert, N., and Fevery, J. (1990). “Fisiologia e fisiopatologia do metabolismo da bilirrubina”, em Hepatologia. A Textbook of Liver Disease, 2nd Edn, Vol. 1, eds D. Zakim e T. D. Boyer (Philadelphia: W. D. Saunders), 254-302.
Breimer, L. H., Spyropolous, K. A., Winder, A. F., Mikhailidis, D. P., e Hamilton, G. (1994). A bilirrubina é protetora contra doença arterial coronária. Clin. Quimioterapia. 40, 1987-1988.
Pubmed Abstract | Pubmed Full Text
Breimer, L. H., Wannamethee, G., Ebrahim, S., and Shaper, A. G. (1995). Bilirrubina sérica e risco de doença cardíaca isquêmica em homens britânicos de meia-idade. Clin. Chem. 41, 1504-1508.
Pubmed Abstract | Pubmed Full Text
Brito, M. A., Lima, S., Fernandes, A., Falcão, A. S., Silva, R. F., Butterfield, D. A., e Brites, D. (2008). Bilirrubin injury to neurons: contribution of oxidative stress and rescue by glycoursodeoxycholic acid. Neurotoxicology 29, 259-269.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bulmer, A. C., Blanchfield, J. T., Toth, I., Fassett, R. G., and Coombes, J. S. (2008). Melhoria da resistência à oxidação sérica na síndrome de Gilbert: um mecanismo de protecção cardiovascular. Atherosclerosis 199, 390-396.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cheriyath, P., Gorrepati, V. S., Peters, I., Nookala, V., Murphy, M. E., Srouji, N., e Fischman, D. (2010). Alta bilirrubina total como fator de proteção para diabetes mellitus: uma análise dos dados de NHANES de 1999-2006. J. Clin. Med. Res. 2, 201-216.
Pubmed Abstract | Pubmed Full Text
Chowdhury, J. R., e Chowdhury, N. R. (1983). Conjugação e excreção de bilirrubina. Semin. Dis. de fígado. 3, 11-23.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chowdhury, J. R., Chowdhury, N. R., Bhargava, M. M., and Arias, I. M. (1979). Purificação e caracterização parcial da bilirrubina glucuronosídica do fígado de rato glucuronosiltransferase. J. Biol. Quimioterapia. 254, 8336-8339.
Pubmed Abstract | Pubmed Full Text
Clark, J. E., Foresti, R., Green, C. J., e Motterlini, R. (2000a). Dinâmica da oxigenase-1expressão da hemoglobina e produção de bilirrubina na protecção celular contra o stress oxidativo. Bioquímica. J. 348, 615-619.
CrossRef Texto completo
Clark, J. E., Foresti, R., Sarathchandra, P., Kaur, H., Green, C. J., e Motterlini, R. (2000b). Heme oxygenase-1-derivado bilirrubin ameliorates postischemic myocardial dysfunction. Am. J. Fisiol. 278, H643-H651.
Cui, Y., König, J., Leier, I., Buchholz, U., e Keppler, D. (2001). Captação hepática de bilirrubina e seus conjugados pelo transportador de ânions orgânicos humanos SLC21A6. J. Biol. Quimioterapia. 276, 9626-9630.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Davies, K. J. (1995). Stress oxidativo: o paradoxo da vida aeróbica. Bioquímica. Soc. Symp. 61, 1-31.
Pubmed Abstract | Pubmed Full Text
Davies, K. J. (2000). Tensão oxidativa, defesas antioxidantes e sistemas de remoção, reparação e substituição de danos. IUBMB Life 50, 279-289.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dennery, P. A., McDonagh, A. F., Spitz, D. R., Rodgers, P. A., e Stevenson, D. K. (1995). Hiperbilirrubinemia resulta em redução da lesão oxidativa em ratos Gunn neonatais expostos a hiperóxia. Radic livre. Biol. Medic. 19, 395-404.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Djousse, L., Levy, D., Cupples, L. A., Evans, J. C., D’Agostino, R. B., e Ellison, R. C. (2001). Bilirrubina sérica total e risco de doença cardiovascular no Estudo Framingham Offspring Study. Am. J. Cardiol. 87, 1196-1200.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Djoussé, L., Rothman, K. J., Cupples, L. A., Levy, D., and Ellison, R. C. (2003). Efeito da albumina sérica e bilirrubina no risco de infarto do miocárdio (o Framingham Offspring Study). Am. J. Cardiol. 91, 485-488.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Doré, S., Takahashi, M., Ferris, C. D., Zakhary, R., Hester, L. D., Guastella, D., e Snyder, S. H. (1999). Bilirrubina, formada pela ativação de heme oxygenase-2, protege os neurônios contra lesões por estresse oxidativo. Proc. Natl. Acad. Sci. U.S.A. 96, 2445-2450.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dröge, W. (2002). Radicais livres no controle fisiológico da função celular. Physiol. Rev. 82, 47-95.
Pubmed Abstract | Pubmed Full Text
Erdogan, D., Gullu, H., Yildirim, E., Tok, D., Kirabas, I., Ciftci, O., Baycan, S. T., e Muderrisoglu, H. (2005). Baixos níveis séricos de bilirrubina estão independentemente e inversamente relacionados com a vasodilatação mediada por fluxo deficiente e o aumento da espessura da íntima-média carotídea tanto em homens como em mulheres. Atherosclerosis 184, 431-437.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fondevila, C., Shen, X. D., Tsuchiyashi, S., Yamashita, K., Csizmadia, E., Lassman, C., Busuttil, R. W., Kupiec-Weglinski, J. W., e Bach, F. H. (2004). A terapia com biliverdina protege os fígados de ratos da isquemia e da lesão de reperfusão. Hepatology 40, 1333-1341.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Foresti, R., Green, C. J., e Motterlini, R. (2004). Generation of bile pigments by hem oxygenase: a refined cellular strategy in response to stressful insults. Bioquímica. Soc. Symp. 71, 177-192.
Pubmed Abstract | Pubmed Full Text
Forman, H. J., Maiorino, M., e Ursini, F. (2010). Funções de sinalização de espécies reativas de oxigênio. Bioquímica 49, 835-842.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franchini, M., Targher, G., e Lippi, G. (2010). Níveis de bilirrubina sérica e risco de doença cardiovascular: um Janus Bifrons? Adv. Clin. Quimioterapia. 50, 47-63.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fujii, M., Inoguchi, T., Sasaki, S., Maeda, Y., Zheng, J., Kobayashi, K., and Takayanagi, R. (2010). Bilirrubina e biliverdina protegem roedores contra a nefropatia diabética através da desregulamentação da NAD(P)H oxidase. Kidney Int. 78, 905-919.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fukui, M., Tanaka, M., Shiraishi, E., Harusato, I., Hosoda, H., Asano, M., Hasegawa, G., e Nakamura, N. (2008). Relação entre bilirrubina sérica e albuminúria em pacientes com diabetes tipo 2. Int. Rim 74, 1197-1201.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fukui, M., Tanaka, M., Yamazaki, M., Hasegawa, G., Nishimura, M., Iwamoto, N., Ono, T., Imai, S., e Nakamura, N. (2011). Baixa concentração sérica de bilirrubina em pacientes com diabetes tipo 2 em hemodiálise. Diabet. Med. 28, 96-99.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
García-Lafuente, A., Guillamón, E., Villares, A., Rostagno, M. A., e Martínez, J. A. (2009). Flavonóides como agentes anti-inflamatórios: implicações no cancro e nas doenças cardiovasculares. Inflamação. Res. 58, 537-552.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ghersi-Egea, J. F., Gazzin, S., e Strazielle, N. (2009). Interfaces hemato-encefálicas e doenças neurológicas induzidas pela bilirrubina. Moeda. Pharm. Des. 15, 2893-2907.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gullu, H., Erdogan, D., Tok, D., Topcu, S., Caliskan, M., Ulus, T., e Muderrisoglu, H. (2005). Altas concentrações séricas de bilirrubina preservam a reserva de fluxo coronário e as funções microvasculares coronárias. Arterioscler. Thromb. Vasc. Biol. 25, 2289-2294.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Halliwell, B., and Gutteridge, J. M. C. (1999). Free Radicals in Biology and Medicine. Nova York, NY: Oxford University Press.
Hopkins, P. N., Wu, L. L., Hunt, S. C., James, B. C., Vincent, G. M., e Williams, R. R. (1996). A bilirrubina sérica mais elevada está associada com a diminuição do risco de doença coronária familiar precoce. Arterioscler. Thromb. Vasc. Biol. 16, 250-255.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Horsfall, L. J., Rait, G., Walters, K., Swallow, D. M., Pereira, S. P., Nazareth, I., e Petersen, I. (2011). Bilirrubina sérica e risco de doença respiratória e morte. JAMA 305, 691-697.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hwang, H. J., Lee, S. W., e Kim, S. H. (2011). Relação entre a bilirrubina e a proteína C reativa. Clin. Quimiol. Laboratório. Med. 49, 1823-1828.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ishizaka, N., Ishizaka, Y., Takahashi, E., Yamakado, M., and Hashimoto, H. (2001). O nível elevado de bilirrubina sérica está inversamente associado com a presença de placa carotídea. Stroke 32, 580-583.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jo, J., Yun, J. E., Lee, H., Kimm, H., e Jee, S. H. (2011). Concentrações séricas totais, diretas e indiretas de bilirrubina e síndrome metabólica entre a população coreana. Endocrine 39, 182-189.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kaliora, A. C., Dedoussis, G. V., e Schmidt, H. (2006). Antioxidantes dietéticos na prevenção da aterogênese. Atherosclerosis 187, 1-17.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kamisako, T., Kobayasi, Y., Takeuchi, K., Ishihara, T., Higuchi, K., Tanaka, Y., Gabazza, E. C., e Adachi, Y. (2000). Recentes avanços na pesquisa do metabolismo da bilirrubina: o mecanismo molecular do transporte da bilirrubina hepatocitária e sua relevância clínica. J. Gastroenterol. 35, 659-664.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kapitulnik, J., e Maines, M. D. (2009). Funções pleiotrópicas da biliverdina redutase: sinalização celular e geração de bilirrubina citoprotetora e citotóxica. Tendências Pharmacol. Sci. 30, 129-137.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kaur, H., Hughes, M. N., Green, C. J., Naughton, P., Foresti, R., e Motterlini, R. (2003). Interação da bilirrubina e biliverdina com espécies reativas de nitrogênio. FEBS Lett. 543, 113-119.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ko, G. T., Chan, J. C., Woo, J., Lau, E., Yeung, V. T., Chow, C. C., Li, J. K., So, W. Y., and Cockram, C. S. (1996). Soro bilirrubina e fatores de risco cardiovascular em uma população chinesa. J. Cardiovasc. Risk 3, 459-463.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kwon, K. M., Kam, J. H., Kim, M. Y., Kim, M. Y., Chung, C. H., Kim, J. K., Linton, J. A., Eom, A., Koh, S. B., and Kang, H. T. (2011). Associação inversa entre bilirrubina total e síndrome metabólica em mulheres coreanas rurais. J. Womens Health (Larchmt) 20, 963-969.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lee, S. S., Gao, W., Mazzola, S., Thomas, M. N., Csizmadia, E., Otterbein, L. E., Bach, F. H., e Wang, H. (2007). Heme oxygenase-1, monóxido de carbono e bilirrubina induzem tolerância em recipientes em direção a aloenxertos de ilhotas através da modulação de células reguladoras T. FASEB J. 21, 3450-3457.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levinson, S. S. (1997). Relação entre bilirrubina, apolipoproteína B, e doença arterial coronária. Ann. Clin. Laboratório. Sci. 27, 185-192.
Pubmed Abstract | Pubmed Full Text
Lin, J. P., O’Donnell, C. J., Schwaiger, J. P., Cupples, L. A., Lingenhel, A., Hunt, S. C., Yang, S., e Kronenberg, F. (2006). Associação entre o alelo UGT1A1*28, níveis de bilirrubina e doença cardíaca coronária no Estudo do Coração de Framingham. Circulação 114, 1476-1481.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lin, J. P., Schwaiger, J. P., Cupples, L. A., O’Donnell, C. J., Zheng, G., Schoenborn, V., Hunt, S. C., Joo, J., e Kronenberg, F. (2009). A ligação condicional e estudos de associação de todo o genoma identificam o UGT1A1 como um gene principal para os níveis de bilirrubina sérica anti-aterogênica – o Estudo do Coração de Framingham. Atherosclerosis 206, 228-233.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Litwack, G., Ketterer, B., and Arias, I. M. (1971). Ligandina: uma proteína hepática que liga esteróides, bilirrubina, carcinógenos e um número de ânions orgânicos exógenos. Nature 234, 466-467.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maghzal, G. J., Leck, M. C., Collinson, E., Li, C., and Stocker, R. (2009). Papel limitado do ciclo de amplificação da bilirrubina-biliverdina redox na proteção celular antioxidante por biliverdina redutase. J. Biol. Chem. 284, 29251-29259.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maines, M. D. (1997). O sistema heme oxigenase: um regulador de gases do segundo mensageiro. Annu. Rev. Pharmacol. Toxicol. 37, 517-554.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mancuso, C., Bonsignore, A., Di Stasio, E., Mordente, A., e Motterlini, R. (2003). Bilirrubina e interação S-nitrosothiols: evidência de um possível papel da bilirrubina como um necrófago de óxido nítrico. Biochem. Pharmacol. 66, 2355-2363.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mazzone, G. L., Rigato, I., Ostrow, J. D., Bossi, F., Bortoluzzi, A., Sukowati, C. H., Tedesco, F., e Tiribelli, C. (2009). A bilirrubina inibe a indução relacionada ao TNFalfa de três moléculas de adesão endotelial. Biochem. Biofísica. Res. Comun. 386, 338-344.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Meister, A., and Anderson, M. E. (1983). Glutationa. Annu. Rev. Biochem. 52, 711-760.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Miralem, T., Hu, Z., Torno, M. D., Lelli, K. M., e Maines, M. D. (2005). Pequena interferência RNA-mediated silencing do gene da biliverdina redutase humana, mas não a da heme oxygenase-1, atenua a indução da arsenite-mediated da oxigenase e aumenta a apoptose em 293A células renais. J. Biol. Chem. 280, 17084-17092.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nakao, A., Murase, N., Ho, C., Toyokawa, H., Billiar, T. R., e Kanno, S. (2005). A administração de biliverdina evita a formação de hiperplasia intimal induzida por lesão vascular. Circulação 112, 587-591.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nakao, A., Neto, J. S., Kanno, S., Stolz, D. B., Kimizuka, K., Liu, F., Bach, F. H., Billiar, T. R., Choi, A. M., Otterbein, L. E., e Murase, N. (2000). Proteção contra lesão de isquemia/reperfusão em transplante cardíaco e renal com monóxido de carbono, biliverdina e ambos. Am. J. Transplante. 5, 282-291.
CrossRef Texto Completo
Neuzil, J., e Stocker, R. (1993). A bilirrubina atenua os danos mediados radicalmente à albumina sérica. FEBS Lett. 331, 281-284.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Neuzil, J., and Stocker, R. (1994). A bilirrubina livre e ligada à albumina são co-antioxidantes eficientes para o alfa-tocoferol, inibindo a peroxidação do plasma e lipoproteínas de baixa densidade. J. Biol. Chem. 269, 16712-16719.
Pubmed Abstract | Pubmed Full Text
Noguchi, M., Yoshida, T., e Kikuchi, G. (1979). Requerimento específico de NADPH-cytochrome c reductase para a reação da microssomal heme oxigenase que produz biliverdina IX alfa. FEBS Lett. 98, 281–284.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nolting, P. R., Kusters, D. M., Hutten, B. A., Kastelein, J. J., e grupo de estudo ExPRESS. (2011). Níveis séricos de bilirrubina na hipercolesterolemia familiar: um novo marcador de risco para doenças cardiovasculares? J. Lipid Res. 52, 1755-1759.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Novotný, L., e Vítek, L. (2003). Relação inversa entre bilirrubina sérica e aterosclerose em homens: uma meta-análise de estudos publicados. Exp. Biol. Medic. (Maywood) 228, 568-571.
Pubmed Abstract | Pubmed Full Text
Ollinger, R., Bilban, M., Erat, A., Froio, A., McDaid, J., Tyagi, S., Csizmadia, E., Graca-Souza, A. V., Liloia, A., Soares, M. P., Otterbein, L. E., Usheva, A., Yamashita, K., e Bach, F. H. (2005). Bilirrubin: um inibidor natural da proliferação de células musculares lisas vasculares. Circulação 112, 1030-1039.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ollinger, R., Wang, H., Yamashita, K., Wegiel, B., Thomas, M., Margreiter, R., and Bach, F. H. (2007). Aplicações terapêuticas da bilirrubina e da biliverdina em transplantes. Antioxidante. Sinal Redox. 9, 2175-2185.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Papez, M. J., Civalier, C. J., Thorne, L. B., e Gulley, M. L. (2009). O genótipo promotor do UGT1A1 não está fortemente associado à gravidade da doença arterial coronária. O diagnóstico. Mol. Pathol. 18, 226-231.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pedersen, A. O., Shonheyder, F., e Broderson, R. (1977). Fotooxidação da albumina sérica humana e seu complexo com bilirrubina. Eur. J. Bioquímica. 72, 213-221.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Perlstein, T. S., Pande, R. L., Beckman, J. A., e Creager, M. A. (2008a). Nível sérico total de bilirrubina e doença arterial periférica de extremidade inferior prevalecente: Pesquisa Nacional de Saúde e Nutrição (NHANES) 1999 a 2004. Arterioscler. Thromb. Vasc. Biol. 28, 166-172.
CrossRef Texto completo
Perlstein, T. S., Pande, R. L., Creager, M. A., Weuve, J., e Beckman, J. A. (2008b). Nível sérico total de bilirrubina, derrame prevalecente e resultados do derrame: NHANES 1999-2004. Am. J. Med. 121, 781-788.
CrossRef Full Text
Rantner, B., Kollerits, B., Anderwald-Stadler, M., Klein-Weigel, P., Gruber, I., Gehringer, A., Haak, M., Schnapka-Köpf, M., Fraedrich, G., e Kronenberg, F. (2008). Associação entre o polimorfismo UGT1A1 TA-repetição e concentração de bilirrubina em pacientes com claudicação intermitente: resultados do estudo CAVASIC. Clin. Quimioterapia. 54, 851-857.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Rodella, L., Lamon, B. D., Rezzani, R., Sangras, B., Goodman, A. I., Falck, J. R., e Abraham, N. G. (2006). O monóxido de carbono e a biliverdina previnem o deslizamento de células endoteliais em ratos com diabetes tipo I. Radic livre. Biol. Med. 40, 2198-2205.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roy-Chowdhury, J. (1996). “Metabolismo da bilirrubina e seus distúrbios”, em Hepatologia. A Textbook of Liver Disease, 3rd Edn, Vol. 1, eds D. Zakim and T. D. Boyer (Philadelphia: W. D. Saunders), 323-361.
Roy-Chowdhury, N., Lu, Y., and Roy-Chowdhury, J. (2008) “Bilirbuin metabolism,” in Textbook of Hepatology: From Basic Science to Clinical Practice, 3rd Edn, eds J. Rodés, J. P. Benhamou, A. T. Blei, J. Reichen, e M. Rizzetto (Hoboken, NJ: Wiley), 165-174.
Ryter, S. W., Morse, D., e Choi, A. M. (2007). Carbon monoxide and bilirubin: potential therapies for pulmonary/vascular injury and disease. Am. J. Respir. Cell Mol. Biol. 36, 175-182.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sarady-Andrews, J. K., Liu, F., Gallo, D., Nakao, A., Overhaus, M., Ollinger, R., Choi, A. M., and Otterbein, L. E. (2005). A administração de biliverdina protege contra lesão pulmonar aguda induzida por endotoxinas em ratos. Am. J. Physiol. Mol. de célula pulmonar. Physiol. 289, L1131-L1137.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schwertner, H. A., Jackson, W. G., e Tolan, G. (1994). Associação de baixa concentração sérica de bilirrubina com aumento do risco de doença arterial coronária. Clin. Química. 40, 18-23.
Pubmed Abstract | Pubmed Full Text
Schwertner, H. A., e Vítek, L. (2008). Síndrome de Gilbert, alelo UGT1A1*28, e risco de doença cardiovascular: possíveis efeitos protetores e aplicações terapêuticas da bilirrubina. Atherosclerosis 198, 1-11.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sedlak, T. W., e Snyder, S. H. (2009). Ciclando os vagões para biliverdin reductase. J. Biol. Quimio. 284, le11.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stevens, B., and Small, R. D. (1976). A fotoperoxidação de moléculas orgânicas insaturadas-XV. O2 1Δg têmpera por bilirrubina e biliverdina. Fotoquímica. Fotobiol. 23, 33-36.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stocker, R., e Ames, B. (1987). Potencial papel da bilirrubina conjugada e do cobre no metabolismo dos peróxidos lipídicos na bílis. Proc. Natl. Acad. Sci. U.S.A. 84, 8130-8134.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stocker, R., and Maghzal, G. J. (2009). Resposta a Sedlak e Snyder: o pequeno bighorn do ciclo de amplificação de biliverdina redutase. J. Biol. Chem. 284, le12.
CrossRef Full Text
Stocker, R., e Peterhans, E. (1989a). Interação sinergética entre a vitamina E e os pigmentos bilirrubina e biliverdina. Biochim. Biófilos. Acta 1002, 238-244.
Stocker, R., e Peterhans, E. (1989b). Antioxidant properties of conjugated bilirubin and biliverdin: relevant scavenging of hypochlorous acid. Radic livre. Res. Comun. 6, 57-66.
CrossRef Texto completo
Stocker, R., Yamamoto, Y., McDonagh, A., Glazer, A., e Ames, B. N. (1987a). A bilirrubina é um antioxidante de possível importância fisiológica. Science 235, 1043-1045.
CrossRef Full Text
Stocker, R., Glazer, A. N., e Ames, B. N. (1987b). Atividade antioxidante da bilirrubina ligada à albumina. Proc. Natl. Acad. Sci. U.S.A. 84, 5918-5922.
CrossRef Full Text
Sugamura, K., e Keaney, J. F. Jr. (2011). Espécies reativas de oxigênio em doenças cardiovasculares. Radic livre. Biol. Med. 51, 978-992.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tapan, S., Karadurmus, N., Dogru, T., Ercin, C. N., Tasci, I., Bilgi, C., Kurt, I., and Erbil, M. K. (2011). Diminuição dos pequenos níveis densos de LDL na síndrome de Gilbert. Clin. Biochem. 44, 300-303.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tell, G., and Gustincich, S. (2009). Estado Redox, estresse oxidativo e mecanismos moleculares de proteção e efeitos tóxicos da bilirrubina sobre as células. Moeda. Pharm. Des. 15, 2908-2914.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Temme, E. H. M., Zhang, J. J., Schouten, E. G., e Kesteloot, H. (2001). Bilirrubina sérica e risco de mortalidade de 10 anos em uma população belga. Cancer Causes Control 12, 887-894.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tenhunen, R., Marver, H. S., e Schmid, R. (1969). Microsomal heme oxigenase. Caracterização da enzima. J. Biol. Chem. 244, 6388-6394.
Pubmed Abstract | Pubmed Full Text
Tenhunen, R., R., Ross, M. E., Marver, H. S., e Schmid, R. (1970). Redução da nicotinamida-adenina dinucleotídeo fosfato dependente de biliverdina-redutase: purificação e caracterização parcial. Biochemistry 9, 298-303.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Valko, M., Rhodes, C. J., Moncol, J., Izakovic, M., and Mazur, M. (2006). Radicais livres, metais e antioxidantes em câncer induzido por estresse oxidativo. Chem. Biol. Interagir. 160, 1-40.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vítek, L., Jirsa, M., Brodanová, M., Kaláb, M., Mareček, Z., Danzig, V., Novotný, L., e Kotal, P. (2002). Síndrome de Gilbert e cardiopatia isquémica: um efeito protector dos níveis elevados de bilirrubina. Atherosclerosis 160, 449-456.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vitek, L., and Ostrow, J. D. (2009). Química e metabolismo da bilirrubina; aspectos nocivos e protetores. Moeda. Pharm. Des. 15, 2869-2883.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, H. D., Yamaya, M., Okinaga, S., Jia, Y. X., Kamanaka, M., Takahashi, H., Guo, L. Y., Ohrui, T., e Sasaki, H. (2002). Bilirrubina ameliorata a fibrose pulmonar induzida por bleomicina em ratos. Am. J. Respir. Crit. Care Med. 165, 406-411.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, X., Chowdhury, J. R., e Chowdhury, N. R. (2006a). Metabolismo da bilirrubina: fisiologia aplicada. Moeda. Pediatr. 16, 70-74.
CrossRef Full Text
Wang, H., Lee, S. S., Dell’Agnello, C., Tchipashvili, V., d’Avila, J. C., Czismadia, E., Chin, B. Y., e Bach, F. H. (2006b). Bilirrubin pode induzir tolerância a aloenxertos de ilhotas. Endocrinology 147, 762-768.
CrossRef Full Text
Wegiel, B., Gallo, D., Csizmadia, E., Roger, T., Kaczmarek, E., Harris, C., Zuckerbraun, B. S., e Otterbein, L. E. (2011). Biliverdina inibe a expressão de Toll-like receptor-4 (TLR4) através da translocação nuclear dependente de óxido nítrico de biliverdina reductase. Proc. Natl. Acad. Sci. U.S.A. 108, 18849-18854.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Yamashita, K., McDaid, J., Ollinger, R., Tsui, T. Y., Berberat, P. O., Usheva, A., Csizmadia, E., Smith, R. N., Soares, M. P., e Bach, F. H. (2004). Biliverdin, um produto natural do catabolismo heme, induz a tolerância ao aloenxerto cardíaco. FASEB J. 18, 765-767.
Pubmed Abstract | Pubmed Full Text
Yoshida, T., e Kikuchi, G. (1974). Sequência da reação do catabolismo heme catalisado pelo sistema da microssomal heme oxigenase. FEBS Lett. 48, 256-261.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Yoshida, T., Noguchi, M., and Kikuchi, G. (1980). Forma oxigenada do complexo heme heme oxigenase e requisito para que o segundo elétron inicie a degradação do complexo heme oxigenado. J. Biol. Chem. 255, 4418-4420.
Pubmed Abstract | Pubmed Full Text
Yoshino, S., Hamasaki, S., Ishida, S., Kataoka, T., Yoshikawa, A., Oketani, N., Saihara, K., Okui, H., Shinsato, T., Ichiki, H., Kubozono, T., Kuwahata, S., Fujita, S., Kanda, D., Nakazaki, M., Miyata, M., e Tei, C. (2011). Relação entre concentração de bilirrubina, função endotelial coronária e estresse inflamatório em pacientes com sobrepeso. J. Atheroscler. Thromb. 18, 403-412.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhou, H., Qian, H., Liu, J., Zhu, D., Ding, W., Pan, P., Jin, D., Wang, J., e Li, W. (2011). Proteção contra lesão de enxerto pulmonar de doadores de morte cerebral com monóxido de carbono, biliverdina ou ambos. J. Transplante de pulmão de coração. 30, 460-466.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhu, H., Wang, J., Jiang, H., Ma, Y., Pan, S., Reddy, S., and Sun, X. (2010). A bilirrubina protege os enxertos contra lesões induzidas por inflamação não específica no transplante de ilhotas intraportal sinergênicas. Exp. Mol. Med. 42, 739-748.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text