Introdução
Carófitos ou Estreptofitos basais; (Becker e Marin, 2009; Leliaert et al, 2012) constituem um sortimento taxonômico diversificado de algas verdes terrestres e de água doce que apresentam uma ampla variedade de formas unicelulares, filamentosas e “parenquimatosas” (Graham, 1993; Lewis e McCourt, 2004). Uma linhagem ancestral de filósofos surgiu em terras colonizadas há 450-500 milhões de anos. Estes organismos adaptaram-se às condições terrestres, tornaram-se capazes de sobreviver e reproduzir-se quando totalmente expostos à atmosfera, e alguns membros acabaram por evoluir para plantas terrestres (Zhong et al., 2013; Delwiche e Cooper, 2015). Esta “terrestrialização” das plantas verdes representou um evento biológico fundamental que mudou para sempre a biogeoquímica e a história natural do planeta. A subsequente proliferação de plantas terrestres alterou as condições atmosféricas e do solo e permitiu a emergência de outras formas de vida diversificadas na terra. A evolução das plantas terrestres também transformou mais significativamente a história humana através da inovação da agricultura e da consequente criação da civilização humana moderna. Em parte devido ao seu significado evolutivo, as carófitas receberam uma atenção significativa dos biólogos vegetais nas últimas décadas (Pickett-Heaps e Marchant, 1972; Pickett-Heaps, 1975; Mattox e Stewart, 1984; Becker e Marin, 2009; Harholt et al., 2016). No entanto, à medida que novos dados adicionais foram recolhidos sobre a biologia destas algas, elas tornaram-se modelos importantes para a compreensão dos fenómenos básicos da bioquímica, biologia celular, biologia do desenvolvimento, ecologia e, cada vez mais, biologia molecular (Delwiche e Cooper, 2015; Lemieux et al., 2016). A série Frontiers in Plant Science sobre “Charophytes” ilustra a importância destes organismos em várias áreas específicas da investigação em biologia vegetal. Esta mini-revisão destaca os atributos das “Charophytes” como organismos modelo em diversas áreas de pesquisa. Espera-se também que ela estimule uma nova geração de cientistas a expandir o uso dessas algas na pesquisa básica e a iniciar a triagem de outros taxa que, por sua vez, podem levar à identificação e ao uso de novos modelos de carófitos.
A “Line-Up” de Charophytes
Durante os anos 70 e 80, ultra-estruturais (por exemplo mecanismo de divisão celular, subestrutura do aparelho flagelar) e dados bioquímicos (por exemplo, perfis enzimáticos) foram os principais critérios para a inclusão de uma alga verde na linhagem de Charophytes (Mattox e Stewart, 1984; Lewis e McCourt, 2004; Leliaert et al., 2012). Da década de 1990 até hoje, estudos focados em análises moleculares de cloroplasto e genomas nucleares e transcriptomas reafirmaram e refinaram esquemas taxonômicos e filogenéticos anteriores (Timme et al., 2012; Delwiche e Cooper, 2015). Isto foi ainda complementado por análises detalhadas bioquímicas, imunológicas e baseadas na biologia celular de paredes celulares de carófitos e vias biossintéticas e de sinalização hormonais (Popper e Fry, 2003; Popper, 2008; Sørensen et al., 2010, 2011, 2012; Zhang e van Duijn, 2014; Ju et al., 2015; O’Rourke et al., 2015). Carófitas extensas apresentam uma percentagem relativamente baixa de diversidade em comparação com outras taxas de algas verdes e abrangem 13 famílias e 122 géneros (Becker e Marin, 2009; Leliaert et al., 2012). A opinião filogenética atual coloca as filófitas em seis classes (Figura 1; Delwiche e Cooper, 2015). A classe basal, a Mesostigmatophyceae, é representada por um único gênero conhecido, Mesostigma. Esta alga é um biflagelado unicelular com uma forma assimétrica única (isto é, como um bote salva-vidas achatado) e é coberta por camadas de escamas de desenho ornamental (Manton e Ettl, 1965; Becker et al., 1991; Domozych et al., 1991, 1992). A segunda classe, a Chlorokybophyceae, também consiste num único tipo conhecido, Chlorokybus atmophyticus. Esta alga rara forma um pacote sarcinoide de células rodeado por uma cobertura espessa em forma de gel (Rogers et al., 1980). Deve-se notar que filogenias alternativas colocam Mesostigma e Chlorokybus como linhagens irmãs que juntas são irmãs de todos os outros Streptophytes (Rodríguez-Ezpeleta et al., 2007). Na filogenia de seis classes, a terceira classe, a Klebsormidiophyceae, consiste em três gêneros que formam filamentos simples não ramificados (Sluiman et al., 2008) que freqüentemente são membros de “crostas biológicas” crescendo em superfícies de vários habitats terrestres. Várias espécies nesta classe podem mesmo suportar stress significativo de dessecação quando parte das crostas do deserto (Mikhailyuk et al., 2008, 2014; Holzinger e Karsten, 2013); outras são tolerantes ao stress de dessecação associado a ambientes de baixa temperatura (Stamenkovic et al., 2014; Herburger e Holzinger, 2015). Estas três primeiras classes constituem as carófitas “early divergent”. A linhagem “divergente tardia” também inclui três classes. As Charophyceae, ou calhaus rolados, são comumente encontradas em ecossistemas de água doce e possuem tálio multicelular macroscópico composto por agregações de filamentos ramificados feitos de células excepcionalmente alongadas (Lewis e McCourt, 2004). Os membros deste grupo exibem reprodução sexual baseada em oogamia que inclui espermatozóides móveis e óvulos não móveis, ambos produzidos em gametangia multicelular. As Coleochaetophyceae consistem em taxa que têm tálio multicelular feito de filamentos ramificados ou parênquima (Graham, 1993; Delwiche et al., 2002). Estes organismos também apresentam uma reprodução sexual distinta baseada em oogamia. As Coleochaetophyceae são tipicamente encontradas na interface de água doce e habitats terrestres, muitas vezes como epífitas. Por fim, o maior e mais diversificado grupo de carófitas, as Zygnematophyceae, consiste em unicelas e filamentos não ramificados (Gontcharov et al., 2003; Guiry, 2013). A característica distintiva deste grupo é a presença de reprodução sexual baseada na conjugação que requer sinalização e adesão de células complexas (Abe et al., 2016). As algas zigmatófitas são habitantes comuns de habitats de água doce, por vezes ocorrendo em espectaculares florações efémeras, bem como em substratos terrestres húmidos.

FIGURA 1. Charófitas extensas. As Charófitas Exteriores são divididas em taxas divergentes precoces e tardias. Os táxons divergentes precoces incluem as Mesostigmatophyceae, as Chlorokybophyceae e as Klebsormidiophyceae e os táxons divergentes tardios incluem as Charophyceae, as Coleochaetophyceae e as Zygnematophyceae. Os representantes de cada grupo são Mesostigma (Mesostigmatophyceae), Chlorokybus atmophyticus (Chlorokybophyceae), Klebsormidium flaccidum (Klebsormidiophyceae), Chara (Charophyceae), Coleochaete scutata (Coleochaetophyceae) e Micrasterias (Zygnematophyceae).
Carófitos como Organismos Modelo
Carófitos universais têm sido amplamente utilizados como organismos modelo no estudo dos processos biológicos básicos. O seu pequeno e simples thalli (isto é, quando comparado com plantas terrestres) e a facilidade na manipulação experimental são apenas dois dos seus atributos que os tornam organismos-modelo atraentes. Evidências recentes também demonstraram que muitas carófitas têm várias características notavelmente semelhantes às das plantas terrestres, incluindo a presença de vias biossintéticas para muitos reguladores de crescimento (Figura 2; Boot et al., 2012; Hori et al., 2014; Wang et al., 2014, 2015; Holzinger e Becker, 2015; Ju et al., 2015) e polímeros de parede celular múltipla (Popper, 2008; Sørensen et al., 2010, 2011, 2012; Mikkelsen et al., 2014). Estas duas características tornaram as carófitas eficazes em áreas de estudo como o desenvolvimento molecular das plantas e a fisiologia do stress. Embora muitos filófilos tenham sido utilizados em uma ampla gama de estudos biológicos, os seguintes taxa são mais notáveis pelo seu uso extensivo em múltiplas áreas de estudo como modelos:
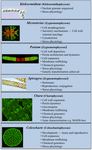
FIGURA 2. Modelo atual Charophytes. Várias Charófitas incluindo Klebsormidium, Micrasterias, Penium, Spirogyra, Chara e Coleochaete são usadas como modelos; cada uma tem atributos específicos que a tornam um modelo particularmente adequado para processos fisiológicos e bioquímicos específicos.
Desmids: The Symmetrical Models
As Zygnematophyceae demonstraram recentemente ser muito provavelmente os antepassados vivos mais próximos das plantas terrestres (Wodniok et al.., 2011; Delwiche e Cooper, 2015). Os membros unicelulares do grupo dos desmídios de placoderme inclusivo tornaram-se modelos importantes para elucidar muitos princípios fundamentais da biologia e desenvolvimento das células vegetais. Tamanho celular grande, simetria/formato notável, arquitetura da parede celular distinta e sistemas de endomembrana/cetoesqueleto elaborados são apenas algumas das características que os tornam excelentes sistemas celulares para o estudo da fisiologia e desenvolvimento celular. O recente estabelecimento de linhas transformadas estáveis e em breve genomas/transcriptomas sequenciados de desmídias selecionadas aumentaram ainda mais o seu valor nos estudos botânicos. Dois taxa, Micrasterias e Penium, surgiram como os mais bem estudados dos desmídias.
Micrasterias tem sido o desmídio mais popular para pesquisa em biologia celular nos últimos 50 anos devido às suas características únicas (Meindl, 1993; Lutz-Meindl, 2016). A célula de Micrasterias exibe uma simetria bilateral que é frequentemente realçada por uma periferia espectacularmente dissecada (ou seja, multilobada). As novas semicélulas filhas produzidas pela divisão celular não têm esta morfologia complexa, mas têm uma forma esférica. Um complexo programa de desenvolvimento pós-citocinético que emprega múltiplos conjuntos de mecanismos subcelulares altamente coordenados gera subseqüentemente o fenótipo multilobe durante a expansão da semicélula filha. Este programa também é responsável pela deposição de polímeros para a produção tanto de uma parede celular primária como secundária. Estes eventos estão centrados numa grande rede de corpos Golgi e vesículas associadas que produzem um complexo mecanismo de secretariado. Este processo, por sua vez, é direcionado a locais específicos da superfície celular que geram uma expansão celular multipolar e a secreção simultânea de macromoléculas de parede celular e mucilagem extracelular (Kim et al., 1996; Lutz-Meindl e Brosch-Salomon, 2000; Oertel et al., 2004; Aichinger e Lutz-Meindl, 2005). A entrega de componentes secretos a loci de superfície celular precisa requer um sistema elaborado de actinomiosina baseado em citomótis e é controlado por várias cascatas de transdução de sinal (Meindl et al., 1994; Oertel et al., 2003). Além disso, a morfogênese celular é altamente sensível ao estresse externo (por exemplo, estresse oxidativo, salinidade, metais pesados) que leva a grandes mudanças na diferenciação celular (Darehshouri et al., 2008; Affenzeller et al., 2009; Andosch et al., 2012). Micrasterias é um organismo excelente para a análise dessas características subcelulares, pois é fácil de manter e manipular em laboratório e se presta especialmente bem para a aquisição de imagens de alta resolução usando microscopia de luz e eletrônica, incluindo imunocitoquímica, microscopia eletrônica de varredura de feixes de íons focalizados (FIB-SEM) e espectroscopia de perda de energia elétrica (EELS) (Lutz-Meindl, 2007; Eder e Lutz-Meindl, 2008, 2010; Wanner et al., 2013; Lutz-Meindl et al., 2015). Além disso, as análises moleculares iniciais, incluindo a produção de linhas celulares transformadas, melhoraram ainda mais o uso de Micrasterias, especialmente na dinâmica molecular do processamento de paredes celulares (Vannerum et al., 2010, 2011, 2012).
O desmídio, o Penium margaritaceum, tornou-se também um valioso organismo modelo (Domozych et al., 2009, 2014; Sørensen et al., 2014; Rydahl et al., 2015; Worden et al., 2015). Ao contrário das Micrasterias, o Penium tem uma forma cilíndrica simples, possui apenas uma parede celular primária e deposita polímeros de parede em dois loci específicos da superfície celular durante a expansão (Domozych et al., 2011). Esta relativa simplicidade é altamente atractiva para elucidar os princípios fundamentais do desenvolvimento celular das plantas, incluindo o desenvolvimento da parede celular, expansão celular e dinâmica da secreção (Domozych et al., 2005, 2014; Ochs et al., 2014). Um de seus principais atributos é que possui polímeros de parede semelhantes aos presentes em muitas plantas terrestres (por exemplo, celulose, pectinas, hemiceluloses) e que estes polímeros podem ser rotulados com anticorpos monoclonais. Após a rotulagem das células vivas, estes podem ser devolvidos à cultura onde a expansão celular subsequente e os eventos de deposição na parede podem ser monitorizados (Domozych et al., 2009; Rydahl et al., 2015). O pênis também é facilmente mantido em laboratório e sua rápida taxa de crescimento sob condições precisamente controladas faz dele um excelente espécime para a triagem simultânea em larga escala de muitos agentes químicos (pelo crescimento em placas de poços múltiplos) e para a avaliação de seus efeitos específicos na expansão/desenvolvimento de paredes (Worden et al., 2015). Isto ajuda significativamente a revelar o papel de componentes e processos subcelulares específicos na expansão/diferenciação. Recentemente, o isolamento de linhas transformadas estáveis (Sørensen et al., 2014) aumentou ainda mais o potencial desta alga em futuros estudos de células vegetais.
Chara e Nitella: Gigantes Celulares para Fisiologia Vegetal
Espécies de Chara e Nitella (Charophyceae) têm sido usadas há muito tempo como espécimes para uma variedade de investigações biológicas, especialmente aquelas que lidam com a dinâmica celular, expansão e fluxo citoplasmático (Green, 1954; Probine and Preston, 1962). Seus tális macroscópicos são distinguidos por nós, onde surgem ramos e gametangia, e regiões internodais que consistem de células excepcionalmente alongadas. As células internodais exibem uma estratificação claramente notável dos componentes subcelulares, onde cloroplastos de orientação helicoidal definem um córtex estacionário que envolve um endoplasma onde ocorre o mais rápido fluxo citoplasmático gerado por actinomiosina. O citoplasma contém diversos componentes endomembrânicos que participam de redes dinâmicas de tráfico de membranas (por exemplo, endocitose e exocitose) que são controlados por cascatas complexas de transdução de sinal (Foissner e Wastenys, 2000, 2012, 2014; Sommer et al., 2015; Foissner et al., 2016). As células internodais possuem paredes celulares ricas em celulose e a pectina, homogalacturonan (HG). O turgor é a principal força motriz da expansão e a pectina é muito provavelmente o componente portador de carga que controla a expansão das paredes. A modulação cíclica, não enzimática e o complexo de cálcio simultâneo do HG é o mecanismo responsável pelo controle das modulações da parede que levam à expansão celular (Proseus e Boyer, 2007, 2008, 2012; Boyer, 2016). Uma das vantagens técnicas da Chara e da Nitella na pesquisa celular é que as células internodais podem ser removidas individualmente; endoplasma e paredes celulares podem ser “dissecadas” e depois usadas como sistemas acelulares para manipulação experimental.
Outros componentes do talo, como rizóides, têm organização polar organizada do citoplasma. Estas células contêm estatólitos sedimentáveis, ricos em minerais, localizados no ápice que funcionam na percepção da gravidade (Hodick et al., 1998; Braun, 2002; Braun e Limbach, 2006). Esta característica fez de Chara a primeira carófita no espaço. Durante os voos parabólicos dos foguetes TEXUS, foi demonstrado que os estatólitos exercem forças de tensão sobre os filamentos de actina. Um equilíbrio de forças (ou seja, a gravidade e a força contrária dos filamentos de actina) é responsável pelo posicionamento correcto dos estatólitos no rizóide que, por sua vez, garantem a capacidade de responder ao vector de gravidade (Braun e Limbach, 2006). O uso de pinças laser e microscopia de centrifugação de rotação lenta tem demonstrado que a sedimentação do estatólito não é suficiente para causar a flexão gravítica da ponta do rizóide. Ao invés disso, os estatólitos ricos em minerais devem assentar em regiões específicas da membrana plasmática para que os efeitos morfológicos gravitrópicos prossigam (Braun, 2002). Chara também tem sido usada para estudar outros fenômenos incluindo eletrofisiologia e o papel e movimento dos hormônios (Belby, 2016).
Coleochaete for Developmental Studies and Pattern Development
A formação de um talo multicelular (isto é, tecido, órgão) de uma planta requer planos de divisão celular precisos e regulados espacialmente que são controlados por múltiplos conjuntos de genes expressos em pontos específicos durante o desenvolvimento (Besson e Dumais, 2011; Umen, 2014). Dirigida tanto no espaço tridimensional quanto no tempo, a morfogênese do talo também se modula em resposta a fatores externos de estresse. Nas plantas, esses programas de desenvolvimento se tornam ainda mais complexos pela presença de paredes celulares que não permitem a migração celular ou a flexibilidade dos tecidos. A elucidação dos eventos específicos que são centrais para a manifestação da forma e tamanho do talo é frequentemente difícil de decifrar em plantas terrestres onde a resolução de comportamentos celulares específicos é muitas vezes mal resolvida quando embutida em tecidos/orgãos altamente complexos e expansivos. O uso de organismos com desenhos mais simples do talo tem sido vantajoso para a compreensão de fenômenos básicos de desenvolvimento e o gênero Coleochaete é um desses exemplos. Certas espécies (por exemplo, C. orbicularis, C. scutatum) produzem um talo parenquimatoso discóide que cresce para fora por uma combinação de divisões celulares anti- ou peri-clinais e subsequente expansão de suas células mais externas (Brown et al., 1994; Cook, 2004). O plano de divisão de qualquer célula segue regras simples que são baseadas no tamanho da célula, forma celular e localização geográfica no talo (Dupuy et al., 2010; Besson e Dumais, 2011). Esta característica permite a construção de modelos matemáticos que podem então ser usados para interpretar a morfogênese multicelular (Domozych e Domozych, 2014; Umen, 2014) e produzir uma visão crítica sobre a evolução, biomecânica e fisiologia dos órgãos e organismos inteiros. Além disso, algumas espécies de Coleochaete têm sido extensivamente estudadas para determinar as modulações estruturais e funcionais que ocorrem a um talo sob condições de dessecação (Graham et al., 2012), ou seja, características chave na compreensão da evolução inicial das plantas terrestres e da dinâmica de crescimento das plantas durante as secas.
Insights from Genomic and Gene Studies
Simplesmente a muitas outras tecnologias, as ferramentas moleculares têm a capacidade de transmitir novas informações importantes para muitas áreas de pesquisa, incluindo fisiologia e desenvolvimento. Por exemplo, membros da família genética MADS-box foram isolados e caracterizados a partir de três carófitas, Chara globularis, Coleochaete scutata e Closterium peracerosum-strigosum-littorale (Tanabe et al., 2005). O padrão de expressão dos genes da caixa MADS nas carófitas sugere que elas desempenham um papel no desenvolvimento e reprodução haplóide (Tanabe et al., 2005). Pensa-se que tenham sido recrutados para a geração diplóide, e que o seu papel no desenvolvimento se tenha diversificado ainda mais, durante a evolução da planta terrestre (Tanabe et al., 2005). Até hoje Klebsormidium flaccidum é a única carófita para a qual existe um genoma nuclear quase completo (Hori et al., 2014); embora os genomas cloroplástico e mitocondrial tenham sido sequenciados para representantes de cada uma das seis classes de carófitos e os ESTs (etiquetas sequenciais expressas) estão disponíveis para alguns carófitos (Delwiche et al., 2016). O genoma Klebsormidium já revelou a presença de genes para a síntese de vários hormônios vegetais e intermediários de sinalização, mecanismos de proteção contra a alta intensidade luminosa (Hori et al., 2014), e a presença de fatores de transcrição do Grupo IIb WRKY que anteriormente se pensava terem aparecido pela primeira vez em musgos (Rinerson et al., 2015). Vários projetos de seqüenciamento de genoma de carófitos estão atualmente em andamento (Delwiche, 2016) e permitirão análises comparativas mais detalhadas, incluindo um maior número de carófitos e potencialmente dar uma nova visão sobre as relações evolutivas entre espécies e genes. A posição única das carófitas como o primeiro grupo divergente de Streptophytes torna-as uma ferramenta particularmente poderosa para estudos de desenvolvimento evolutivo e tecnologias emergentes, tais como a recente conquista de transformação estável em Penium (Sørensen et al, 2014) permitirá explorar a função de genes específicos.
Usos Futuros de Carófitos como Organismos Modelo
Um próximo passo crítico na pesquisa de carófitos é a análise dos genomas dos taxa inclusivos e estudos comparativos com os das plantas terrestres. Este trabalho não só produzirá uma visão chave sobre os mecanismos adaptativos que as carófitas desenvolveram ao emergir e colonizar com sucesso os habitats terrestres, mas refinará e expandirá ainda mais o uso dos organismos modelo atuais na pesquisa fundamental de plantas. Embora os estudos moleculares apoiem muitas áreas de pesquisa, duas áreas que se beneficiarão imediatamente serão a biologia da parede celular e a dinâmica dos reguladores de crescimento no crescimento e desenvolvimento. Na primeira, as carófitas poderiam esclarecer muitos fenómenos básicos, mas mal resolvidos, incluindo a biossíntese da pectina e da proteína da parede celular, a secreção controlada, a deposição e as modulações pós-secretas dos polímeros de parede e as redes específicas e interactivas de tráfico de membranas em células vegetais. Neste último, modelos de carófitos ajudariam a decifrar a sinalização molecular, biologia celular e dinâmica de desenvolvimento do crescimento e desenvolvimento associados a hormônios como etileno e auxina. Os recentes estudos ecofisiológicos com carófitos também oferecem uma potencial bonança de dados críticos para determinar como as células vegetais se adaptam ao estresse, incluindo dessecação e tolerância ao sal (Holzinger e Karsten, 2013; Pichrtová et al., 2014; Herburger et al., 2015; Holzinger e Becker, 2015; Holzinger e Pichrtová, 2016; Kondo et al., 2016). O futuro da investigação de carófilos é de facto muito brilhante e tornar-se-á consequentemente uma bênção para toda a biologia vegetal.
Author Contributions
Todos os autores listados, fizeram uma contribuição substancial, directa e intelectual para o trabalho, e aprovaram-no para publicação.
Conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesses.
Conhecimento
Este trabalho foi apoiado pela NSF (USA) MCB collaborative grants 1517345 and 1517546.
Belby, M. J. (2016). Sistema experimental caracético multiescala: da eletrofisiologia de transportadores de membrana à conectividade célula a célula, fluxo citoplasmático e metabolismo de auxinas. Frente. Plant Sci. 7:1052. doi: 10.3389/fpls.2016.01052
CrossRef Full Text | Google Scholar
Braun, M. (2002). A percepção da gravidade requer estatólitos assentados em áreas específicas da membrana plasmática em rizóides e protonematos de caracea. Protoplasma 219, 150-159. doi: 10.1007/s007090200016
CrossRef Full Text | Google Scholar
Braun, M., e Limbach, C. (2006). Rizoides e protonematos de algas cáceas: células modelo para pesquisa sobre crescimento polarizado e detecção da gravidade de plantas. Protoplasma 229, 133-142. doi: 10.1007/s00709-006-0208-9
CrossRef Full Text | Google Scholar
Graham, L. E. (1993). Origem das Plantas Terrestres. Nova York, NY: John Wiley & Sons, 287.
Google Scholar
Herburger, K., e Holzinger, A. (2015). Localização e quantificação da calose no Streptophyte green alga Zygnema e Klebsormidium: correlação com a tolerância à dessecação. Plant Cell Physiol. 56, 2259-2270. doi: 10.1093/pcp/pcv139
CrossRef Full Text | Google Scholar
Lemieux, C., Otis, C., e Turmel, M. (2016). Análises comparativas do genoma cloroplástico de algas verdes estreptofitas revelam grandes alterações estruturais nas Klebsormidiophyceae, Coleochaetophyceae e Zygnematophyceae. Frente. Plant Sci. 7:697. doi: 10.3389/fpls.2016.00697
CrossRef Full Text | Google Scholar
Lutz-Meindl, U. (2007). Uso de microscopia eletrônica de transmissão de energia para geração de imagens e análise de elementos em organismos vegetais. Micron 38, 181-196. doi: 10.1016/j.micron.2006.03.017
CrossRef Full Text | Google Scholar
Meindl, U. (1993). Células de Micrasterias como um sistema modelo para pesquisa de morfogênese. Microbiol. Rev. 57, 415-433.
Google Scholar
Pichrtová, M., Kulichova, J., e Holzinger, A. (2014). A limitação de azoto e a secagem lenta induzem tolerância à dessecação na conjugação de algas verdes (Zygnematophyceae, Streptophyta) de habitats polares. PLoS ONE 9:e113137. doi: 10.1371/journal.pone.0113137
CrossRef Full Text | Google Scholar
Pickett-Heaps, J. D., e Marchant, H. J. (1972). A filogenia das algas verdes: uma nova proposta. Cytobios 6, 255-264.
Google Scholar
Stamenkovic, M., Woelken, E., e Hanelt, D. (2014). A ultraestrutura das cepas de Cosmarium (Zygnematophyceae, Streptiophyta) coletadas em várias localizações geográficas mostra diferenças específicas das espécies tanto em temperaturas ótimas quanto em temperaturas de estresse. Protoplasma 251, 1491-1509.
Google Scholar