Lewis structure of oxalate ion is drawn in this tutorial step by step. O conceito de electrões de valência total é usado para desenhar a estrutura de Lewis do C2O42-. Após terminar a estrutura de Lewis do C2O42-, deve haver uma carga de -2 e uma estabilidade. Você aprenderá sobre estas coisas neste tutorial.
Ionxalato | C2O42-
Ion carbonato tem uma carga de -2. Há dois átomos de carbono no íon oxalato.
C2O42- Estrutura de Lewis
Dois átomos de carbono são articulados a um átomo de carbono. Assim, outros dois átomos de oxigênio têm articulação com outros átomos de carbono. Na estrutura de lewis do íon C2O42, o íon é simétrico em torno da ligação C-C.
Passos do desenho da estrutura de lewis do C2O42-
Passos seguintes são necessários para desenhar a estrutura de C2O42- lewis e são explicados em detalhes neste tutorial.
- Passos totais de elétrons das conchas de valância dos átomos de carbono e oxigênio. Isto é usado para determinar o número de ligações, pares solitários ao redor dos átomos.
- Pares totais de electrões ao redor dos átomos
- Selecção do centro do átomo de acordo com a valência máxima
- Põe pares solitários nos átomos
- Verifica a estabilidade e minimiza as cargas nos átomos para construir a estrutura mais estável, convertendo pares solitários em ligações.
Como estes passos, os seguintes factos são importantes para desenhar a estrutura de lewis.
O oxigênio deve manter cargas negativas na estrutura do lewis porque o oxigênio gosta de manter elétrons do que o átomo de carbono.
Electronegatividade do oxigênio é maior do que o carbono.
Desenhar a estrutura lewis correta é importante para desenhar estruturas de ressonância de CO32- corretamente.
Número total de elétrons das conchas de valância de C2O42-
Carbono está localizado no grupo 4 da tabela periódica. Portanto, o carbono tem quatro elétrons em sua concha de valência. O oxigénio está localizado no 6º grupo. Ele tem seis elétrons na sua casca de valência.
- Total de elétrons de valência dados por átomos de carbono = 4 * 2 = 8
Existem quatro átomos de oxigênio em C2O42- íon, Portanto
- Total de elétrons de valência dados por átomos de oxigênio = 6 *4 = 24
Existem -2 carga em C2O42- íon. Portanto existem mais dois electrões que contribuem para os electrões de valência.
- Total de electrões de valência = 8 + 24 + 2 = 34
Total de pares de electrões de valência
Total de pares de electrões de valência = σ ligações + π ligações + pares isolados nas conchas de valência
Total de pares de electrões são determinados dividindo o número total de electrões de valência por dois. Para, C2O42- íon, os pares totais de elétrons são 17,
Átomo central de C2O42- íon
Para ser o átomo central, a capacidade de ter uma valência mais alta é importante. O carbono tem mais chance de ser o átomo central (Veja a figura) porque o carbono pode mostrar valência de 4. A valência mais alta do oxigênio é 2. Então, agora podemos construir um esboço de C2O42- íon.
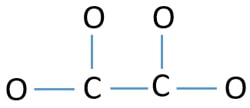
Pares solitários nos átomos
- Existem quatro ligações C-O e uma ligação C-C no esboço acima fazendo cinco ligações. Portanto, apenas doze (17-5 = 12) pares de elétrons de valência são restantes.
- Primeiro, marque esses doze pares de elétrons de valência como pares solitários em átomos externos (em átomos de oxigênio). Um átomo de oxigênio levará três pares solitários seguindo a regra octal (o átomo de oxigênio não pode manter mais de oito elétrons em sua concha de valência).
- Para quatro átomos de oxigênio, doze pares de elétrons são gastos. Agora, não há mais pares solitários para marcar em átomos de carbono após marcar pares solitários em átomos de oxigênio (átomos externos).
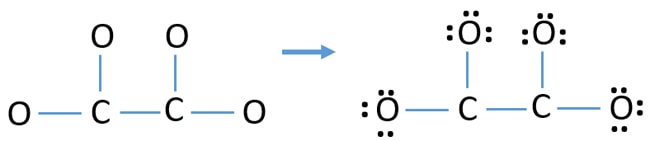
Cargas em átomos
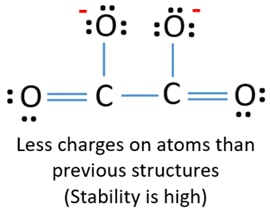
Depois, marcando pares de elétrons em átomos (neste caso, apenas em átomos de oxigênio), devemos marcar cargas de cada átomo se houver uma carga. A marcação de cargas é significativa porque é usada para determinar a melhor estrutura de lewis do íon. Após marcar as cargas, você verá, cada átomo de oxigênio terá uma carga -1 e ambos os átomos de carbono terão uma carga +1.
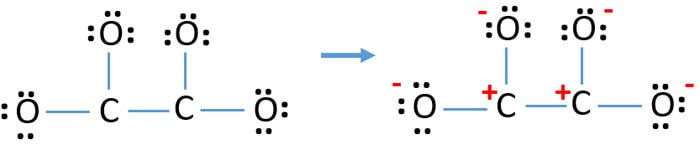
Esta estrutura é muito instável porque há cargas em toda parte do íon.
Verifica a estabilidade e minimiza as cargas nos átomos convertendo pares solitários em ligações
- Os átomos de oxigénio devem ter cargas negativas porque a electronegatividade do átomo de oxigénio é superior à do átomo de carbono. Caso contrário, podemos dizer que a capacidade de manter cargas negativas é maior nos átomos de oxigênio do que nos átomos de carbono.
- A estrutura desenhada não é estável porque todos os átomos têm uma carga (a estrutura de Lewis deve ser estável com menos cargas).
- Agora, devemos tentar minimizar as cargas convertendo o par ou pares isolados em ligações. Então converta um par ou pares solitários de um átomo de oxigênio para fazer uma ligação C-O.
- Agora existe uma ligação dupla entre um átomo de carbono e um átomo de oxigénio (uma ligação C=O). Agora, há três ligações simples entre um átomo de carbono e outros três átomos de oxigênio (duas ligações C-O).
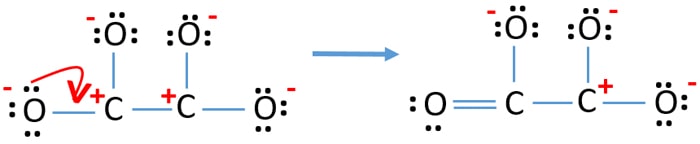
Na nova estrutura, as cargas de átomos são reduzidas do que na estrutura anterior. Agora não há carga em um átomo de oxigênio e em um átomo de carbono. Mas, ainda há cargas em três átomos de oxigênio (têm -1 cargas negativas) e outro átomo de carbono. Agora você entende que esta estrutura de C2O42- é mais estável do que a estrutura anterior. Mas, nós tentamos reduzir as cargas tanto quanto se for possível.
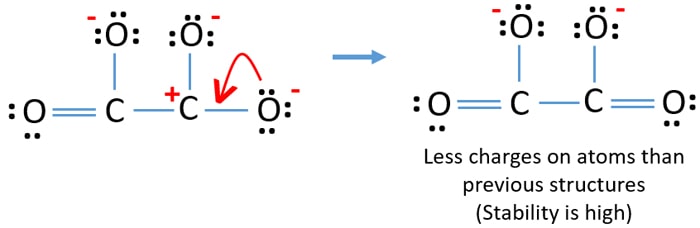
Reduzir cargas além disso
Você pode converter um par único de outro átomo de oxigênio em uma ligação C-O como abaixo.
>
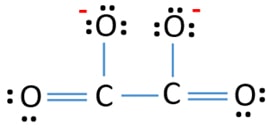
Lewis structure of C2O42- (carbonato) ion
Perguntas
Perguntas de química e encontrar as respostas
Tutoriais relacionados